通心络对脑缺血再灌注大鼠TLR4和NF-κB表达的影响①
2020-04-13李佳佳朱云波康玲伶
李佳佳 朱云波 康玲伶 朱 江
(承德医学院附属医院神经内科,承德 067000)
缺血性脑卒中是危害人类健康的高发病之一,目前缺血性脑卒中的发病机制尚未明了,但研究表明,炎症反应参与缺血性脑卒中的发生与发展,Toll样受体4 (Toll-like receptor 4,TLR4) 通过介导核转录因子(nuclear factor-κB,NF-κB)的激活,促进其下游炎症因子IL-6、IL-1β及TNF-α等的表达,从而放大炎症信号[1,2]。通心络是有脉络学说指导组方的中成药,具有活血通络、搜风解痉的功效,是临床上治疗冠心病和缺血性脑卒中的主要用药,大量文献报道通心络可通过保护血管及神经损伤治疗缺血性脑卒中[3,4],但通心络能否介导TLR4/NF-κB通路对缺血性脑卒中产生疗效尚未报道。故本文旨在建立大鼠脑缺血再灌注(cerebral ischemia reperfusion,I/R)模型,观察不同剂量通心络的药效及具体效用机制。
1 材料与方法
1.1材料
1.1.1实验动物 健康雄性SD大鼠50只,4月龄,体质量(300±20)g,由武汉华联科生物技术有限公司提供,许可证号:SCXK(鄂)2018-0028,饲养于清洁级动物房中,自由摄食饮水,适应性喂养7 d后用于后续试验中。
1.1.2试剂与仪器 通心络(石家庄以岭药业股份有限公司,国药准字:Z19989915),尼莫地平(山东新华制药股份有限公司,国药准字:H10910080),TUNEL试剂盒(Roche公司),IL-6、IL-1β及TNF-αELISA试剂盒(美国R&D公司),Caspase-3、TLR4、p65、p-p65及β-Actin抗体(美国Sigma-Aldrich公司),HRP标记的山羊抗兔二抗或小鼠二抗(美国Santa Cruz公司);JS-1075化学发光全自动化学发光图像分析系统(上海培清科技有限公司);GRME-LUX2-3L光学显微镜(日本Kyowa公司)。
1.2方法
1.2.1模型制备 采用改良Longa法[5]建立脑缺血再灌注模型,腹腔注射10%的水合氯醛麻醉大鼠,仰卧固定;小心开脑,分离出右侧颈总动脉、颈内动脉及颈外动脉,结扎颈总动脉和颈外动脉根部,于颈总动脉靠近分叉口处开孔后插入线栓,从颈总动脉通过颈内动脉一直插入到大脑中动脉处;局灶性脑缺血90 min后去掉线栓,进行再灌注。假手术组按照上述方法分离右侧颈总动脉、颈内动脉及颈外动脉,但不作结扎和插入线栓处理。术后各组大鼠分笼饲养,并注意保温。
1.2.2分组与给药 将50只SD大鼠随机分为5组:假手术组(Sham)、模型组(I/R)、通心络低、高剂量组(0.5 g/kg、2 g/kg)和尼莫地平组(2 mg/kg),每组10只;造模成功后,通心络按0.5 g/kg、2 g/kg,尼莫地平按2 mg/kg灌胃给药,连续给药10 d;Sham组和I/R组以生理盐水替代。
1.2.3样品采集 收集各组大鼠眼底静脉血2 ml,3 000 r/min离心10 min,取上清即为血清,置于-80℃冰箱保存备用;腹腔注射10%的水合氯醛麻醉大鼠,快速断头,冰上迅速开颅取脑,置于液氮罐中保存备用。
1.2.4神经功能缺损评分 参照Longa评分对各组大鼠神经功能学进行评价[6],分值为0~5分,其中无神经缺损症状为0分,不能完全伸展对侧前爪为1分,行走时向偏瘫侧转圈为2分,行走时向偏瘫侧倾倒为3分;不能自发行走、意识受到抑制为4分,死亡为5分。剔除死亡大鼠,并补足各组大鼠数目。
1.2.5脑梗死体积的测量 取出脑组织,以2 mm间距切片,置于0.5%TTC缓冲液中,避光条件下37℃孵育30 min;固定于4%多聚甲醛中,用数码相机拍照,应用软件Image J扫描图片,计算脑梗死区所占百分比(相较于对侧脑体积)。
1.2.6病理学形态检测 取出脑组织置于4%多聚甲醛液中固定4 h,作常规石蜡切片,梯度乙醇脱水后行HE染色,显微镜下观察大鼠脑组织细胞形态的变化。
1.2.7TUNEL检测脑组织中细胞凋亡 取出脑组织作常规石蜡切片,二甲苯浸洗10 min脱蜡,梯度乙醇浸洗,滴加蛋白酶 K增加细胞通透性,37℃下孵育20 min,滴加50 μl TUNEL反应混合液加盖玻片,避光条件下37℃孵育1 h,滴加50 μl converter-POD加盖玻片,避光条件下37℃孵育30 min,加100 μl DAB混合液,室温下反应10 min,苏木素复染3 s后冲洗,梯度乙醇脱水、二甲苯透明、中性树胶封片。显微镜下计数凋亡细胞数目(凋亡的细胞被染色),随机挑选5个视野(200~500个细胞)计数并拍照。
1.2.8ELISA检测脑组织中血清因子的含量 取出血清样本,参照ELISA试剂盒说明书,检测大鼠血清中白介素6(IL-6)、白介素1β(IL-1β)和肿瘤坏死因子α(TNF-α)的含量。
1.2.9Western blot检测脑组织中Caspase-3、TLR4及NF-κB p65的表达 取出脑组织,剪碎后置于RIPA裂解液中匀浆,冰上静置裂解40 min,4℃下9 000 r/min 离心10 min,去上清测蛋白浓度,定量后置于沸水浴中变性10 min;配制SDS-PAGE凝胶,点蛋白样电泳,当溴酚蓝跑至底部时停止电泳,转膜2 h,封闭2 h,分别置于兔抗含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase-3,Caspase-3)、TLR4、p65、p-p65及β-actin抗体(稀释比为1∶1 000)中,4℃孵育过夜;清洗后,加HRP标记的山羊抗兔二抗或小鼠二抗(稀释比为1∶8 000),室温孵育40 min;应用JS-1075化学发光全自动化学发光图像分析系统进行曝光拍照。应用软件Image J扫描图片,以β-actin为内参,计算Caspase-3、TLR4、p65的相对表达量。

2 结果
2.1通心络对脑缺血再灌注大鼠神经行为学评分和脑梗死体积的影响 与Sham组相比,I/R组大鼠神经行为学评分、脑梗死体积显著升高(P<0.05);通心络低、高剂量组和尼莫地平组大鼠神经行为学评分、脑梗死体积显著降低(P<0.05),通心络组具有剂量依赖性,见表1。
2.2通心络对脑缺血再灌注大鼠病理学形态的影响 HE染色如图1所示,Sham组神经元细胞呈圆形,且形态正常、结构完整、排列整齐,细胞内未见水肿、空泡、核固缩现象,无炎性细胞浸润;I/R组神经元细胞呈梭形或三角形,且结构模糊、排列紊乱,细胞间距增大,细胞内出现明显水肿、空泡和核固缩现象,有炎性细胞浸润;相较于I/R组,通心络低、高剂量组和尼莫地平组细胞形态与结构明显改善,周围细胞水肿、空泡和核固缩现象减轻。
2.3通心络对脑缺血再灌注大鼠脑组织细胞凋亡的影响 如图2所示,与Sham组相比,I/R组大鼠脑组织细胞凋亡数、Caspase-3的表达显著升高(P<0.05);通心络低、高剂量组和尼莫地平组大鼠脑组织细胞凋亡数、Caspase-3的表达显著降低(P<0.05),通心络组具有剂量依赖性。
2.4通心络对脑缺血再灌注大鼠血清IL-6、IL-1β及TNF-α水平的影响 如图3所示,与Sham组相比,I/R组大鼠血清IL-6、IL-1β及TNF-α水平显著升高(P<0.05);通心络低、高剂量组和尼莫地平组大鼠血清IL-6、IL-1β及TNF-α水平显著降低(P<0.05),通心络组具有剂量依赖性。


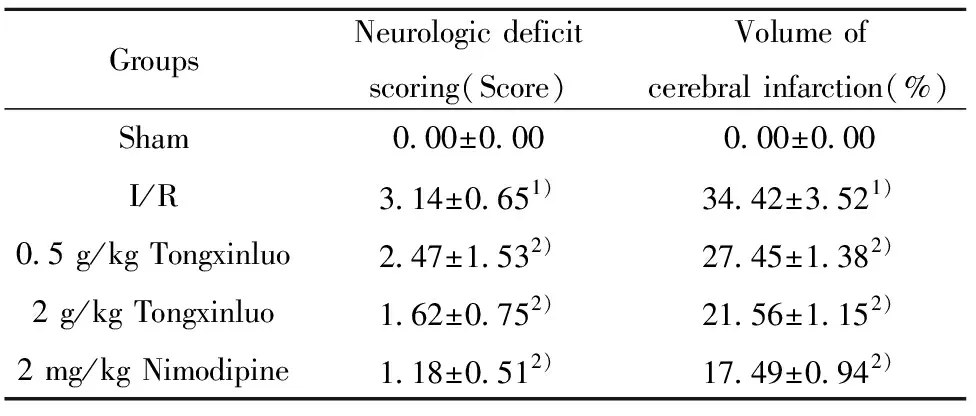
GroupsNeurologic deficitscoring(Score)Volume ofcerebral infarction(%)Sham0.00±0.000.00±0.00I/R3.14±0.651)34.42±3.521)0.5 g/kg Tongxinluo2.47±1.532)27.45±1.382)2 g/kg Tongxinluo1.62±0.752)21.56±1.152)2 mg/kg Nimodipine1.18±0.512)17.49±0.942)
Note:I/R vs.Sham,1)P<0.05;Tongxinluo,Nimodipine vs.I/R,2)P<0.05.

图1 通心络对脑缺血再灌注大鼠病理学形态的影响(HE,×400,n=5)Fig.1 Effects of Tongxinluo on pathological morphology of rats with cerebral ischemia-reperfusion(HE,×400,n=5)Note: A.Sham;B.I/R;C.0.5 g/kg Tongxinluo;D.2 g/kg Tongxinluo;E.2 mg/kg Nimodipine.

图2 通心络对脑缺血再灌注大鼠脑组织细胞凋亡的影响(n=5)Fig.2 Effects of Tongxinluo on apoptosis of brain tissues in rats with cerebral ischemia-reperfusion(n=5)Note: A.Sham;B.I/R;C.0.5 g/kg Tongxinluo;D.2 g/kg Tongxinluo;E.2 mg/kg Nimodipine;I/R vs.Sham,#.P P

图3 通心络对脑缺血再灌注大鼠血清IL-6、IL-1β及TNF-α水平的影响(n=5)Fig.3 Effects of Tongxinluo on serum IL-6,IL-1β and TNF-α levels in rats with cerebral ischemia-reperfusion(n=5)Note: I/R vs.Sham,#.P P
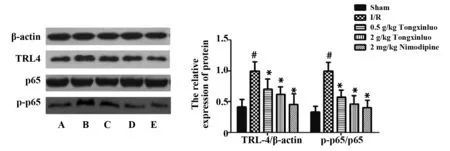
图4 通心络对脑缺血再灌注大鼠脑组织中TLR4、NF-κB p65表达的影响(n=5)Fig.4 Effects of Tongxinluo on expression of TLR4 and NF-κB p65 in brain tissue of rats with cerebral ischemia-reperfusion(n=5)Note: A.Sham;B.I/R;C.0.5 g/kg Tongxinluo;D.2 g/kg Tongxinluo;E.2 mg/kg Nimodipine;I/R vs.Sham,#.P P
2.5通心络对脑缺血再灌注大鼠脑组织中TLR4、NF-κB p65表达的影响 如图4所示,与Sham组相比,I/R组大鼠脑组织中TLR4、NF-κB p65表达显著升高(P<0.05);通心络低、高剂量组和尼莫地平组大鼠脑组织中TLR4、NF-κB p65表达显著降低(P<0.05),通心络组具有剂量依赖性。
3 讨论
通心络由人参、水蛭、全蝎、土元、蜈蚣、蝉蜕、赤芍、冰片、檀香、降香、乳香、酸枣仁等组成,可用于治疗气虚血瘀络阻型脑卒中[7]。据报道,通心络可靶向兴奋性氨基酸毒性、钙超载、自由基、炎症反应、细胞凋亡等,保护脑组织细胞[8],但通心络介导TLR4/NF-κB信号通路对脑卒中的影响报道较少。本研究通过改良Longa法处理大鼠,成功复制脑缺血再灌注(I/R)模型,发现通心络可明显改善I/R大鼠神经行为学评分并减少脑梗死体积,与谭辉等[9]研究结果一致,提示通心络可以缓解缺血再灌注脑损伤。
TLR4是重要的调控先天性免疫功能的效应分子,参与多种疾病的病理生理过程,主要表达于防御功能的细胞中[10]。TLR4通过与接头蛋白髓样分化因子88、白细胞介素相关激酶等结合,激活NF-κB p65和MAPKs信号通路,诱发炎性细胞因子(如TNF-α、IL-1β、IL-6等)的分泌,最终导致机体过度炎症反应[11]。IL-6、TNF-α是重要的促炎因子,其过度分泌会引起局部炎症反应,损伤器官;IL-1β是主要的炎症调节因子,可以诱导促炎因子的产生,放大炎症信号[12]。通心络胶囊是传统的抗炎中成药,其中人参、冰片、檀香、降香等成分均具有良好的抗炎活性[13,14],本研究发现通心络可明显减少血清IL-6、IL-1β及TNF-α水平和脑组织中TLR4 及NF-κB p65的表达,提示通心络可能通过下调TLR4/NF-κB信号,减少IL-6、IL-1β及TNF-α等炎性因子的分泌,从而降低脑缺血损伤后的炎症级联反应。
此外,TLR4/NF-κB信号通路还参与细胞增殖、分化、凋亡等生理过程[15]。细胞凋亡过程是凋亡相关基因表达的结果,同时受细胞内外多种基因调控,Caspase-3是凋亡过程中重要的执行蛋白[16]。本研究发现通心络可明显下调Caspase-3水平,抑制脑组织细胞的凋亡,起到脑组织保护作用,且高剂量组效果显著,与位庚等[17]报道通心络在受损心肌微血管内皮细胞中的效用相似。
综上所述,通心络可保护脑缺血再灌注对大鼠脑组织产生的损伤,可能与下调TLR4/NF-κB信号通路有关;但本研究仅在动物水平探讨,尚需开展细胞实验作进一步验证。
