盐酸安罗替尼治疗晚期非小细胞肺癌的疗效及安全性
2020-04-13曹梦函陈昊韩正祥杜秀平
曹梦函,陈昊,韩正祥,杜秀平
1.徐州医科大学附属医院肿瘤内科,江苏徐州 221000;2.徐州医科大学附属医院呼吸内科,江苏徐州 221000
研究发现, 对于初治后进展或复发的晚期非小细胞肺癌(NSCLC),二线治疗采用单药化疗控制肿瘤进展的效果不佳,特别是对于存在基因突变的NSCLC 患者,不能有效延长生存时间[1]。NSCLC 靶向治疗是近年临床研究热点之一,目前已发现数个靶点,抗血管生成的酪氨酸激酶抑制剂用于治疗NSCLC 在前期研究中也已收到显著临床效果[2]。 盐酸安罗替尼是我国自主研发的靶向治疗药物,经研究证实对晚期NSCLC、甲状腺髓样癌等多种恶性肿瘤有效,而且毒性反应可控,用于NSCLC三线治疗效果显著且安全可靠[3]。 但是目前,临床关于该品用于晚期NSCLC 二线治疗以及该品联合其他药物治疗晚期NSCLC 的研究和报道较少, 文章方便择取2017 年6 月—2019 年6 月该院收治的114 例晚期NSCLC 患者为例,探究其应用疗效及安全性,以期为临床用药治疗提供依据和参考,报道如下。
1 资料与方法
1.1 一般资料
从该院收治的晚期NSCLC 患者中方便择取114 例为研究对象, 依据治疗方法不同分为3 组。 A 组(38例):男23 例,女15 例;年龄48~73 岁,平均(60.8±11.3)岁;腺癌26 例,鳞癌12 例;TNM ⅢIIIb 期10 例,IV 期28 例;二线治疗13 例,三线治疗25 例。 B 组(38例):男24 例,女14 例;年龄46~74 岁,平均(61.0±12.1)岁;腺癌24 例,鳞癌13 例,腺鳞癌1 例;TNM ⅢIIIb 期12 例,IV 期26 例;二线治疗12 例,三线治疗26例。 C 组(38 例):男22 例,女16 例;年龄44~75 岁,平均(60.5±12.8)岁;腺癌26 例,鳞癌11 例,腺鳞癌1 例;TYNM ⅢIIIb 期11 例,IV 期27 例;二线治疗14 例,三线治疗24 例。 3 组基线资料两两比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:病理组织学证实晚期NSCLC,TNM ⅢIIIb 期或IV 期,既往未行外科手术,有药物治疗史,后进展或复发, 该次为二线或三线治疗, 化疗用药多西他赛;年龄18~75 岁者;CT 检查显示至少有一个可测量靶病灶, 病灶最长径≥1 cm, 满足实体瘤疗效评价标准(RECIST);美国东部肿瘤协作组(ECOG)体能状态评级0~2 级;合并表皮生长因子受体(EGFR)基因突变或间变性淋巴瘤激酶(ALK)阳性;预计生存期≥3 个月;研究经过伦理委员会批准,患者及家属知情同意。
排除标准: 合并小细胞肺癌;75 岁以上高龄老人;近1 个月内抗肿瘤治疗史者;合并其他严重内科疾病,不能配合治疗或影响疗效评价者;大咯血高危风险者;存在症状性脑转移者;既往靶向治疗史;无法吞咽药物者;治疗不足3 个周期,未获得完整临床资料者。
1.3 方法
A 组常规化疗,患者用药多西他赛注射液(国药准字H20020543;规格:0.5 mL∶20 mg)。 用法用量:用药前, 预防性口服或静滴地塞米松减少水钠潴留及抗过敏,肌注异丙嗪预防药源性恶心呕吐,患者每次用药75 mg/m2,缓慢静脉滴注,第1 天给药,21 d 为1 个周期,具体用药时机和剂量根据患者不良反应程度及耐受情况适当调整, 用药至患者病情进展或出现明显不耐受时结束治疗。
B 组患者用药盐酸安罗替尼胶囊 (国药准字H20180004;规格12 mg×7 s)。用法用量:12 mg/d(1片),口服,连服2 周(14 d),停药1 周(7 d),21 d 为1 个周期,期间密切监测患者不良反应,适时予以对症治疗、停药和(或)调整剂量等方式处理,用药至患者病情进展或出现明显不耐受时结束治疗。
C 组患者以常规化疗联合盐酸安罗替尼治疗,患者化疗用药与治疗方案同A 组, 在此基础上加用盐酸安罗替尼口服,具体用药方法及疗程同B 组。
1.4 观察指标与评价标准
于治疗前1 d 及治疗3 个周期后复查CT, 评价3组疗效。 疗效评价参照RECIST1.1 版,非淋巴结病变完全消融,淋巴结短轴<1 cm—完全缓解(CR);肿瘤负荷减少≥30%—部分缓解(PR),出现新病灶或原有肿瘤负荷增加≥20%—疾病进展(PD);不符合CR/PR/PD 标准—疾病稳定(SD)。 统计3 组肿瘤客观缓解率(ORR,CR 与PR 患者占比)与疾病控制率(DCR,CR、PR 与SD患者占比)。 对3 组进行长期随访,记录3 组无进展生存期(PFS,入组至疾病发生进展的时间)与总生存期(OS,入组至任何原因引起死亡的时间)。 另外,统计3组用药后不良反应发生率, 参照NCI-CTCAE 4.0 版标准评价不良反应严重程度,以III 级及以上为严重不良反应。
1.5 统计方法
数据以SPSS 21.0 统计学软件统计分析,计量资料以(±s)表示,多组差异比较以F 检验,计数资料以频数及百分比(%)表示,组间差异比较以χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效评价
B 组ORR 与DCR 高于A 组, 差异有统计学意义(χ2=5.112、6.917,P<0.05),C 组ORR 与DCR 高于A 组差异有统计学意义(χ2=6.138、9.708;P<0.05),C 组ORR与DCR 高于B 组,差异有统计学意义(χ2=4.853、5.081,P<0.05),见表1。
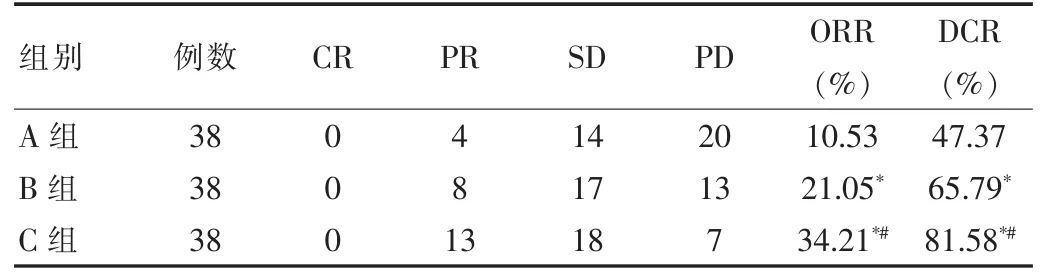
表1 3 组患者近期疗效评价比较
2.2 远期生存评价
B 组PFS 长于A 组,C 组PFS 长于A 组和B 组,差异有统计学意义(F=132.900,P<0.05),B 组、C 组OS 长于A 组,差异有统计学意义(t=15.730,P<0.05),见表2。
表2 3 组远期疗效比较[(±s),月]
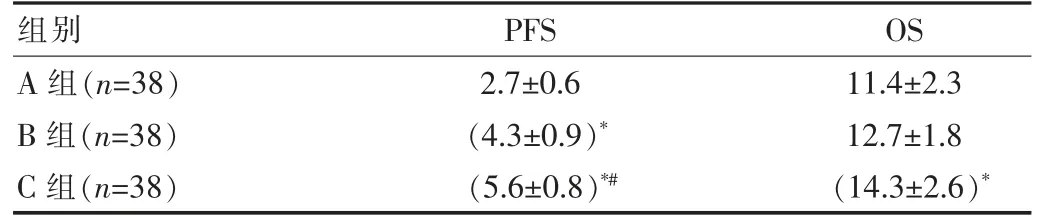
表2 3 组远期疗效比较[(±s),月]
注:与A 组比较*P<0.05,与B 组比较#P<0.05
?
2.3 用药安全性评价
3 组胃肠道症状、肝肾功能损伤、乏力发生率差异无统计学意义(P>0.05),B、C 两组高血压、手足综合征发生率高于A 组,差异有统计学意义(P<0.05),但B、C两组间高血压、 手足综合征发生率差异无统计学意义(P>0.05),见表3。 不良反应程度方面,A 组严重不良反应4 例(10.53%),B 组严重不良反应5 例(13.16%),C组严重不良反应5 例(13.16%),组间差异无统计学意义(P>0.05)。

表3 3 组患者主要不良反应发生率比较[n(%)]
3 讨论
靶向治疗其优势在于药物特异性与致癌位点结合发生作用,精准度高,可以提高肿瘤细胞杀灭效果,同时减少对肿瘤周围正常组织细胞的毒性作用, 减少不良反应[4]。
盐酸安罗替尼是近年新应用于临床的一种小分子酪氨酸激酶抑制剂,属于多靶点型血管靶向药物[5],可以抑制血管内皮生长因子(VEGF)、VEGF 受体(VEGFR)、血小板衍生生长因子(PDGFR)和干细胞因子受体(MGF)等多靶点[6]。 血管生成是恶性肿瘤重要特征,国外有研究发现[7-8],遗传和表观遗传可以诱导血管肿瘤表型转变为新血管生成, 为恶性肿瘤提供营养, 从而加速生长、增殖和转移。 盐酸安罗替尼作为血管靶向药物,可以通过特异性抑制血管生成生长因子等机制来阻断血管生成,从而诱导肿瘤细胞凋亡。 由于抑制靶点多,盐酸安罗替尼较一般的抗血管生成靶向药物的抗肿瘤作用效果更强[9]。 该品为我国自主研发靶向药物,ⅡII 期临床研究证实以该品治疗三线及以上小细胞肺癌,PFS延长了3.4 个月,疾病进展风险降低81.%[10]。 该品在临床上目前也主要用于晚期NSCLC 的三线及以上治疗,但也有关于一、二线治疗的报道[11]。 有学者指出[12],安罗替尼单药使用即有明显的抗肿瘤效果,但以此联合化疗使用, 可以发挥抗肿瘤叠加效用, 有助于逆转化疗耐药,增强敏感性。一项研究显示[13],以化疗联合盐酸安罗替尼二线治疗晚期NSCLC,疾病控制率达100%,有望成为NSCLC 治疗新选择。该次临床研究中,C 组以化疗联合盐酸安罗替尼二线或三线治疗晚期NSCLC, 结果显示患者ORR 34.21%,DCR 81.58%,均优于两种药物单一使用,PFS(5.6±0.8)月,也明显延长,与徐寿华等[14]报道安罗替尼治疗晚期NSCLC 的ORR(35.5%)和PFS(78.0%)相近,与丁海樱等[15]报道的安罗替尼治疗晚期NSCLC 的PFS(5.8±0.7)月也基本相当。 关于联合用药提高疗效, 可能原因为盐酸安罗替尼的使用消退或缩窄了肿瘤血管,降低了管壁通透性,可以促使化疗药物在肿瘤部位更好地发挥作用。 不良反应方面,B、C 两组差异无统计学意义(P>0.05),提示盐酸安罗替尼联合化疗用药不良反应可控,与文献报道结论也存在一致性[16],肯定了联合治疗的有效性与可行性。
综上所述, 盐酸安罗替尼治疗晚期非小细胞肺癌效果优于常规化疗, 且不会明显增加或加重安罗替尼用药不良反应,安全性稳定。
