人卵巢癌裸鼠皮下移植瘤模型的建立
2020-04-13卢晓莉成乐楠秦方圆赵子仪葛利葱翟亚萍杨秋云
卢晓莉,成乐楠,秦方圆,赵子仪,葛利葱,翟亚萍,杨秋云
(1.河南大学,河南 开封 475000;2.河南大学人民医院/河南省人民医院,河南 郑州 450003;3.吉林大学,吉林 长春 130023;4.河南省眼科重点实验室,河南 郑州 450003)
卵巢癌是女性常见的生殖系统恶性肿瘤,发病率仅次于宫颈癌和子宫体癌,死亡率居妇科肿瘤死亡率的第1位,占女性恶性肿瘤死亡率的5%[1-2]。据统计,2018年有将近30万新增卵巢癌病例[3]。早期诊断困难,发病时70%~75%患者已处于晚期,5年生存率约为20%[4]。目前对卵巢癌的治疗原则仍以手术为主,辅以化疗、放疗等综合治疗,但效果并不显著。尽管卵巢癌治疗在分子和细胞水平已经取得了实质性的进展,但研究表明,其晚期疾病的长期存活率几乎没有提高[5]。卵巢癌的诊治仍需进一步研究。因此,为研究人类卵巢癌生物学行为和抗肿瘤实验性治疗,需建立卵巢癌的动物模型。尽管国内外有较多成功建立卵巢癌移植瘤的模型[6-7],但对小鼠模型建立的具体方法及成瘤情况的相关报道并不多,且各项研究中肿瘤细胞系的选择,具体接种细胞数量均不同。本研究采用人卵巢癌SKOV3悬浮细胞液皮下注射接种法构建裸鼠卵巢癌皮下移植瘤模型,动态观察记录裸鼠成瘤情况并探讨移植瘤可用于实验的时机。
1 材料与方法
1.1 主要试剂与仪器试剂:DMEM/F12培养基(美国Gibco公司)、胰酶(美国Gibco公司)、双抗青链霉素(美国Hyclone公司)、PBS缓冲液(美国Hyclone公司)、血清(美国Gibco公司);仪器:巴氏管、15 mL离心管、离心机、酒精灯、培养箱、细胞计数板等。
1.2 实验动物及细胞SKOV3细胞株:购自广州赛业生物科技有限公司,培养于DMEM/F12完全培养基中(即含10%FBS,1%青链霉素的DMEM/F12培养基,5 mL培养基/25 cm2培养瓶),置于5% CO2、37 ℃、95%饱和湿度培养箱中培养。每48 h换液1次,细胞融合度达80%后进行1∶3传代。裸鼠:BALB/c Nude鼠,雌性,5~6周龄,体质量18~20 g,购自北京维通利华实验动物公司,饲养于河南省中药研究所,生长所需的垫料、饲料和饮水均经灭菌处理,高效过滤器每小时换气10~15次,相对湿度保持在45%~60%,每日保持10 h的光照,14 h无光的阴暗周期。
1.3 人卵巢癌移植瘤模型的建立将培养中处于对数生长的SKOV3细胞经2.5 g·L-1胰蛋白酶消化后,用PBS缓冲液洗涤,调整活细胞浓度为2×107个·mL-1,于每只裸鼠背部皮下接种0.2 mL(每只4×106个细胞)。穿刺点距离注射部位1.0 cm,每只裸鼠皮下接种1点,次日记为接种第1天。
1.4 裸鼠生活情况及肿瘤生长情况观察裸鼠接种肿瘤细胞后继续于SPF级层流室内饲养,每天观察其精神、活动、摄食等状况,是否有肿瘤生长和肿瘤生长速度等。每3 d测量1次荷瘤裸鼠体质量,每3 d用游标卡尺测量肿瘤结节的长径、短径,根据公式:体积=1/2×长×宽2,计算结节体积,并做详细记录,比较各组间肿瘤大小的差异。观察结束后,采用二氧化碳安乐死自动仪,将裸鼠安乐死,连同包膜完整剥离出肿瘤组织,对瘤体体质量进行称量。
1.5 移植瘤病理观察将完整剥除的移植瘤组织用40 g·L-1的甲醛溶液进行常规固定,制备石蜡包埋切片,制作常规4 μm切片,进行HE染色;常规无水乙醇脱水,二甲苯透明,中性树脂封片。在光学显微镜下观察。
2 结果
2.1 裸鼠成瘤情况及肿瘤生长情况接种SKOV3细胞前,实验组裸鼠的体质量、精神、活动等情况与对照组无明显差异。实验组裸鼠体质量为(19.47±0.74)g,对照组裸鼠体质量为(19.53±0.64)g,两组裸鼠体质量比较,差异无统计学意义(P>0.05),具有可比性。实验组中有1只裸鼠在观察期内未发现明显的移植瘤体出现,余14只裸鼠接种第3~7天在裸鼠接种部位可见或可触及皮下结节质硬,成瘤率为93.33%。整个观察期内,实验组裸鼠的体质量、精神、活动等情况与对照组对比,差异无统计学意义。观察期间未见瘤体表面皮肤破溃,直至42 d观察结束当天发现2例瘤体表面皮肤破溃。整个观察期间,瘤体体积随时间逐渐增大,接种30 d时可见肿瘤体积明显增大。见表1。整个观察期处死裸鼠后完整剥离瘤体,测得肿瘤质量(0.88±0.19)g。
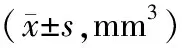
表1 不同时间瘤体体积
2.2 裸鼠移植瘤大体观察及病理形态观察大体观察移植瘤呈圆形或椭圆形,表面未破溃的移植瘤与周围组织轻度粘连,容易剥离。但出现破溃的2个移植瘤与瘤体皮肤粘连密切,剥离较困难。肿块质地中等,将瘤体切开,剖面呈鱼肉状,有分叶,色灰白,有4例体积较大的移植瘤中央区域可见坏死液化。HE染色后光学显微镜观察可见肿瘤细胞丰富,排列密集,细胞异型性明显,核大深染,细胞核质比例明显增大,畸形核和核分裂相多见。细胞内可见大量空泡,少数细胞核固缩,裂解,偶见凋亡细胞。肿瘤组织内有较多坏死组织和炎症细胞浸润,纤维化形成明显。见图1。

图1 裸鼠移植瘤组织HE染色(×200)
3 讨论
裸鼠肿瘤模型作为人类研究肿瘤生物学特性以及临床治疗的实验模型,其可以保留原发肿瘤本身的形态特征及遗传性[8]。卵巢癌动物模型是探索人卵巢癌生物学特征、治疗方法或评估疗效的重要研究工具。目前,卵巢癌动物模型的制备主要包括诱发性肿瘤模型和移植性肿瘤模型。移植性肿瘤模型的建立大多采用皮下注射法[9]和腹腔注射法[10-11]。岳静等[12]比较了人卵巢癌裸鼠皮下移植瘤、腹水瘤和原位移植瘤模型,认为3种模型从不同方面体现了人卵巢癌的生物学特点,成瘤率分别为100%、100%、90%;虽然人卵巢癌原位模型较皮下移植瘤更客观地反映了肿瘤的生物学特征,但操作困难,耗时,难度大,成瘤率低。本研究采用了卵巢癌SKOV3细胞悬液皮下注射接种法,操作简单方便,接种部位在裸鼠右侧肩胛背部,易于观察和测量,同时能避免裸鼠挠抓。
本研究中有1只裸鼠移植失败,可能是因为一次性接种15只裸鼠,处理好的肿瘤细胞不能及时接种至裸鼠体内或接种时肿瘤细胞分布不均所致。在整个观察期荷瘤小鼠的体质量与对照组无明显差异,但如果去除瘤体体质量,荷瘤裸鼠的体质量相对对照组较低。本研究结果显示,在接种第30天,肿瘤体积明显增大,且30 d后肿瘤体积增大速度较快。本实验有2例瘤体表面皮肤出现破溃,在剥离时发现与皮肤粘连致密,很显然这样的荷瘤鼠不是进行实验研究的较好选择,而且在解剖时发现有些体积较大的瘤体内已经出现液化坏死现象,这可能与瘤体生长过快有关。但30 d前裸鼠的瘤体过小,不宜实验。因此,进行下一步实验探究时应选择体积在100~450 mm3之间较为适宜。
本实验结果显示,SKOV3细胞株在裸鼠右侧肩胛背部生长良好,所有裸鼠在观察期内未出现明显恶病质和意外死亡。如果研究卵巢癌生物学特性或评估药物疗效,在卵巢癌原位移植瘤难以建立时,将SKOV3细胞株接种于裸鼠右侧肩胛皮下部位是可行的。移植瘤组织符合人卵巢癌细胞的病理学特征,具有操作简单,成瘤时间短,成瘤率高,易于观察等优点,是较为实用的临床癌动物模型,为后续体内卵巢癌的基础研究、临床治疗提供了可靠的依据。
