沈阳市交通相关的PM2.5 对孕鼠呼吸道菌群及胎鼠生长发育影响研究
2020-04-12王水苗张迪范荣华商磊张阳蕾
王水苗, 张迪, 范荣华, 商磊, 张阳蕾
(1. 沈阳医学院基础医学院临床医学专业学生, 辽宁 沈阳110034; 2. 公共卫生学院卫生检验教研室; 3. 药学院药理学教研室; 4. 沈阳市第十人民医院)
沈阳作为我国重要的工业基地[1], 大气污染问题日益突出。 PM2.5是指大气中直径≤2.5 μm 的颗粒物[2], 与呼吸系统疾病、 心脑血管疾病、 免疫疾病以及肿瘤的发生发展等有着密切联系[3]。通过对大气污染物与高血压大鼠呼吸道微生态的影响研究发现, 暴露于大气污染物中可导致高血压大鼠口咽部细菌出现菌群失调, 破坏机体的微生态平衡[4]。 国内外大量研究表明, PM2.5通过呼吸进入母体后, 不仅能够影响孕妇本身的状态,而且可能通过其他途径造成胎儿早产、 流产、 死胎、 吸收胎、 子代出生体重降低等不良妊娠, 具有一定的胚胎毒性[5-10], 动物实验研究也证实了这一点[11]。 相关研究发现, PM2.5等空气污染物和菌群失调常与儿童哮喘发作有关[12]。 但PM2.5暴露所致的孕鼠呼吸道菌群失调与胎儿生长发育的关系目前并不清楚。 本研究采用16S rDNA 高变区测序分析沈阳市交通相关的PM2.5对Wistar 孕鼠呼吸道微生态和对胎鼠生长发育造成的影响, 探讨PM2.5改变孕鼠呼吸道微生态与胎鼠生长发育的联系, 以期为孕妇和胎儿健康的相关研究提供理论依据。
1 材料与方法
1.1 实验动物及分组 选取SPF 级Wistar 大鼠雄性10 只, 雌性20 只, 体重(200±10) g, 均未经生育交配, 由沈阳医学院实验动物中心提供, 实验动物许可证号: SYXK (辽) 2015-0001), 常规饲养于沈阳医学院实验动物中心。 实验初始将发情期雌鼠与雄鼠按照2∶1 比例合笼饲养, 次日清晨采用显微镜观察法确定雌鼠是否怀孕, 镜下可见精子团或肉眼可见阴道栓者记为孕1 d。 随后将受孕成功的20 只雌鼠随机分为实验组和对照组,每组10 只。
1.2 主要试剂及仪器 沈阳市空气污染细颗粒物(采集于沈阳市黄河北大街) 制成混悬液; 无菌咽拭子培养管(苏州康健医疗器械有限公司); 显微镜(北京瑞科中仪科技有限公司); 超声仪(必能信超声上海有限公司); TE-6070VFC 大流量颗粒物采样器(美国Tisch Environmental 公司); 低温高速离心机(美国Sigma 公司); HRH-MNE 型动物口鼻吸入暴露系统(北京慧荣和科技有限公司); -80 ℃低温冰箱(日本Panasonic 公司); 纯水机(美国Milli-Q Integral 公司); 16S rDNA 高变区测序分析(广州基迪奥生物公司)。
1.3 方法
1.3.1 PM2.5标本采集与混悬液制备 将恒重超纯石英纤维滤膜放置在沈阳医学院交通活跃、 生活污染区距地面高1.6 m 的大流量颗粒物采样器内,于冬季采暖期收集大气细污染物PM2.5, 24 h 持续采样, 采集6 个月。 采样前滤膜干燥称重, 采样后的滤膜剪成3 cm×3 cm 的方块, 置于提前备好的含有100 ml 超纯水的烧杯中, 常温(25 ℃) 超声震荡3 次(15 min/次), 收集震荡后粗洗液并用6 层纱布过滤, 除去残渣。 后将滤过液离心(1 000 r/min) 1 h, 弃上清, 收集底部混悬液。
1.3.2 PM2.5暴露孕鼠模型 将实验组孕7 d 孕鼠放入动物口鼻吸入暴露系统的口鼻暴露室内以1.3 mg/m3细颗粒物的浓度雾化吸入PM2.5至孕20 d,隔天暴露一次(4 h/次), 共暴露7 次; 对照组以同等方式等量雾化吸入超纯水。
1.3.3 标本的采集 孕20 d 用微生物专用无菌咽拭子棉签采集孕鼠咽后壁的菌群样本(注意取样时勿致口腔咽颊及舌黏膜出血), 采样后标记并立即放入-80 ℃冰箱内低温保存。 完成咽拭子标本的采集后, 用乙醚麻醉和颈椎脱位法将孕鼠处死后剖腹, 取出子宫称取窝重。 剖开子宫取出全部胎鼠, 记录每窝胎鼠数并测量每窝胎鼠重量和胎盘重, 以及单只胎鼠的体重、 体长, 比较不良妊娠结局。
1.3.4 16S rDNA 高变区测序分析 采用16S rDNA高变区测序方法对孕鼠口咽部菌群进行分析鉴定。 经过基因组DNA 提取、 PCR 扩增、 建库和测序以及数据处理与分析获得OTU 后, 依次进行物种注释、 Alpha 多样性分析、 Beta 多样性分析等群落功能预测, 在有效分组的情况下进行组间差异检验及差异比较。 与环境因子结合进行特定的高级分析, 确定呼吸道微生态与PM2.5暴露之间的关系。
1.4 统计学方法 采用SPSS 20.0 软件对数据进行统计学分析, 计量资料采用均数±标准差表示,组间比较采用独立样本t 检验和Wilcoxon 秩和检验进行统计分析, 以P<0.05 为差异有统计学意义。
2 结果
2.1 OTU 分析 本研究共得到7 174 个OTU。 选取比较分组平均丰度大于1 的所有OTU (即高丰度并集OTU) 进行韦恩图分析得到, 两组间共有的OTU 数为208 个, 分别占实验组和对照组OTU总数的86%和36%; 实验组和对照组独有OTU 数分别为33 个和370 个, 实验组较对照组的微生物种类更加集中, 见图1。
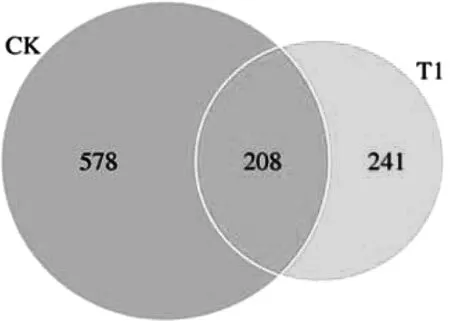
图1 PM2.5暴露后组间比较的韦恩图
2.2 Alpha 多样性分析 本研究绘制稀释曲线(rarefaction curve), 见图2, 并采用Chao1、 Ace、Shannon、 Observed _ species、 Simpson 和Goods_coverage六大类常用统计方法分析Alpha 多样性,见表1。 结果可以看出, PM2.5暴露影响孕鼠口咽部微生物的多样性, 对照组的多样性高于实验组。

图2 样品在0.03 距离下的OTU 稀释曲线图
2.3 Beta 多样性分析 利用R 语言的Pheatmap包, 以热图形式展示组间Weighted 和Unweighted Unifrac 指数, 见图3; 基于样本间的Weighted 和Unweighted Unifrac 数据结果, 绘制PCoA 图形, 见图4。 结果显示, 实验组较对照组的微生物种类少。
2.4 物种分类分析 经物种分类热图分析, 20 个样品中总共有19 个门、 32 个纲、 47 个目、 73 个科、 114 个属、 36 个种被鉴定, 结果见图5。
2.5 物种差异分析 通过LEfSe 分析组间菌群差异, 找出实验组和对照组之间差异显著的物种,见图6。 通过组间菌群差异数据表更加清晰地体现各主要差异菌群在实验组与对照组间的差异, 见表2。 上述实验结果显示, 变形菌门、 拟杆菌门及厚壁菌门细菌在实验组和对照组差异明显。

图3 样本间Weighted (A) 和Unweighted Unifrac (B) 指数热图
2.6 窝重、 胎盘重量及不良妊娠结局 实验组窝重低于对照组(P<0.05)。 实验组胎鼠的胎盘重量低于对照组, 但差异无统计学意义(P>0.05),见表3。 实验组中2 只孕鼠流产, 解剖后可见子宫明显扩张但宫内无胎鼠。
2.7 胎鼠生长发育情况 实验组每窝胎鼠数量少于对照组(P<0.05)。 实验组胎鼠平均体重、 平均体长均低于对照组, 但差异无统计学意义(P>0.05), 见表4。

图4 基于Weighted (A) 和Unweighted Unifrac (B) 距离的PCoA 分析

图5 物种分类热图

表2 实验组和对照组的LEfSe 结果

续表2
表3 实验组和对照组胎鼠窝重和胎盘重的比较

表3 实验组和对照组胎鼠窝重和胎盘重的比较
注:*实验组有2 只孕鼠流产。 与对照组比较,1)P =0.003
组别 n 窝重(g) 胎盘重量 (g)对照组 10 45.03±12.29 0.51±0.07实验组 8* 23.82±13.371) 0.39±0.20

图6 LEfSe 差异分析图(柱状图的长度代表差异物种的影响大小)
表4 实验组和对照组每窝胎鼠数及胎鼠平均体重、 平均体长的比较()

表4 实验组和对照组每窝胎鼠数及胎鼠平均体重、 平均体长的比较()
注:*实验组有2 只孕鼠流产。 与对照组比较,1)P =0.026
组别 鼠数(n) 每窝胎鼠数(个) 平均体重(g) 平均体长(g)对照组 10 11.00±3.50 2.38±0.12 3.31±0.11实验组 8* 6.30±5.061) 2.17±1.20 2.65±1.35
3 讨论
本实验主要研究对象为孕鼠, 为了更好地模拟孕期受大气PM2.5影响, 考虑到孕妇孕期PM2.5暴露频率及时长, 故选择隔天暴露(4 h/次) 作为本研究的暴露方式。 Wistar 大鼠孕期通常为19 ~23 d, 本试验选择21 d 作为大鼠妊娠周期。 张铭[13]研究结果表明, 模仿人类妊娠周期可以将Wistar 大鼠的妊娠周期分为3 个阶段, 孕早期为怀孕后1~7 d, 孕中期为怀孕后8 ~14 d, 孕晚期为怀孕14 d 以后。 考虑到孕早期母体各项指标均不稳定, 易导致意外流产、 畸形等不良妊娠结局,故选择大鼠孕中期初始即孕7 d 开始进行造模。
PM2.5可以改变呼吸道正常菌群定植、 破坏呼吸道微生态, 从而引发呼吸系统疾病[14]。 本研究采用16S rDNA 高通量测序技术对PM2.5暴露后孕鼠呼吸道菌群变化进行分析。 菌属重叠结果显示,实验组独有OTU 数明显少于对照组, 表明PM2.5暴露可使孕鼠呼吸道菌群呈减少的趋势。 由表1 可知, 实验组和对照组间Chao1 指数和Ace 指数存在显著差异, 说明暴露孕鼠和非暴露孕鼠呼吸道菌群的丰富度存在不同。 经过物种差异分析, 本研究共发现3 种组间差异明显的细菌门, 包括变形菌门、 拟杆菌门及厚壁菌门, 且三种菌门的物种最高丰度平均值均高于对照组, 差异有统计学意义。 本实验结果中实验组和对照组间菌群丰度、数量、 多样性等发生变化, 意味着当大气污染达到一定时间和浓度时, 微生物防线被打破, 口咽部菌群改变。 张莉等[15]通过PM2.5对大鼠咽部微生态的影响研究, 发现吸入PM2.5后大鼠咽部菌群中正常菌的检出率明显降低, 而致病菌和条件致病菌检出率明显增加。 该研究表明PM2.5可以破坏大鼠咽部微生态平衡, 早期主要表现为需氧菌菌群失调, 晚期可发生厌氧菌菌群失调。 郭杰[16]利用16S rDNA 高变区测序分析法探讨PM2.5对Wistar 大鼠呼吸道微生态的影响研究, 发现PM2.5暴露对Wistar 大鼠的口咽部呼吸道微生态优势菌菌群构成有影响, 并表明这些菌群相对比例变化可能与人群的肺炎和支气管疾病等相关。
此外, 实验组γ-变形菌纲中, 专性好氧菌及兼性厌氧菌检出率减少; 拟杆菌纲中, 普雷沃氏菌检出率减少。 文献报道, 健康人群的呼吸道黏膜表面定居着以厚壁菌门、 变形菌门、 拟杆菌门为主的大量细菌[17]。 研究表明, 慢性阻塞性肺疾病患者支气管肺泡灌洗液中变形菌门丰度增加[18];哮喘患者气道内拟杆菌门中的普雷沃氏菌比例低于正常人群[19]。 说明大鼠呼吸道优势菌群与人类非常相似, 人类呼吸道微生态与多种呼吸系统疾病的发生发展有密切关系。 本研究16S rDNA 高通量测序结果表明, PM2.5暴露可致Wistar 孕鼠呼吸道中的厚壁菌门、 变形菌门和拟杆菌门等正常菌群丰度及数量减少、 多样性降低, 即PM2.5暴露可致孕鼠呼吸道菌群构成发生变化, 提示PM2.5暴露可能引起孕妇孕期口咽部菌群改变, 破坏呼吸道微生态平衡, 从而引起生理机能发生改变。
本研究统计学分析胎鼠生长发育相关数据显示, 实验组窝重明显减轻、 每窝胎鼠数明显减少,差异有统计学意义, 表明PM2.5可致胎鼠总数减少、 窝重减轻, 提示PM2.5暴露对妊娠有一定影响。 且对照组整体标准差较小, 显示PM2.5可致胎鼠胎盘重量和体重减轻、 体长减小。 文献报道,大气污染可通过影响孕妇的呼吸、 心血管等系统,进而影响子宫、 胎盘和脐血血流, 导致新生儿低体重、 胎儿生长迟缓或早产[20]。 Kannan 等[21]研究表明, 空气颗粒物可通过全身氧化应激和炎症反应、 血凝变化、 内皮功能和血流动力学的变化等生物学作用途径, 单独或联合起作用影响胎盘和胎儿。 Perera 等[22]研究表明, 空气污染可导致胎儿体重减轻、 体长减少等不良出生结局。 本研究统计学分析结果表明, PM2.5暴露可导致一定比例的孕鼠流产; 未流产孕鼠与对照组相比, 可引起胎鼠总数减少, 窝重、 胎盘重量和胎鼠体重减轻, 体长减少的趋势。 即PM2.5暴露能够对孕期胎鼠生长发育产生不良影响。
综上所述, PM2.5暴露可打破孕鼠呼吸道微生态平衡, 引起呼吸道菌群失调, 同时对胎鼠生长发育产生不良影响。 在大气严重污染的天气情况下, 孕妇出行前应做好相应防护措施或尽量避免外出, 以减少或避免PM2.5对自身和胎儿的危害。
