下调miR-433表达抑制高糖介导的肾纤维化机制研究*
2020-04-10张丽华黄云华罗景梅吴斌何君一李嵘
张丽华, 黄云华, 罗景梅, 吴斌, 何君一, 李嵘
昆明医科大学第一附属医院 1老年内分泌科, 2内分泌一科(云南昆明 650031); 3云南省第一人民医院肾内科(云南昆明 650031)
糖尿病目前已成全球流行趋势,2016年全球糖尿病患者已达4.22亿[1]。糖尿病肾脏疾病 (diabetic kidney disease, DKD)是糖尿病的主要并发症,我国2型糖尿病肾病社区患病率为30%~50%,住院患者中约占40%[2]。DKD是糖尿病微血管病变引起的肾损害,肾纤维化是其病理特征之一[3]。但现有治疗策略不能逆转DKD的进展。微小核糖核酸(microRNA)是一类长约21~23个核苷酸的内源性小编码单链RNA,通过碱基配对原则,与靶基因3′非翻译区(3′-UTR)互补序列结合,抑制蛋白翻译或促进mRNA降解,在转录后水平负调控靶基因的表达[4]。研究显示microRNA参与了肾脏疾病的发病机制[5]。我们既往研究显示,miR-433是转化生长因子-β1(TGF-β1) /Smad3信号通路诱导肾纤维化的重要参与者, 正反馈放大TGF-β1/ Smad3诱导的肾纤维化效应;下调miR-433的表达可显著减轻肾纤维化[6]。但下调miR-433表达,是否减轻DKD肾纤维化,尚未见报道。本研究2016年10月至2019年2月通过体外细胞实验探讨在高糖刺激条件下,miR-433是否参与肾纤维化,并进一步明确miR-433在高糖刺激引起肾纤维化中的作用机制,为探讨治疗DKD的疗法提供新思路。
1 材料与方法
1.1 细胞培养 大鼠TECs(NRK52E,ATCC,Manassas,VA)和MMCs(大鼠系膜细胞系,1099,ATCC,Manassas,VA)培养于Dulbecco改良Eagle′s培养基,5%胎牛血清,100 U/mL青霉素和100 mg/mL链霉素(Life Technologies,Carlsbad,CA)培养24 h使细胞同步化,然后给于不同浓度高糖(12.5 mmol/L、25 mmol/L和50 mmol/L) (Life Technologies,Carlsbad,CA)刺激24 h,实时荧光定量PCR (qRT-PCR)检测miR-433表达,摸索出最适宜的高糖刺激浓度25 mmol/L。再用25 mmol/L高糖浓度刺激细胞,在不同时间点(0、12、24和48 h)检测miR-433表达。
1.2 高糖刺激NRK52E和MMCs细胞模型构建和纤维化指标检测 大鼠TECs和MMCs培养24 h使细胞同步化后,以25 mmol/L高糖浓度刺激细胞,对照组TECs和MMCs葡萄糖浓度为5.6 mmol/L。细胞培养0、48 h后进行相关纤维化指标[胶原Ⅰ、Ⅳ(Col-Ⅰ、Col-Ⅳ)、粘连蛋白(FN)和α平滑肌肌动蛋白(α-SMA)]的检测。
1.3 高糖刺激大鼠稳定表达miR-433上调及miR-433下调NRK52E和MMCs细胞系miR-433和纤维化指标的表达 按文献方法[6]构建稳定表达miR-433上调及miR-433下调NRK52E和MMCs细胞系,即将质粒按试剂盒说明书(Ambion, Austin, TX)分别转染入NRK52E和MMCs细胞,分别用G418和puromycin(Sigma, St Louis, MO)筛选,稳定表达细胞系构建成功后,25 mmol/L高糖刺激,采用qRT-PCR和Western blot分别检测miR-433和纤维化指标表达变化。
1.4 实时荧光定量PCR方法 按Taqman MicroRNA Assay(Applied Biosystems, Foster City, CA)试剂盒说明书和Multiplex RT kit (Invitrogen,Carlsbad,CA) 试剂盒说明书提取microRNA和RNA,进一步检测miR-433和纤维化指标(Col-Ⅰ、Col-Ⅳ、FN和α-SMA),RT-PCR引物序列按文献[6]。
1.5 Western blot分析 采用试剂盒(美国Cell Sinaling Techonology)按说明书提取NRK52E和MMCs细胞蛋白。10%SDS-PAGE(SDS,UltraPure Invitrogen,Carlsbad, CA, USA)电泳,转移至硝酸素纤维膜,TBS/T洗膜,5%脱脂奶粉室温下阻断60 min。分别加入Col Ⅰ(Southern Tech, Birmingham,AL)、Col Ⅳ、FN(Dako, Carpinteria, CA)、α-SMA(Sigma, St Louis,MO)或β-Actin 一抗[1∶1 000(美国 Santa Cruz)]4℃孵育过夜。洗膜后分别加入二抗(Santa Cruz,Biotechnology, Santa Cruz, CA) 室温孵育1 h,洗膜后加入发光剂(美国Cell Sinaling Techonology),X线胶片曝光。凝胶图像成像系统成像及扫描定量分析蛋白质带的相对含量。计算与β-Actin比值。
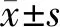
2 结果
2.1 高糖刺激大鼠肾小管上皮细胞miR-433和纤维化指标的表达
2.1.1 不同葡萄糖浓度刺激NRK52E后qRT-PCR miR-433/u6表达 对NRK52E用不同浓度高糖(0、12.5、25和50 mmol/L)刺激24 h,miR-433表达随高糖刺激浓度的增加呈进行性升高(P<0.001),最适浓度为25 mmol/L。见图1、表1。

注:与0 mmol/L比较 *P<0.01,**P<0.001
图1不同葡萄糖浓度刺激NRK52E后qRT-PCRmiR-433/u6表达比较
表1不同葡萄糖浓度刺激NRK52E后qRT-PCRmiR-433/u6的表达比值

葡萄糖浓度nmiR-433/u60 mmol/L30.60±0.0512.5 mmol/L31.20±0.2025 mmol/L32.20±0.0650 mmol/L32.30±0.05
2.1.2 25 mmol/L葡萄糖浓度刺激NRK52E不同时间qRT-PCR miR-433/u6的表达 采用25 mmol/L葡萄糖浓度刺激不同时间(0、12、24和48 h),miR-433表达在48 h达高峰(P<0.001),见图2、表2。
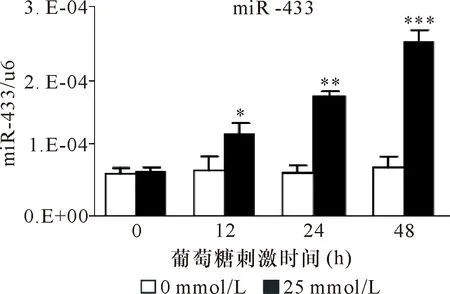
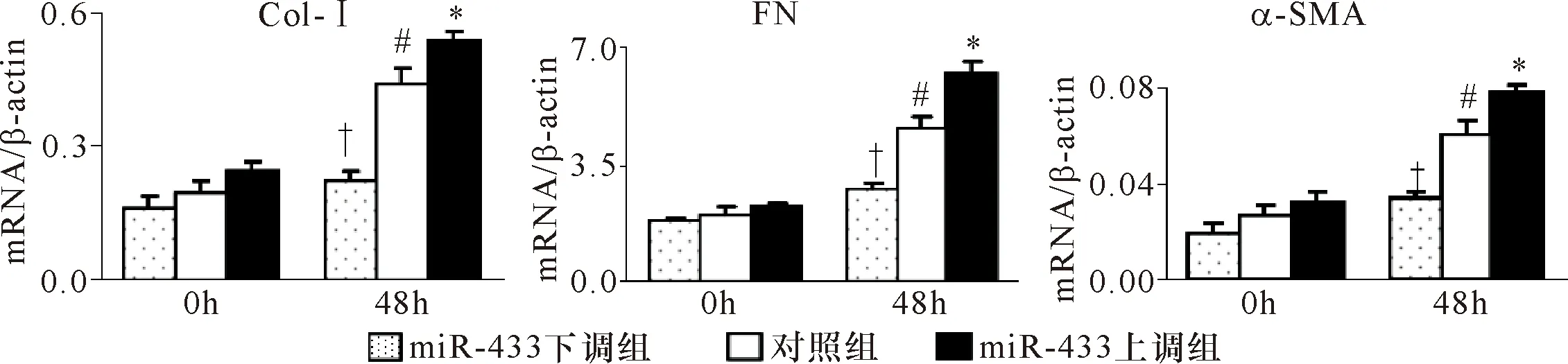
2.1.3 25 mmol/L葡萄糖浓度刺激NRK52E不同时间qRT-PCR纤维化指标的表达 纤维化指标Col-Ⅰ、α-SMA和FN的表达在高糖刺激48 h后明显增加(P<0.001)。见图3、表3。
2.2 高糖刺激大鼠肾小球系膜细胞miR-433和纤维化指标的表达 以25 mmol/L葡萄糖浓度刺激MMCs 48 h,miR-433和纤维化指标:Col-Ⅰ、Col-Ⅳ、FN和α-SMA(图2-B~E)在MMCs中的表达显著升高。高糖刺激48 h,miR-433的表达与刺激的葡萄糖呈浓度和时间依赖; 高糖刺激48 h后Col Ⅰ、 Col-Ⅳ、 FN和α-SMA表达增加。见图4、5和表4、5。
注:与0 mmol/L比较*P<0.05,**P<0.01,***P<0.001
图2以25mmol/L葡萄糖浓度刺激NRK52E不同时间qRT-PCRmiR-433/u6的表达
表2以25mmol/L葡萄糖浓度刺激NRK52E在不同时间qRT-PCRmiR-433/u6表达比值

葡萄糖浓度0 h 12 h 24 h48 h25 mmol/L0.40±0.011.20±0.141.70±0.062.50±0.130 mmol/L0.37±0.050.39±0.150.40±0.070.28±0.12
注:*与0 mmol/L比较 P<0.001
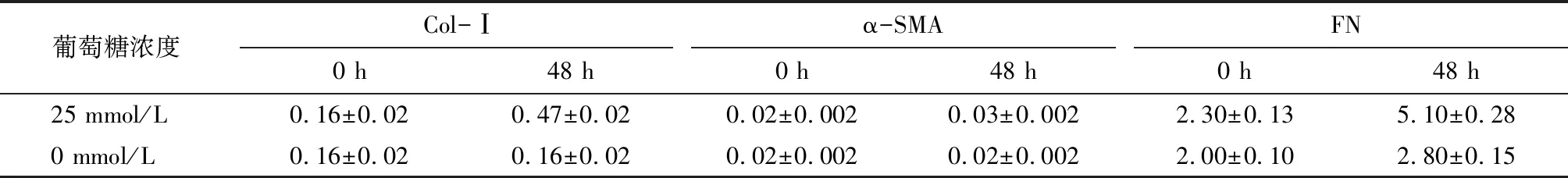
葡萄糖浓度Col-Ⅰα-SMAFN0 h48 h0 h48 h0 h48 h25 mmol/L0.16±0.020.47±0.020.02±0.0020.03±0.0022.30±0.135.10±0.280 mmol/L0.16±0.020.16±0.020.02±0.0020.02±0.0022.00±0.102.80±0.15

注:*与0 mmol/L比较 P<0.001
图4以25mmol/L葡萄糖浓度刺激MMCs不同时间qRT-PCRmiR-433/u6的表达
表4以25mmol/L葡萄糖浓度刺激MMCs不同时间qRT-PCRmiR-433/u6表达比较
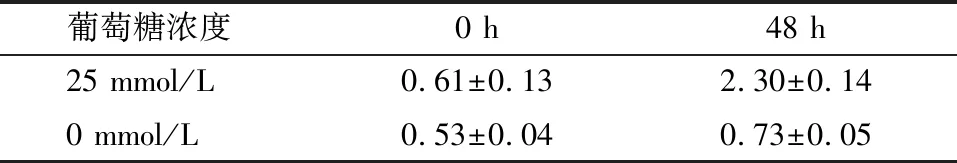
葡萄糖浓度0 h48 h25 mmol/L0.61±0.132.30±0.140 mmol/L0.53±0.040.73±0.05
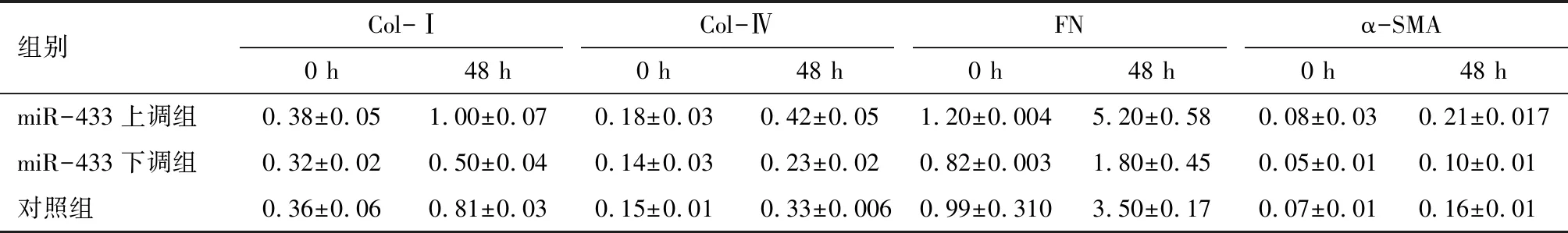
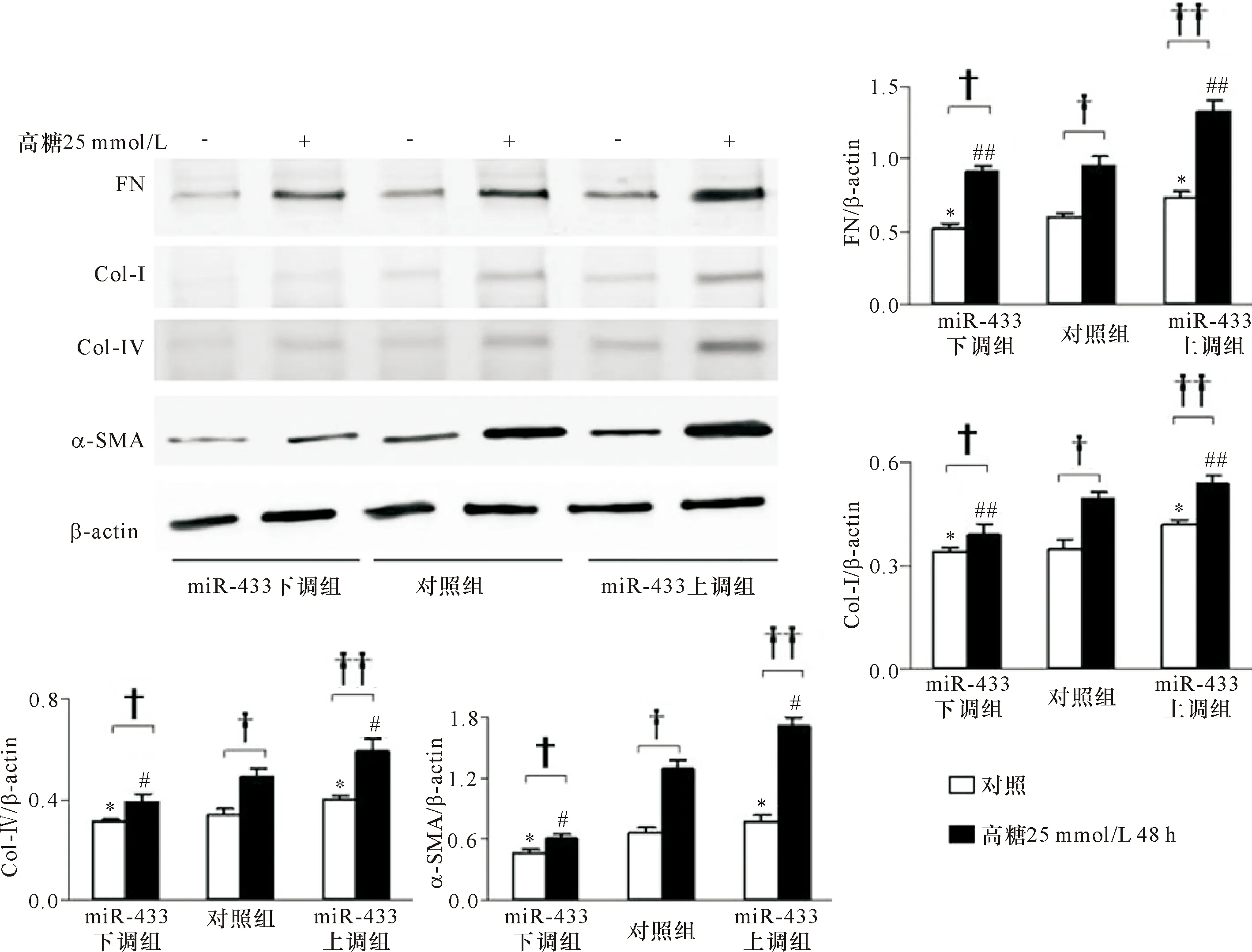
2.3 高糖刺激大鼠稳定表达miR-433上调及miR-433下调NRK52E细胞系 miR-433和纤维化指标的表达 以25 mmol/L葡萄糖浓度刺激NRK52E 24 h,miR-433和纤维化指标:Col-Ⅰ、FN和α-SMA在miR-433上调NRK52E细胞系中的表达显著升高,而在miR-433下调NRK52E细胞系中的表达显著降低。见图6~8、表6~8。

注:*与0 mmol/L比较P<0.001
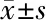

葡萄糖浓度Col-ⅠCol-ⅣFNα-SMA0 h48 h0 h48 h0 h48 h0 h48 h25 mmol/L0.40±0.041.10±0.080.28±0.070.77±0.040.16±0.0020.55±0.0020.32±0.020.58±0.020 mmol/L0.32±0.060.36±0.080.26±0.040.23±0.020.15±0.0010.16±0.0060.28±0.010.30±0.02
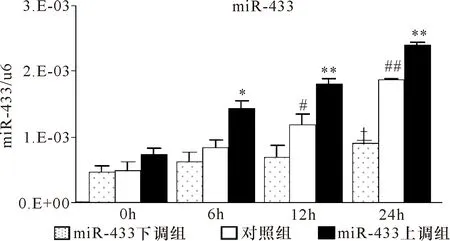
注:与对照组比较 *P<0.05,**P<0.001;与同组0 h比较,#P<0.01,##P<0.001
图6以25mmol/L葡萄糖浓度刺激NRK52E不同时间qRT-PCRmiR-433/u6的表达
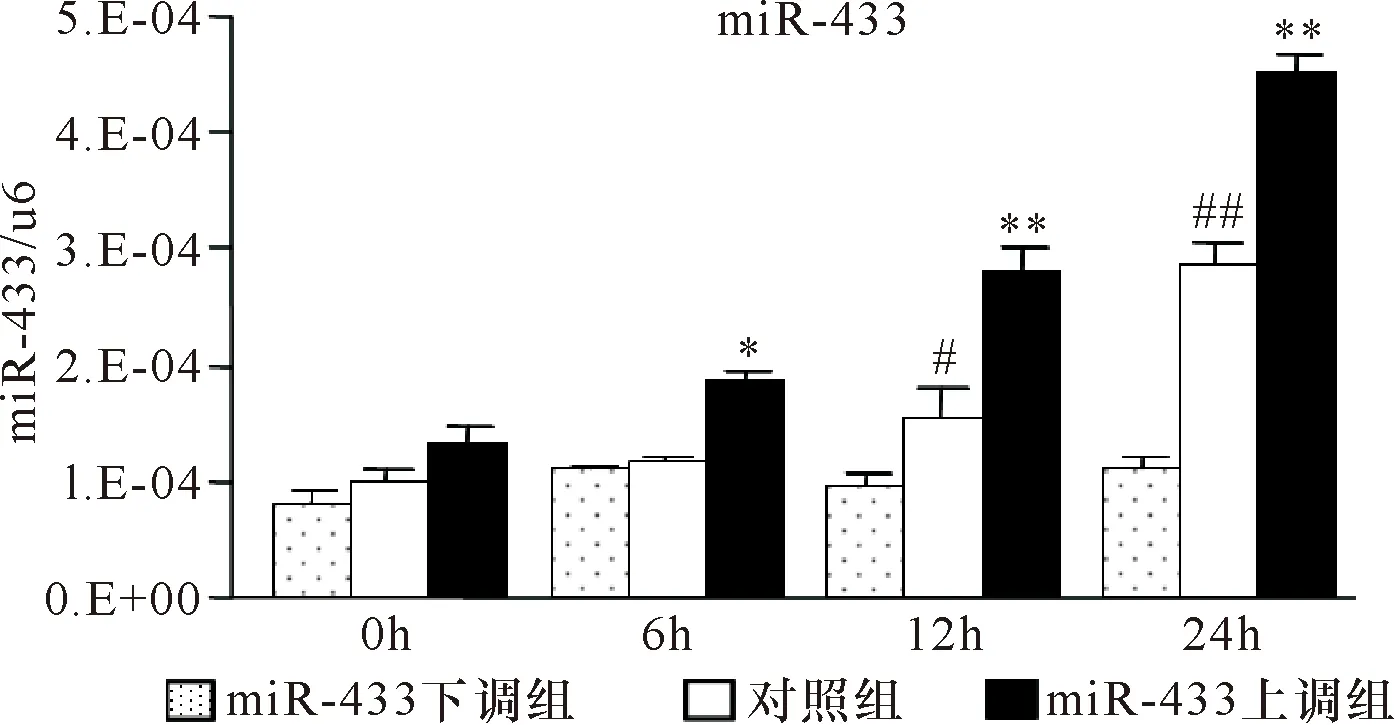
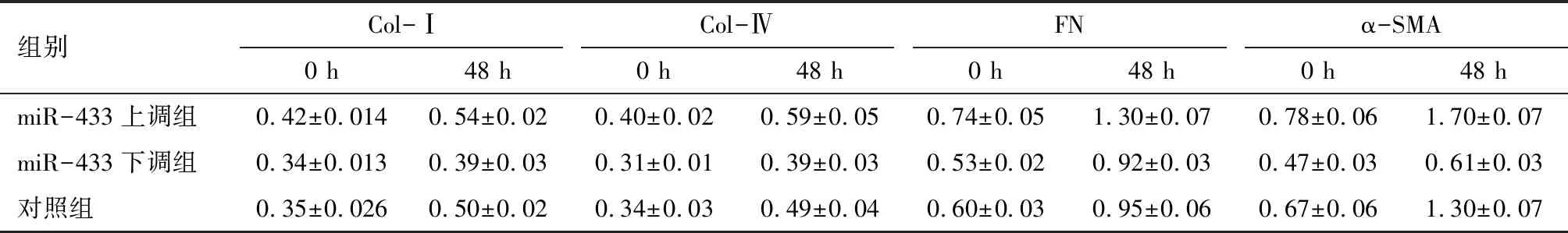
2.4 高糖刺激大鼠稳定表达miR-433上调及miR-433下调MMCs细胞系 miR-433和纤维化指标的表达 以25 mmol/L葡萄糖浓度刺激MMCs 48 h,miR-433和纤维化指标:Col-Ⅰ、Col-Ⅳ、FN和α-SMA在miR-433上调MMCs细胞系中的表达显著升高,而在miR-433下调MMCs细胞系中的表达显著降低。见图9~11、表9~11。
3 讨论
DKD是糖尿病微血管严重并发症之一,其病理实质为肾纤维化,高血糖是DKD启动和进展最关键因素,长期高血糖导致糖基化终末产物(AGEs) 形成,后者与系膜细胞的特异受体结合,促肾小球系膜细胞产生FN、Col-Ⅳ等细胞外基质(ECM),促进肾小球基底膜增厚,系膜扩张,肾小球肥大,肾小球硬化。Col-Ⅳ是基底膜和系膜的主要成分, 其过度沉积与DKD病情进展密切相关[7]。FN主要表达于DKD患者肾小球和肾小管,反映肾纤维化程度,是DKD进展的指标[8]。细胞骨架蛋白α-SMA这一肌成纤维细胞出现的标志,参与了肾纤维化过程[9]。
TGF-β1是目前已知最重要的促纤维化因子,它促进ECM的生成并抑制其降解[6, 10]。肾小球和肾小管间质TGF-β1高表达的现象已在动物模型和DKD患者中证实。高糖可以上调近端肾小管、肾小球上皮细胞和系膜细胞TGF-β1 mRNA 的表达和蛋白的合成;TGF-β1 在肾小管间质纤维化中主要由受损伤的肾小管上皮细胞产生,通过自分泌及旁分泌方式引起肾细胞肥大、ECM积聚,最终导致肾脏纤维化。TGF-β1合成过多或活性增强导致肾脏ECM合成增多和系膜区扩张,肾脏肥大,出现DKD的典型病理改变。
表6以25mmol/L葡萄糖浓度刺激NRK52E不同时间qRT-PCRmiR-433/u6的表达

组别0 h 6 h 12 h24 hmiR-433上调组0.52±0.121.00±0.121.88±0.042.99±0.07miR-433下调组0.36±0.130.43±0.120.47±0.210.52±0.02对照组0.41±0.140.81±0.121.33±0.152.22±0.04
注:与对照组比较 *P<0.001, † P<0.05;与同组0 h比较,#P<0.01
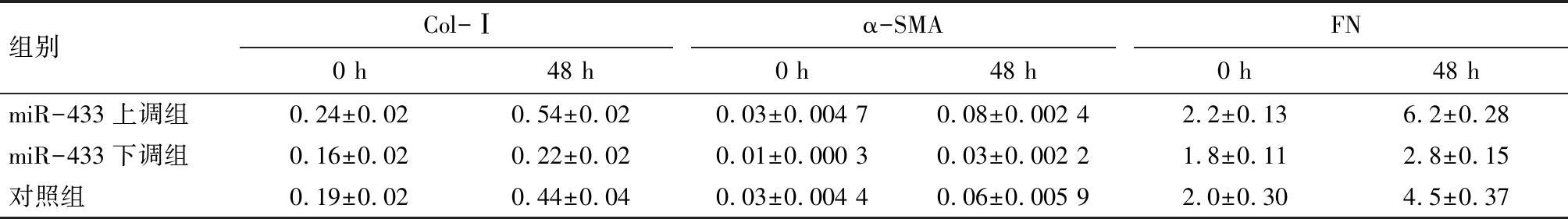
组别Col-Ⅰα-SMAFN0 h48 h0 h48 h0 h48 hmiR-433上调组0.24±0.020.54±0.02 0.03±0.004 70.08±0.002 42.2±0.136.2±0.28miR-433下调组0.16±0.020.22±0.020.01±0.000 30.03±0.002 21.8±0.112.8±0.15对照组0.19±0.020.44±0.040.03±0.004 40.06±0.005 92.0±0.304.5±0.37
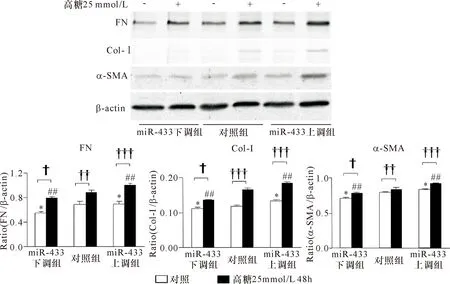
注:与对照组比较 *P<0.05,##P<0.01;†P<0.05,††P<0.01,†††P<0.001
图8以25mmol/L葡萄糖浓度刺激NRK52E不同时间Westernblot纤维化指标比较
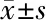

组别Col-Ⅰα-SMAFN0 h48 h0 h48 h0 h48 hmiR-433上调组0.13±0.0050.18±0.0050.83±0.020.91±0.010.69±0.051.00±0.04miR-433下调组0.11±0.0030.14±0.0030.71±0.010.78±0.010.55±0.020.79±0.02对照组0.12±0.0040.17±0.0050.79±0.010.84±0.020.69±0.060.88±0.03
注:与对照组比较 *P<0.05,**P<0.001;与同组0 h比较,#P<0.01,##P<0.001
图9以25mmol/L葡萄糖浓度刺激MMCs不同时间qRT-PCRmiR-433/u6的表达
表9以25mmol/L葡萄糖浓度刺激MMCs不同时间qRT-PCRmiR-433/u6的表达

组别0 h 6 h 12 h24 hmiR-433上调组1.3±0.151.9±0.082.80±0.224.5±0.14miR-433下调组0.8±0.131.1±0.060.96±0.121.1±0.11对照组1.0±0.091.2±0.051.50±0.252.9±0.17
注:与对照组比较 *P<0.001,†P<0.05; #与同组0 h比较P<0.01
图10以25mmol/L葡萄糖浓度刺激MMCs不同时间qRT-PCR纤维化指标比较
组别Col-ⅠCol-ⅣFNα-SMA0 h48 h0 h48 h0 h48 h0 h48 hmiR-433上调组0.38±0.051.00±0.070.18±0.030.42±0.051.20±0.0045.20±0.580.08±0.030.21±0.017miR-433下调组0.32±0.020.50±0.040.14±0.030.23±0.020.82±0.0031.80±0.450.05±0.010.10±0.01对照组0.36±0.060.81±0.030.15±0.010.33±0.0060.99±0.3103.50±0.170.07±0.010.16±0.01
注:与对照组比较 *P<0.05, #P<0.01;†P<0.01,††P<0.001
组别Col-ⅠCol-ⅣFNα-SMA0 h48 h0 h48 h0 h48 h0 h48 hmiR-433上调组0.42±0.0140.54±0.020.40±0.020.59±0.050.74±0.051.30±0.070.78±0.061.70±0.07miR-433下调组0.34±0.0130.39±0.030.31±0.010.39±0.030.53±0.020.92±0.030.47±0.030.61±0.03对照组0.35±0.0260.50±0.020.34±0.030.49±0.040.60±0.030.95±0.060.67±0.061.30±0.07
既往研究发现,TGF-β1中和抗体(如anti-TGF-β2 IgG4)[11],TGF-β的反义寡核苷酸或可溶性人TGF-βII型受体[12],抑制肾纤维化、减少蛋白尿缓解了DKD。但后续研究发现DKD患者使用TGF-β1的中和抗体,虽安全,但不能延缓DKD进展[13]。Smad3的特异性抑制剂减轻了内皮细胞向间充质细胞的转化,延缓了肾病进展,但却没有降低蛋白尿[14]。并且,阻断TGF-β1/Smad3信号通路,可能损害TGF-β的抗炎特性,促进炎症反应。
新近研究证实多种miRNAs与DKD进展有着密切的关系[5]。我们研究发现,miR-433是肾组织中的促纤维化miRNA,可正反馈放大TGF-β1/Smad3肾纤维化信号通路,而抑制miR-433表达,可减轻肾纤维化[6]。Zhu等[15]研究证实,伴随糖尿病大鼠肾组织纤维化病理改变,肾脏miR-433和TGF-β1 mRNA和蛋白水平显著升高,促激肽释放的胰激肽原酶(PKase)腹腔注射治疗后,miR-433和TGF-β1 mRNA和蛋白水平显著降低,肾纤维化减轻。本研究显示,下调miR-433表达,显著减轻了肾小管和系膜细胞Col-Ⅰ、Col-Ⅳ、FN和α-SMA的表达。早期DKD患者中,尿miR-433排泄增加[16]。由此,miR-433可作为DKD早期诊断的生物学标记;下调miR-433的表达,可抑制DKD肾纤维化。因此,探索miR-433在DKD进展中的作用,对于发现利于DKD早期诊断的生物学指标和有效治疗手段,具有极其重要的临床价值。
