扩大的血管周围间隙与动脉粥样硬化性血管狭窄的相关性分析*
2020-04-10白永杰张笑娜王浏瑛李昕赵昱倩黄丽娜
白永杰, 张笑娜, 王浏瑛, 李昕, 赵昱倩, 黄丽娜
1河南科技大学第一附属医院神经内科(河南洛阳 471003); 2河南科技大学医学部(河南洛阳 471003)
血管周围间隙是包绕在小动脉、小静脉血管周围介于两层软脑膜之间的正常腔隙,其间充满液体将小血管与周围的脑组织分开[1]。扩大的血管周围间隙(enlarged perivascular space,EPVS)与血管源性脑白质损伤、腔隙性梗死、微出血等一起被认为是脑小血管病的影像学标志物,被认为与认知功能减退或痴呆、步态异常的发生相关[2-4]。目前脑小血管病的发病机制尚不明确,理论上颅内外大、小血管共同构成了脑血管树,并暴露于相同的危险因素,脑大、小血管病变的严重程度应该具有平行相关性[5-6]。前期研究也发现脑小血管病亚型如脑白质损伤、微出血与颅内外大血管狭窄具有相关性,但各项研究的结果并不尽一致,且颅内外血管狭窄程度多依据血管超声检查,被认为准确性稍差[6-7]。关于EPVS与大动脉粥样硬化性狭窄的相关性分析较少。本研究基于判断血管狭窄的“金标准”脑血管造影(DSA)检查,旨在分析EPVS的危险因素以及大动脉粥样硬化性血管狭窄与不同部位EPVS的相关性,以探讨EPVS形成的可能机制。
1 资料与方法
1.1 一般资料 连续性纳入2016年1月至2019年5月在河南科技大学第一附属医院神经内科住院的急性脑梗死或短暂性脑缺血发作(TIA)患者。纳入标准:(1)年龄≥18岁;(2)符合2014年中国缺血性脑卒中诊治指南急性脑梗死或TIA的诊断标准[8]。排除标准:(1)合并有其他严重内科系统疾病(甲状腺功能亢进、心力衰竭、慢性阻塞性肺疾病、阻塞性睡眠呼吸暂停综合征、肾脏疾病、血液疾病、恶性肿瘤等);(2)大脑半球大面积脑梗死影响EPVS评分;(3)除颈内动脉(ICA)和大脑中动脉(MCA M1段)外的其他大血管重度狭窄(狭窄程度≥50%);(4)其他可能导致大血管狭窄的疾病,包括静脉窦狭窄、动静脉畸形、颈内动脉肌纤维营养不良、颅内外血管夹层狭窄和Moyamoya病等;(5)资料不全或影像学图像质量不合格。研究获得本院伦理委员会同意。
1.2 方法
1.2.1 收集人口统计学资料 包括(年龄、性别、身高、体重)、血管危险因素(高血压、高脂血症、糖尿病、缺血性心脏病、心房颤动、既往卒中或TIA病史、吸烟、饮酒)、基线血压(收缩压、舒张压)、实验室检查[血常规、血糖、三酰甘油、总胆固醇、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、血同型半胱氨酸(Hcy)]等。
1.2.2 影像学检查 所有纳入患者均行数字减影脑血管成像检查,ICA狭窄程度采用北美症状性颈动脉狭窄动脉内膜切除术试验(NASCET)的狭窄测量法,MCA M1段狭窄采用华法林阿司匹林治疗症状性颅内动脉狭窄的随机对照研究所公布的WASID方法,血管狭窄率≥50%定义为重度狭窄[9-10]。
所有患者均应用飞利浦3.0T核磁共振成像仪(Achieva 3.0 T,荷兰)行头颅扫描,成像方式包括T1加权成像(T1WI)、T2加权成像(T2WI)、液体衰减反转恢复序列(T2 FLAIR)、弥散加权成像(DWI)和三维时间飞跃法(3D-TOF)磁共振血管成像(MRA)。EPVS、血管源性脑白质损伤以及腔隙性梗死诊断参照国际血管改变神经影像标准报告小组(STRIVE)的脑小血管病影像学诊断标准[2]。EPVS在T2WI像呈高信号,DWI上呈低信号,ADC上为高信号,T2WI-FLAIR序列呈低信号,以鉴别因梗死引起的T2WI高信号。根据解剖部位,EPVS分为基底节区(EPVS-GB)和皮层下半卵圆中心(EPVS-CSO)2个区域分别计数EPVS数量,计数大血管狭窄同侧EPVS数量,如双侧血管均无狭窄,则测量EPVS数量最多的一侧,如果一侧因梗死灶影响EPVS计数,则计数病灶对侧。EPVS的分级标准[11]如下:无EPVS=0分;1~10个EPVS=1分;11~20个EPVS=2分;21~40个EPVS=3分;大于40个EPVS=4分。0~1分为无或轻度EPVS,2~4分为重度EPVS[12]。
2 结果
2.1 患者基线特征 依据纳入/排除标准,研究共纳入239例患者,平均年龄(59±12.2)岁,其中男143例(59.8%),女96例(40.2%);重度EPVS-GB患者106例(44.4%),重度EPVS-CSO患者76例(31.8%)。发现ICA重度狭窄38例(15.9%),MCA重度狭窄42例(17.6%),ICA/MCA狭窄共存29 例(12.1%)。
2.2 EPVS影响因素的单因素分析 重度EPVS-BG组患者年龄[(64.9±9.11)岁vs(54.4±12.41)岁;t=-2.868,P=0.004]、高血压病史(80.0%vs45.5%;2=29.327,P<0.001)、卒中病史(36.2%vs14.9%;2=14.485,P<0.001)、脑深部中重度脑白质损伤(33.0%vs14.9%;2=10.826,P=0.001)、侧脑室旁中重度脑白质损伤(34.3%vs12.7%;2=15.769,P<0.001)和腔隙性梗死(31.6%vs13.7%;2=10.137,P=0.001)的患者构成比均显著高于无或轻度EPVS组;两组之间大动脉粥样硬化血管狭窄的分布同样差异有统计学意义(2=18.227,P<0.001)。半卵圆中心区重度EPVS与无或轻度EPVS患者在年龄、高血压、卒中病史、HDL、脑深部或侧脑室旁重度脑白质损伤、腔隙性梗死及大动脉粥样硬化血管狭窄的差异同样有统计学意义(均P<0.05)。见表1、2。
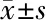
变量总例数(n=239)重度EPVS组(n=106)无或轻度EPV(n=133)t/Z/2值P值年龄(岁)59±12.264.9±9.154.4±12.4-2.8680.004男性[例(%)]143(59.8)65(61.9)78(58.2)0.3350.563高血压病[例(%)]145(60.7)84(80.0)61(45.5)29.327<0.001糖尿病[例(%)]89(37.2)39(37.1)50(37.3)0.0010.978卒中病史[例(%)]58(24.3)38(36.2)20(14.9)14.485<0.001吸烟史[例(%)]59(24.7)24(22.9)35(26.3)0.3760.540血糖(mmol/L)6.56±2.616.48±2.426.62±2.75-0.0670.946尿酸(μmol/L)291.8±88.3 300.6±94.5 284.7±82.7 -1.3930.164三酰甘油(mmol/L)1.81±1.351.78±1.491.83±1.24-0.2730.785LDL(mmol/L)2.64±0.992.56±1.032.70±0.96-0.8620.389HDL(mmol/L)1.14±0.291.15±0.331.13±0.25-0.8990.368Hcy(μmol/L)14.20±7.9714.06±6.3214.33±9.17-0.8470.397体质指数(kg/m2)∗25(23,27)25(22,26)25(23,27)-1.0260.305大血管狭窄部位[例(%)]18.227<0.001 无重度狭窄130(54.4)41(39.0)89(66.4) 颈内动脉狭窄38(15.9)23(21.9)15(11.2) 大脑中动脉狭窄42(17.6)23(21.9)19(14.2) 颅内外大血管狭窄共存29(12.1)18(17.1)11(8.2) 脑小血管病影像学标志[例(%)] 深部重度WMH54(22.6)34(33.0)20(14.9)10.8260.001 侧脑室旁重度WMH52(21.8)35(34.3)17(12.7)15.769<0.001 腔隙性梗死56(23.8)42(31.6)14(13.7)10.1370.001
注:*M(P25,P75):WMH:血管源性脑白质损伤
2.3 EPVS的独立预测因素 高龄(OR=1.08,95%CI1.04~1.13;P<0.001)、高血压病史(OR=2.12,95%CI1.05~4.25;P=0.035)、ICA狭窄(OR=3.44,95%CI1.32~8.49;P=0.011)、MCA狭窄(OR=2.87,95%CI1.22~6.73;P=0.016)和两者共存(OR=3.43,95%CI1.27~9.27;P=0.015)是基底节区重度EPVS的独立预测因素(表3)。高龄(OR=1.15,95%CI1.09~1.20;P<0.001)、高血压病史(OR=3.12,95%CI1.32~7.38;P=0.010)、MCA重度狭窄(OR=3.51,95%CI1.29~9.50;P=0.014)及ICA/MCA大血管狭窄并存(OR=5.69,95%CI1.87~17.33;P=0.002)是半卵圆中心区重度EPVS的独立预测因素,但ICA重度狭窄与半卵圆中心区EPVS并无相关性(OR=2.51,95%CI0.87~7.20;P=0.087)。
3 讨论
作为脑小血管病影像学表现的一个亚型,EPVS被认为与腔隙性梗死、血管源性脑白质损伤、脑微出血等存在着类似的危险因素和病理基础。本项研究发现高龄、高血压病史、上游血管大动脉粥样硬化血管狭窄与基底节区和半卵圆区EPVS独立相关。
高龄是脑小血管病的重要危险因素,文献报道腔隙性梗死、血管源性脑白质损伤和脑微出血的发生率均随着年龄的增长而显著升高[13]。同样,本项研究也发现年龄与基底节区和半卵圆区EPVS呈正相关,与以人口学为基础的流行病学调查[14]结果一致。随着年龄的增长,脑小动脉脂质透明样变、纤维增厚狭窄及淀粉样血管病变增加,导致血管壁通透性增加、血脑屏障破坏被认为是EPVS发生的主要原因[15]。高血压是脑小动脉硬化狭窄、纤维素样坏死和脂质透明样变的主要原因,既往研究显示高血压使脑白质损伤的发生风险增加2.5倍[16],使脑微出血的发生风险增加1.9倍[17],本项研究显示高血压可使基底节区EPVS发生风险增加1.12倍,使半卵圆中心区EPVS的发生风险增加2.12倍。部分研究认为高血压患者小动脉硬化、血管弹性和顺应性下降、小血管搏动能力减弱导致组织间液回流下降是EPVS发生的动力[18]。
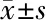
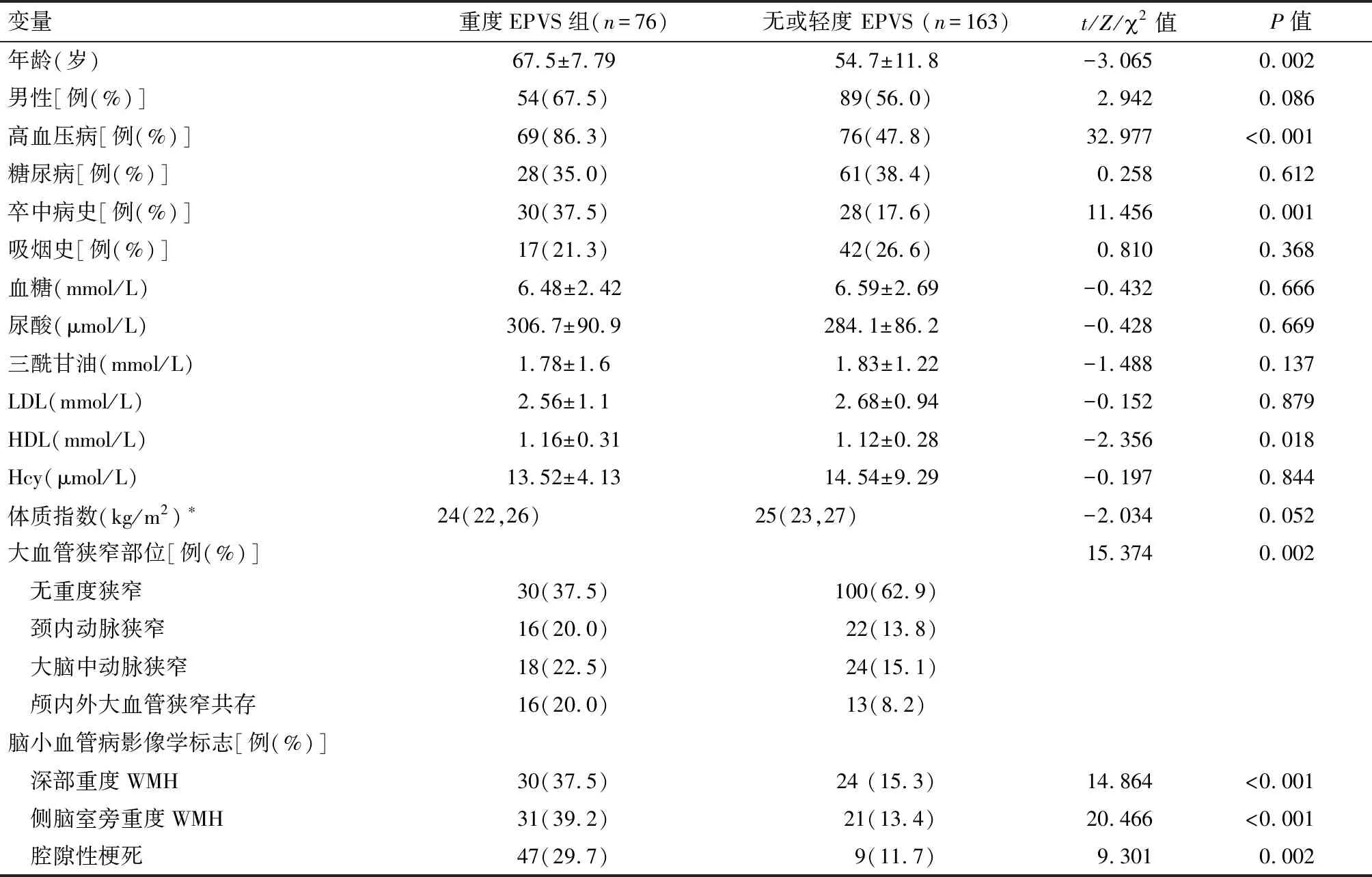
变量重度EPVS组(n=76)无或轻度 EPVS (n=163)t/Z/2值P值年龄(岁)67.5±7.7954.7±11.8-3.0650.002男性[例(%)]54(67.5)89(56.0)2.9420.086高血压病[例(%)]69(86.3)76(47.8)32.977<0.001糖尿病[例(%)]28(35.0)61(38.4)0.2580.612卒中病史[例(%)]30(37.5)28(17.6)11.4560.001吸烟史[例(%)]17(21.3)42(26.6)0.8100.368血糖(mmol/L)6.48±2.426.59±2.69-0.4320.666尿酸(μmol/L) 306.7±90.9 284.1±86.2 -0.4280.669三酰甘油(mmol/L)1.78±1.61.83±1.22-1.4880.137LDL(mmol/L)2.56±1.12.68±0.94-0.1520.879HDL(mmol/L)1.16±0.311.12±0.28-2.3560.018Hcy(μmol/L)13.52±4.1314.54±9.29-0.1970.844体质指数(kg/m2)∗24(22,26)25(23,27)-2.0340.052大血管狭窄部位[例(%)]15.3740.002 无重度狭窄30(37.5)100(62.9) 颈内动脉狭窄16(20.0)22(13.8) 大脑中动脉狭窄18(22.5)24(15.1) 颅内外大血管狭窄共存16(20.0)13(8.2)脑小血管病影像学标志[例(%)] 深部重度WMH30(37.5)24 (15.3)14.864<0.001 侧脑室旁重度WMH31(39.2)21(13.4)20.466<0.001 腔隙性梗死47(29.7)9(11.7)9.3010.002
注:*M(P25,P75):WMH:血管源性脑白质损伤

表3 基底节区和半卵圆中心区重度EPVS危险因素的logistic回归分析
注:WMH:血管源性脑白质损伤
上游颅内外大血管的结构和功能改变是否会对下游脑小血管床造成损害目前仍存在争议,颅内外动脉不同部位的狭窄与脑小血管病的关系也不尽相同。Chutinet等[19]报道高加索人群中脑白质损伤与颅外动脉狭窄相关,而Lee等[20]在亚洲人群中发现脑白质损伤与颅内动脉狭窄有关。Park等[21]报道颈内动脉狭窄与同侧EPVS的严重程度呈正相关,国内一小样本研究[22]显示颅内大血管狭窄与基底节区EPVS相关,但与颅外大血管狭窄无相关性。本项研究发现作为上游血管的MCA狭窄是基底节区和半卵圆区EPVS的独立预测因素,而ICA狭窄是基底节区EPVS的独立预测因素,但与半卵圆中心区EPVS的发生无相关性,与之前的报道部分一致。可能的原因包括:(1)前期研究对于颅内外大血管狭窄的评估手段多依据血管超声,与脑血管造影检查相比精确性稍差;(2)由于基底节区与半卵圆中心区主要有前循环供血,前期研究并未将后循环大血管狭窄排除在外;(3)不同患者Willis环的完整性不同,其对颅内的血流代偿作用可在一定程度上弥补颅外动脉狭窄对下游血流动力学的影响。目前关于扩大的血管外间隙的解剖学基础、病理学机制尚不清楚,部分研究认为基底节区和半卵圆中心区主要由前循环大脑中动脉-豆纹动脉或髓质动脉供血,大脑中动脉的粥样硬化斑块闭塞穿支动脉开口或由于上游血管狭窄导致的远端小血管低灌注、小血管弹性和顺应性下降可能是EPVS发生的原因[23]。
综上所述,高龄、高血压病史以及上游血管大动脉粥样硬化狭窄与基底节区和半卵圆中心区EPVS独立相关。但本研究仍存在的不足之处:(1)回顾性研究的性质不可避免地存在选择性偏倚;(2)因条件限制,未能同时完成核磁共振磁敏感成像,未能排除脑微出血可能引起的偏倚。因此,有待于大样本的前瞻性队列研究进一步验证。
