HBsAg致敏自体树突状细胞治疗乙肝病毒相关性慢加急性肝衰竭患者的临床效果*
2020-04-10朱其荣喻雪琴陈芳戢敏陈星梅怡晗梅小平
朱其荣, 喻雪琴, 陈芳, 戢敏, 陈星, 梅怡晗, 梅小平△
1川北医学院附属医院感染科(四川南充 637000); 2首都医科大学临床医学系(北京 610041)
乙型肝炎(乙肝)病毒(HBV)相关性慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)患者病情重,病死率达62.2%~72.3%[1],其发病机制不明确,多数学者认为免疫失衡可能是其主要发病机制。树突状细胞(dendritic cell,DC)是免疫应答启动的关键细胞,起源于骨髓, 1973年美国学Steinman和Cohn首次发现,是当前功能最强的专职抗原提呈细胞,能使原始T淋巴细胞激活的唯一的抗原提呈细胞,其功能状态直接影响免疫应答与抗病毒作用[2],它的成熟、功能状态是导致HBV持续感染的主要原因。ACLF患者免疫失衡的主因之一是其外周血DC数量下降,功能缺陷,无法有效提呈HBV抗原肽,不能诱导ACLF患者有效的特异免疫效应,DC的抗原提呈功能处于静息状态及γ干扰素(IFN-γ)、白细胞介素-4(IL-4)等细胞因子释放紊乱,诱发ACLF患者Treg/Th17、Th1/Th2等型细胞因子水平失调。观察血清IFN-γ、IL-4等细胞因子变化来了解DC在ACLF中的作用具有一定指标意义。DC主要有2种亚群:髓样 DCs (myeloid DCs,mDCs)是最重要的抗原提呈细胞,通过Toll样受体来产生IL-4等;浆系 DCs(plasmacytoid DCs,pDCs)通过TLR7和TLR来产生干扰素(IFN)和肿瘤坏死因子-α(TNF-α)等,从而激活免疫反应形成抗病毒免疫屏障[3], 而在ACLF患者体内DC数量及功能下调,HBV抗原信息不能提呈给T淋巴细胞和HBV特异性T细胞免疫应答障碍,诱导ACLF的发生。在体外通过HBsAg致敏自体树突状细胞(抗HBV-DCs)治疗对ACLF可能发挥一定效果。恩替卡韦(ETV)是目前常用的抗HBV感染药物,具有直接抑制HBV作用。目前抗HBV治疗是治疗ACLF的手段之一,但调节机体免疫失衡,突破机体免疫耐受是有利于对病毒的清除和纠正免疫失衡。有研究结果显示,DC疫苗可通过调节机体免疫失衡而抑制甚至清除病毒。为此笔者特将2015年7月至2018年6月ETV联合特异性树突细胞疫苗治疗HBV相关ACLF患者外周血 DCs亚群频率分布及TNF-α、IFN-γ、IL-4水平变化结果报告如下。
1 资料与方法
1.1 一般资料 选择川北医学院附属医院2015年7月至2018年6月住院治疗的64例HBV相关ACLF患者为研究对象,其中男50例,女14例,年龄17~61岁,平均(29.8±17.6)岁。研究对象的64例ACLF患者外周血清HBsAg及HBV DNA均阳性。ACLF患者诊断符合《肝衰竭诊治指南(2012年版)》[4]中诊断标准。ACLF患者随机分为两组,抗HBV-DCs联合ETV治疗组(联合治疗组)32例,其中男25例,女7例,给予ETV(江苏正大天晴药业股份有限公司产品)0.5 mg口服,1次/d,同时给予HBV-DCs悬液从外周静脉回输到ACLF患者体内,观察6个月,在治疗的前3个月,每半个月输入HBV-DCs悬液1次;治疗后 3个月每月输入HBV-DCs悬液1次。ETV单独治疗组(单独治疗组)32例,其中男26例,女6例,仅给予ETV 0.5 mg口服,1次/d。联合治疗组与单独治疗组同时接受综合保肝治疗措施。选取同期HBsAg阴性的年龄、性别与研究对象相匹配的健康志愿者20例为对照组,其中男15例,女5例,年龄(28.4±16.5)岁。3组之间年龄、性别差异无统计学意义(P>0.05)。所有研究对象均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)年龄>18岁且<65岁;(2)HBV相关ACLF患者诊断符合《肝衰竭诊治指南(2012年版)》诊断标准;(3)近6个月内未用免疫调节药,未接受过抗HBV治疗。排除标准:(1)合并其他嗜肝病毒感染以及其他原因所致的ACLF患者;(2)合并肿瘤、自身免疫性疾病、糖尿病、高血压、心脏病;(3)妊娠及哺乳期妇女。
1.3 研究方法
1.3.1 标本的采集 联合治疗组与单独治疗组在研究前及研究开始3、6个月时分别检测肝功能、乙肝两对半、HBV DNA,同时抽取外周静脉血15 mL,加入10 U/mL肝素抗凝,其中10 mL应用流式细胞仪检测DC数量及频率、T淋巴细胞亚群,5 mL应用双抗体夹心ABC-ELISA法检测TNF-α、IFN-γ、IL-4水平。健康志愿者同上述过程。
1.3.2 DC分离及培养 外周静脉血采集后2 h内制备单个核细胞。按1∶1比例PBS缓冲液混匀稀释静脉血,将混匀外周静脉血沿管壁缓慢加入已有淋巴细胞分离液的离心管中(静脉血与分离液的比例为2∶1),使两者有明显的分界,室温2 000 r/min离心30 min,离心后用毛细吸管轻轻吸取血浆与淋巴细胞分离液之间的灰白色云雾层,转入一干净离心管中,加入5倍体积的PBS缓冲液,2 000 r/min离心10 min,弃上清液,1 500 r/min离心10 min,弃上清液。用不含血清的RPMI 1640培养基悬浮沉淀细胞,吸管吹打混匀,调整细胞浓度为1×106·mL-1,按每孔2 mL加入6孔板中,置于37℃、5%CO2孵箱中孵育,2 h后弃上清液,用预热的RPMI 1640轻轻洗去悬浮细胞,往贴壁细胞中加入含10%胎牛血清的RPMI 1640培养基2 mL/孔,按含rhGM-CSF 100 ng/mL、rhIL-4 100 ng/mL终浓度加入细胞因子,置37℃、5%CO2孵箱中培养,隔日半量换液1次(含细胞因子rhGM-CSF 50 ng/mL、rhIL-4 50 ng/mL),第5天加入TNF-α(100 ng/mL),第7天收集悬浮细胞并计数。
1.3.3 DC的数量及频率检测 采用直接荧光抗体标记收集DC,流式细胞仪检测外周血DC频率及数量、髓样及浆细胞样树突状细胞数量与频率。
1.3.4 TNF-α、IFN-γ、IL-4的含量检测 取5 mL抗凝血,2 500 r/min离心20 min,取上清液放于无菌的EP管内,将分离的血清标本置于-80℃冰箱保存待检。采用双抗体夹心ABC-ELISA法检测,操作方法按照产品说明书进行。
1.3.5 抗HBV-DCs 制备与治疗 用低分子肝素抗凝管取ACLF患者静脉血20 mL,采取密度梯度离心法获取PBMC。在37℃、5% CO2条件下以PRMI 1640培养液培养孵育,加入GM-CSF和IL-4等诱导PBMC分化为非成熟的DC。在培养孵育第6天加入HBsAg蛋白短期刺激使DC负载HBV的HBsAg,加入TNF-α、IL-4、CD40L和PGE2混合因子诱导DC成熟。在培养第7天获取体外抗HBV-DCs,数量为(1~10)×106,用20~40 mL生理盐水混悬待用。治疗的前3个月,每半月输HBV-DCs悬液1次;治疗3月后每月输入HBV-DCs悬液1次。
1.3.6 T 淋巴细胞表面标志物检测 采用美国BD公司流式细胞仪及相关抗体进行检测外周血CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T亚群百分比及CD4+T/CD8+T比值。
1.3.7 主要仪器、试剂与检测方法 CO2培养箱(Thermo Forma,美国),FACScalibur流式细胞仪(美国BD公司),采用贝克曼全自动生化分析仪检测肝功能;高速台式离心机(CR4I,Thermo);振荡仪(苏州太仓市实验设备厂)。
血清HBV标志物选取Roche公司试剂盒运用电化学发光法检测;血清HBV DNA水平选取广州达安基因诊断试剂公司试剂盒运用PCR法检测;TNF-α、IFN-γ、IL-4检测试剂盒(美国BioSource公司), rhGM-CSF、rhIL-4、鼠抗人CD40, CD83, 1640培养液来源于河北博海生物工程公司, HBsAg来源于中国预防医学科学院病毒所。
2 结果
2.1 外周血DC数量及频率比较 联合治疗组与单独治疗组患者治疗前DC数量及频率较对照组水平低(P<0.05),两治疗组之间治疗前DC数量及频率比较差异无统计学意义(P>0.05),两治疗组治疗后外周血DC数量及频率较治疗前显著上调(P<0.05),联合治疗组较单独治疗组上调更明显(P<0.05),结果见表1。
2.2 外周血TNF-α、IFN-γ、IL-4水平比较 两治疗组治疗前TNF-α、IFN-γ水平较对照组高,IL-4水平较对照组低,差异有统计学意义(P<0.05),两治疗组治疗前TNF-α、IFN-γ、IL-4水平间差异无统计学意义(P>0.05),治疗后联合治疗组TNF-α、IFN-γ水平下调较单独治疗组明显,联合治疗组IL-4水平上调水平较单独治疗组显著(P<0.05),两治疗组治疗后TNF-α、IFN-γ水平下降明显,IL-4水平逐渐升高,治疗24周后复常,较治疗前比较差异有统计学意义(P<0.05),结果见表2。
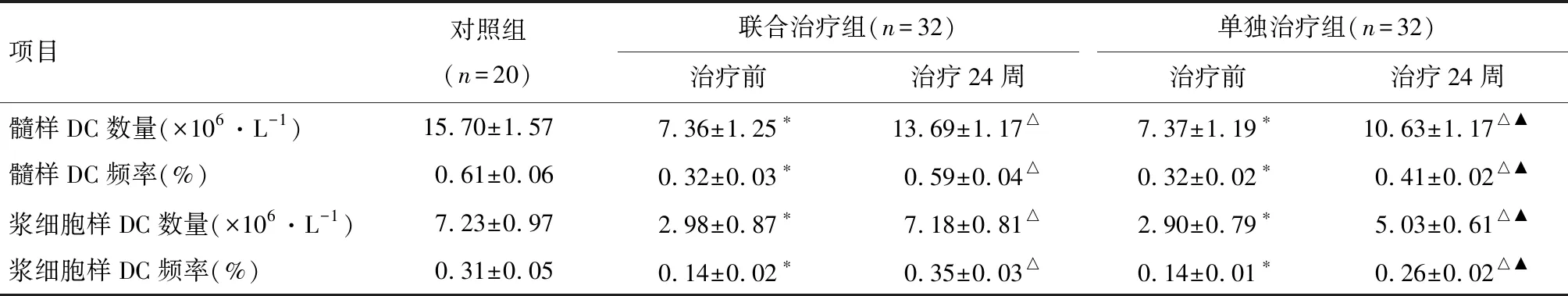
项目对照组(n=20)联合治疗组(n=32)单独治疗组(n=32)治疗前治疗24周治疗前治疗24周髓样DC数量(×106·L-1)15.70±1.577.36±1.25∗13.69±1.17△7.37±1.19∗10.63±1.17△▲髓样DC频率(%)0.61±0.060.32±0.03∗0.59±0.04△0.32±0.02∗0.41±0.02△▲浆细胞样DC数量(×106·L-1)7.23±0.972.98±0.87∗7.18±0.81△2.90±0.79∗5.03±0.61△▲浆细胞样DC频率(%)0.31±0.050.14±0.02∗0.35±0.03△0.14±0.01∗0.26±0.02△▲
注:*与对照组比较P<0.05;△与本组治疗前比较P<0.05;▲与联合治疗组治疗24周比较P<0.05
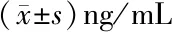
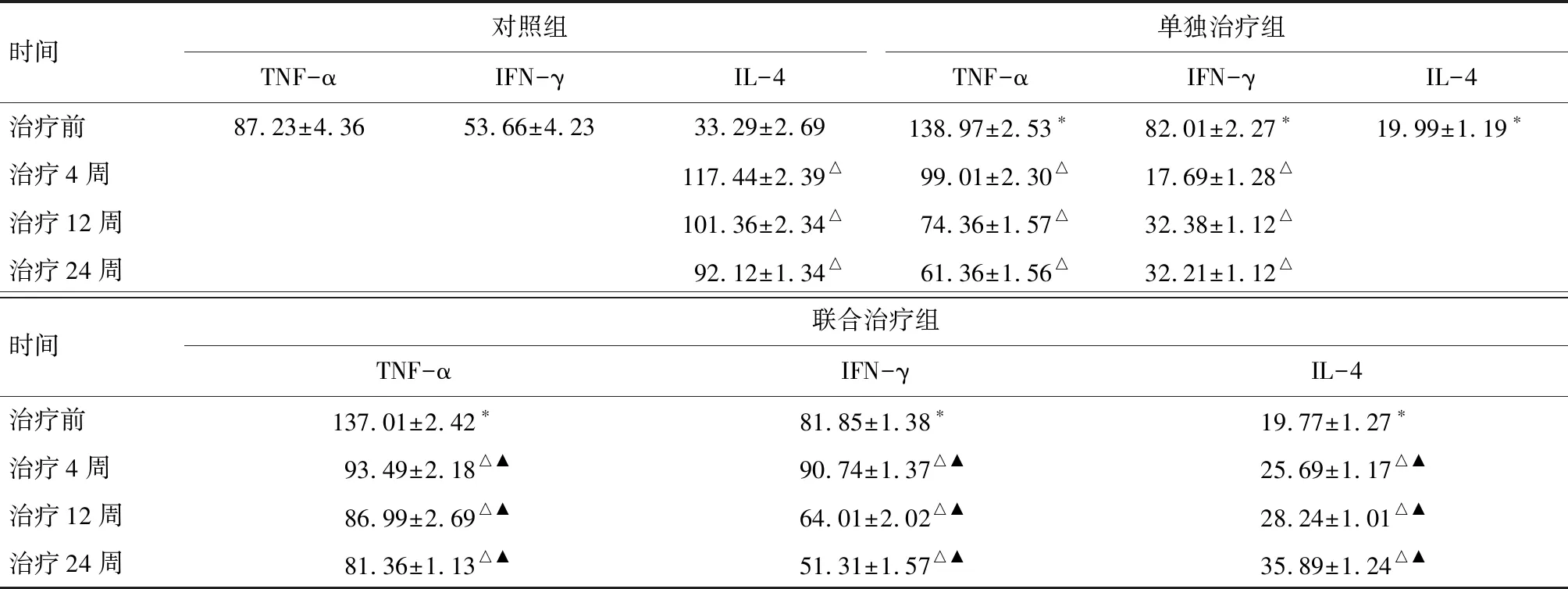
时间对照组单独治疗组TNF-αIFN-γIL-4TNF-αIFN-γIL-4治疗前87.23±4.3653.66±4.2333.29±2.69138.97±2.53∗82.01±2.27∗19.99±1.19∗治疗4周117.44±2.39△99.01±2.30△17.69±1.28△治疗12周101.36±2.34△74.36±1.57△32.38±1.12△治疗24周92.12±1.34△61.36±1.56△32.21±1.12△时间联合治疗组TNF-αIFN-γIL-4治疗前137.01±2.42∗81.85±1.38∗19.77±1.27∗治疗4周93.49±2.18△▲90.74±1.37△▲25.69±1.17△▲治疗12周86.99±2.69△▲64.01±2.02△▲ 28.24±1.01△▲治疗24周81.36±1.13△▲51.31±1.57△▲35.89±1.24△▲
注:*与对照组比较P<0.05;△与本组治疗前比较P<0.05;▲与单独治疗组比较P<0.05
2.3 外周血T淋巴细胞亚群水平影响分析 对照组外周血CD3+T、CD4+T水平高于治疗前治疗组水平,CD8+T低于治疗组水平(P<0.05),治疗前治疗组间CD3+T、CD4+T、CD8+T水平差异无统计学意义(P>0.05),治疗后CD3+T、CD4+T水平较治疗前上调明显,CD8+T水平下调显著(P<0.05),治疗后联合治疗组CD3+T、CD4+T水平较单独治疗组上调明显(P<0.05),结果见表3。
2.4 外周血DC数量与T淋巴细胞亚群水平的相关性 ACLF患者治疗前外周血树突状细胞数量与CD3+T、CD4+T水平呈正相关(P<0.05),与CD8+T水平呈负相关(P>0.05),结果见表4。


项目对照组联合治疗组治疗前单独治疗组治疗前联合治疗组治疗24周后单独治疗组治疗24周后CD3+T69.92±2.2665.17±2.15∗64.28±2.27∗71.65±2.33 △65.12±2.13 ▲CD4+T46.88±2.9830.69±1.65∗31.02±1.85∗48.39±2.41△33.05±2.22▲CD8+T30.12±2.2339.65±2.15∗40.05±1.74∗29.97±1.15△30.25±1.28△
注:*与对照组比较P<0.05;△与本组治疗前比较P<0.05;▲与联合治疗组治疗24周后比较P<0.05

表4 外周血DC数量与T淋巴细胞亚群水平的相关性
3 讨论
DC能激活细胞免疫,利用DC制备HBV核心疫苗治疗HBV相关性肝病已成为当前研究HBV相关性肝病的热点之一。通常使用病毒抗原肽或蛋白直接冲击DC来致敏DC[5],再回输或免疫接种到相应病毒宿主,致敏后的DC治疗能诱导出病毒抗原特异性CTL,打破免疫耐受、促进免疫应答。研究发现,HBV相关性肝病患者DC存在发育与功能异常,导致CD4+T细胞不能接受抗原提呈,导致细胞免疫能力紊乱与失常。在体外特异性抗原激活DC后,能活化CTL而杀伤HBV感染的靶细胞。主要调节以TNF-α、IFN-γ、IL-4 等Th1/Th2型细胞因子的失衡,诱发急性自限性感染和HBV清除,IL-4等为Th2型细胞因子,诱导HBV持续感染,导致HBV清除障碍,HBV感染致Th1/Th2细胞及其细胞因子失衡与细胞免疫功能低下。通过给予抗HBV-DCs治疗可能提高Th1型细胞因子水平,增强或恢复机体抗HBV免疫力,有利于对HBV的清除[6]。研究显示,自体DC疫苗治疗HBeAg阳性慢性乙型病毒性肝炎患者在肝功能改善、HBeAg血清学转换率、HBV DNA阴转方面均取得了较好的疗效[7]。
本研究结果显示,治疗组治疗前DC数量及频率较对照组水平低(P<0.05),两治疗组治疗前DC数量及频率比较差异无统计学意义(P>0.05),治疗组治疗后外周血DC数量及频率较治疗前显著上调(P<0.05),治疗后外周血DC数量及频率联合治疗组较单独治疗组上调明显(P<0.05)。研究结果显示,ACLF患者DC的数量及频率低于对照组。ACLF患者DC量下调明显,表明ACLF患者DC发育、功能和成熟障碍。本研究显示,抗HBV-DCs能明显提高DC的数量与功能,促进DC的成熟,ETV联合抗HBV-DCs治疗ACLF患者不仅能抑制HBV复制,也能纠正机体免疫失衡,打破机体免疫耐受,活化T细胞。笔者探讨ETV联合抗HBV-DCs治疗过程中ACLF患者免疫细胞数量与功能所发生的变化,表明联合治疗可对抑制HBV复制有一定协同作用,在一定程度上改善ACLF患者免疫功能,提高患者生成率,这与孙春伟等[8]报道基本一致。
有研究应用自体回输树突状细胞-细胞因子诱导的杀伤细胞联合ETV治疗慢性乙肝时,能有效降低IFN-γ水平,改善机体免疫功能[9]。本研究应用HBsAg致敏自体DC治疗ACLF患者,研究发现两治疗组治疗前TNF-α、IFN-γ水平较对照组高,IL-4水平较对照组低,差异有统计学意义(P<0.05),两治疗组治疗前TNF-α、IFN-γ、IL-4水平间差异无统计学意义(P>0.05),治疗后联合治疗组TNF-α、IFN-γ水平下调较单独治疗组明显,联合治疗组IL-4水平上调水平较单独治疗组显著(P<0.05),两治疗组治疗后TNF-α、IFN-γ水平下降明显,IL-4水平逐渐升高,治疗24周后复常,较治疗前比较差异有统计学意义(P<0.05)。ACLF是宿主免疫系统对HBV复制调控、抗原免疫应答及所致炎症活动的结果, ETV联合抗HBV-DCs治疗可对HBV复制和免疫调节发生作用,两者联合治疗对DC成熟与相应细胞因子水平失衡的纠正具有一定协同与调控作用,可弥补ETV不能直接清除HBV的缺点,从而起到病原学治疗作用。研究发现联合组TNF-α、IFN-γ水平在治疗4周水平下降,在病情好转后水平与对照组水平一致,而IL-4水平在治疗4周后随病情好转逐渐升高,病情好转后和对照组一致,显示抗HBV-DCs治疗能明显调节Th1/Th2型细胞因子水平,从而达到调控肝组织炎症的发生与病毒清除的作用。本研究提示, 抗HBV-DCs联合ETV抗病毒治疗可能突破ACLF的CTL低应答状态, 抗HBV-DCs治疗有利于机体抗HBV免疫的恢复或增强,为清除病毒创造条件。笔者认为,通过体外用HBsAg对 DC致敏并回输体内的治疗,能够直接或间接抑制HBV复制,降低促炎因子TNF-α、IFN-γ表达水平,减轻肝组织炎症与损伤程度,显示抗HBV-DCs治疗对促炎性因子的明显抑制作用。表明体外运用一定的技术激活DC后可提高抗原的提呈功能并促进其成熟和功能复常, 回输体内后能诱导出抗原特异性的CTL并突破机体的免疫耐受状态,诱导免疫系统对HBV感染后靶细胞的杀伤,起到清除HBV的作用。
本研究结果表明,对照组外周血CD3+T、CD4+T水平高于治疗前治疗组水平,CD8+T低于治疗组水平(P<0.05),治疗前治疗组间CD3+T、CD4+T、CD8+T水平差异无统计学意义(P>0.05),治疗后CD3+T、CD4+T水平较治疗前上调明显,CD8+T水平下调显著(P<0.05),治疗后联合治疗组CD3+T、CD4+T水平较单独治疗组上调明显(P<0.05),同时ACLF患者治疗前外周血DC数量与CD3+T、CD4+T水平呈正相关(P<0.05),与CD8+T水平呈负相关(P>0.05),提示抗HBV-DCs治疗能明显提高T淋巴细胞的数量与功能,调节机体的免疫失衡状态,抑制ACLF的炎症发生,促进HBV的清除,这与徐公民[10]报道一致。
本研究探讨了ETV联合抗HBV-DCs治疗ACLF患者机体T细胞数量及功能变化,显示特异性DC疫苗可间接抑制HBV-DNA复制,调节机体免疫失衡,HBV-DC疫苗可增强抗原递呈细胞的抗原递呈功能,又可以促进DC-T细胞间的协同作用。但DC疫苗免疫途径、免疫间隔周期和频次等都可能影响DC疫苗效果,抗HBV-DCs在临床应用中还存在一些障碍,如DC来源、抗原负载路经、DC在体外培养周期、如何判断DC的成熟与否、免疫治疗周期、剂量及途径等,都可能影响抗HBV-DCs治疗效果。尽管DC疫苗还存在一些问题,疗效有待进一步提高,但DC疫苗可能是ACLF等HBV相关性肝病生物治疗的一种新途径。
本研究的不足之处在于样本量较小,观察时间短,未对早期、中期、晚期不同时期ACLF患者的治疗效果加以比较。下一步我们将扩大样本量,延长观察时间,观察抗HBV-DCs治疗不同病情程度的ACLF患者的疗效。
