紫斑牡丹种子浸提液对植物种子萌发和幼苗生长的影响1)
2020-04-10李婉茹唐红何丽霞
李婉茹 唐红 何丽霞
(甘肃农业大学,兰州,730070) (甘肃省牡丹工程研究中心)
紫斑牡丹(Paeoniarockii)是芍药科芍药属牡丹组木本植物,因其花瓣基部有一个明显的斑块而得名,主要分布于四川北部、甘肃南部和陕西南部(太白山区)等地[1]。紫斑牡丹作为我国特有的传统花卉,具有花大色艳、品种繁多、生长旺盛、抗旱抗寒和适应性强等优点[2]。而且紫斑牡丹根皮可入药,具有凉血散瘀之功效[3]。同时,紫斑牡丹种子含油丰富,富含不饱和脂肪酸,其中亚麻酸含量达到45%,远高于世界卫生组织推荐的多不饱和脂肪酸高于8.00%的保健型营养油脂标准[4]。因此,紫斑牡丹是集观赏、药用及食用价值于一身的木本植物,具有极大的经济效益和开发前景。目前,种子繁殖仍是紫斑牡丹大规模培养以及新品种培育常用的繁殖方式之一。但是由于紫斑牡丹种子在自然条件下,大多处于休眠状态,萌发成苗极其困难,这也是野生紫斑牡丹导致濒危的重要原因之一[5],而且野生紫斑牡丹已被列为国家三级保护植物[6],现已列入《国家重点保护野生植物名录》中。
种子内部存在抑制物质是种子休眠的主要原因之一[7]。关于种子内源抑制物质的研究可以为打破种子休眠和探究休眠机理提供试验依据。丁言等[8]研究发现,凤丹牡丹(Paeoniaostii)种子的种皮、胚乳和种胚尤其是胚乳中含有某些影响白菜(Brassicacampestris)种子萌发和幼苗生长的化学物质,这可能是凤丹牡丹种子休眠的重要原因。宋会兴等[9]发现,四川牡丹(Paeoniadecomposita)种子内源抑制物质可能是其种子休眠的重要原因。杨勇等[10]研究发现,四川牡丹胚乳中存在内源抑制物质,其种类和成分比较复杂。张翔宇等[11]研究发现,大花黄牡丹(Paeonialudlowi)种子内源抑制物质是其种子休眠的主要原因,而且抑制物质主要存在于胚乳中。利用种子不同部位的浸提液对受体植物种子萌发和幼苗生长的影响来研究种子休眠的内源抑制物质已有广泛应用[9,11-12]。本试验以紫斑牡丹种子为研究对象,以白菜、小麦(Triticumaestivum)和绿豆(Vignaradiate)种子为受体植物,通过紫斑牡丹种皮和胚乳不同质量浓度的水浸提液对受体植物的萌发、幼苗生长和抗氧化酶活性的初步研究,为进一步研究紫斑牡丹种子休眠提供理论依据。
1 材料与方法
紫斑牡丹种子于2018年9月份采自甘肃省兰州市省科技厅南山绿化基地。白菜、小麦和绿豆种子为市售品种“甘科”“陇泰29号”和“甜翠1号”。
种子浸提液的提取:取饱满的紫斑牡丹种子,分离种皮和胚乳并研碎,各取10.00 g放入锥形瓶中,并加入80 mL超纯水,保鲜膜封口后置于25 ℃恒温箱浸提24 h。将浸提液在5 000 r·min-1条件下离心5 min。取上清液定容至100 mL,即为0.1 g·mL-1的浸提液。再用超纯水将上述浸提液配制成0、0.025、0.050、0.075、0.100 g·mL-1的浸提液,4 ℃保存备用[9,11]。
种子内源抑制物质活性测定:白菜、小麦和绿豆种子用0.5%的KMnO4消毒30 min,用蒸馏水冲洗干净后取颗粒饱满的种子备用。取各个处理的浸提液10 mL加入铺有两层滤纸的直径为9 cm的培养皿中。每个处理3次重复,每个重复30粒种子。置于25 ℃人工气候箱中培养。以露出子叶为发芽标准[13],48 h后统计白菜、小麦和绿豆种子的发芽率;5 d后测幼苗根长、苗高和鲜质量;采用氮蓝四唑(NBT)还原法、紫外吸收法和愈创木酚法分别测定幼苗的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性。
试验数据采用EXCEL2010和SPSS20.0进行分析。
2 结果与分析
2.1 紫斑牡丹种皮和胚乳浸提液对受体植物种子萌发的影响
由表1可知,随着紫斑牡丹种皮浸提液质量浓度的提高,白菜种子的发芽率只有在种皮浸提液质量浓度较高时才有下降趋势,小麦种子的发芽率则呈现出先上升后下降的趋势,而绿豆种子的发芽率逐渐降低。白菜种子发芽率在种皮浸提液质量浓度为0.100 g·mL-1时才受到显著抑制(P<0.05),而小麦和绿豆种子的发芽率在种皮浸提液质量浓度为0.075 g·mL-1时就受到显著抑制。当种皮浸提液质量浓度为0.100 g·mL-1时,白菜、小麦和绿豆种子的发芽率与CK相比,分别下降了15.29%、15.66%和26.93%。
表1紫斑牡丹种皮和胚乳浸提液对受体植物种子发芽率的影响
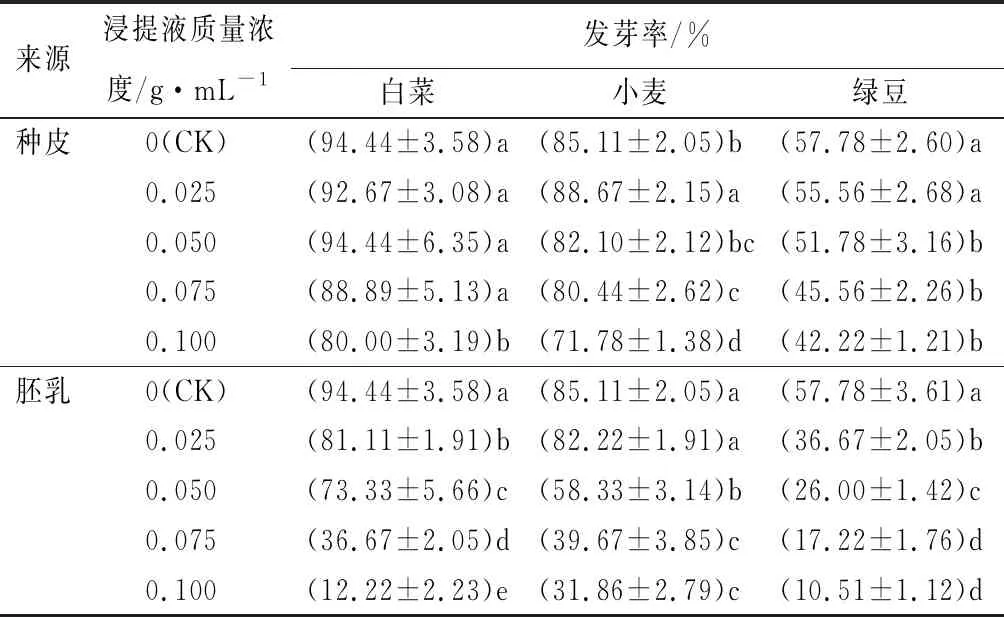
来源浸提液质量浓度/g·mL-1发芽率/%白菜小麦绿豆种皮0(CK)(94.44±3.58)a(85.11±2.05)b(57.78±2.60)a0.025(92.67±3.08)a(88.67±2.15)a(55.56±2.68)a0.050(94.44±6.35)a(82.10±2.12)bc(51.78±3.16)b0.075(88.89±5.13)a(80.44±2.62)c(45.56±2.26)b0.100(80.00±3.19)b(71.78±1.38)d(42.22±1.21)b胚乳0(CK)(94.44±3.58)a(85.11±2.05)a(57.78±3.61)a0.025(81.11±1.91)b(82.22±1.91)a(36.67±2.05)b0.050(73.33±5.66)c(58.33±3.14)b(26.00±1.42)c0.075(36.67±2.05)d(39.67±3.85)c(17.22±1.76)d0.100(12.22±2.23)e(31.86±2.79)c(10.51±1.12)d
注:表中数据为平均值±标准差,平均值经过反正弦后进行方差分析;同列数据后不同字母表示差异显著(P<0.05)。
由表1可以看出,随着紫斑牡丹胚乳浸提液质量浓度的提高,白菜、小麦和绿豆种子的发芽率均呈现出下降的趋势,而且质量浓度越高,下降趋势越明显。其中,当胚乳浸提液质量浓度为0.025 g·mL-1时,白菜和绿豆种子的发芽率与CK相比就受到显著抑制。而当胚乳浸提液质量浓度为0.100 g·mL-1时,白菜、小麦和绿豆种子的发芽率与CK相比,分别下降了87.06%、62.57%和81.81%。
综上可以看出,紫斑牡丹种皮和胚乳浸提液中均有能够抑制受体植物种子萌发的物质,而且胚乳浸提液对受体植物种子萌发的抑制作用强于种皮浸提液。说明与种皮相比,紫斑牡丹胚乳中含有活性较高的内源抑制物质,能够抑制受体植物种子的萌发。
2.2 紫斑牡丹种皮和胚乳浸提液对受体植物幼苗生长的影响
由表2可以看出,紫斑牡丹种皮和胚乳浸提液对白菜幼苗的影响各不相同。种皮浸提液对白菜幼苗的根长和苗高均有抑制作用,而且抑制作用随着浸提液质量浓度的提高而增强。但低质量浓度的种皮浸提液对白菜幼苗鲜质量无明显作用,当种皮浸提液质量浓度为0.075 g·mL-1时,白菜幼苗鲜质量与CK相比显著降低。胚乳浸提液对白菜幼苗的根长、苗高和鲜质量均有抑制作用,抑制作用与胚乳浸提液质量浓度成正比。其中当胚乳浸提液质量浓度为0.025 g·mL-1时,白菜幼苗的根长、苗高和鲜质量分别比CK显著降低了74.39%、50.00%和33.33%。
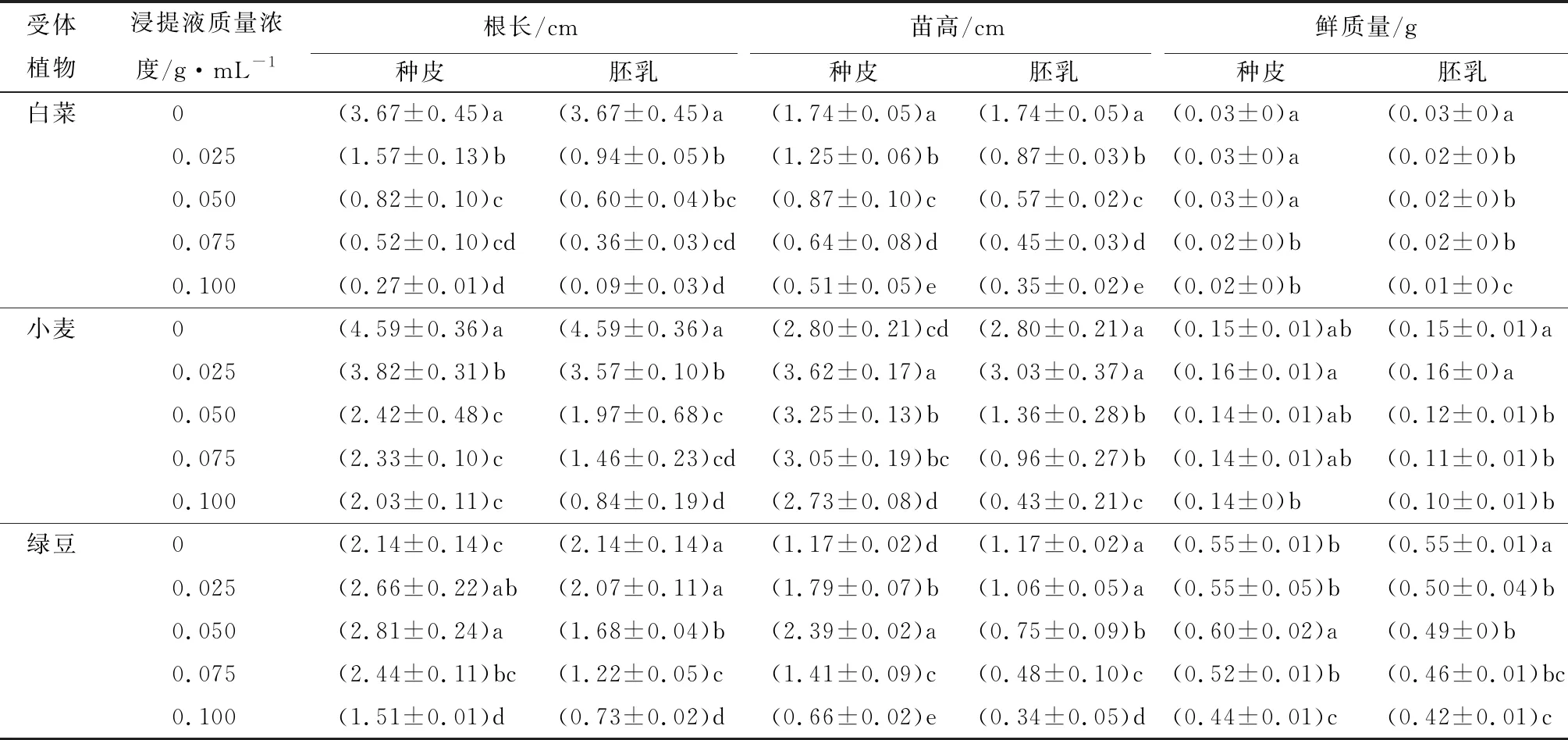
表2 紫斑牡丹种皮和胚乳浸提液对受体植物幼苗根长、苗高和鲜质量的影响
注:表中数据为平均值±标准差,平均值经过反正弦后进行方差分析;同列数据后不同字母表示差异显著(P<0.05)。
由表2可知,紫斑牡丹种皮和胚乳浸提液对小麦幼苗的根长具有显著抑制作用。小麦幼苗的苗高和鲜质量则随着浸提液质量浓度的提高而表现出先增加后降低的趋势。其中,种皮和胚乳浸提液质量浓度为0.025 g·mL-1时,小麦幼苗的苗高和鲜质量达到最大值。种皮浸提液对小麦苗高具有促进作用,而胚乳浸提液为0.050 g·mL-1时,对小麦幼苗苗高呈现抑制作用。
表2显示,随着紫斑牡丹种皮浸提液质量浓度的提高,绿豆幼苗的根长、苗高和鲜质量表现出先升高后降低的趋势,当种皮浸提液质量浓度为0.050 g·mL-1时,绿豆幼苗的根长、苗高和鲜质量均达到最大值。而绿豆幼苗的根长和苗高却随着胚乳浸提液质量浓度的升高而逐渐降低,当胚乳浸提液质量浓度为0.050 g·mL-1时,绿豆幼苗的根长、苗高和鲜质量与CK相比分别显著降低了21.50%、35.90%和10.10%。
总之,紫斑牡丹的种皮和胚乳中均含有抑制受体植物种子萌发和幼苗生长的物质,而胚乳浸提液对受体植物幼苗生长的抑制作用大于种皮浸提液。说明紫斑牡丹种皮和胚乳中均含有内源抑制物质,且胚乳中的内源抑制物的抑制作用强于种皮,这些内源抑制物质对受体植物幼苗的根长的抑制尤为显著。
2.3 紫斑牡丹种皮和胚乳浸提液对受体植物幼苗抗氧化酶活性的影响
由表3可以看出,随着种皮浸提液质量浓度的提高,白菜、小麦和绿豆幼苗的SOD活性呈现出先升高后降低的趋势。其中,白菜、小麦和绿豆幼苗的SOD活性分别在浸提液质量浓度为0.050、0.050、0.075 g·mL-1时达到最大值。而与CK相比,白菜和绿豆幼苗的SOD活性在浸提液质量浓度为0.050 g·mL-1时显著提高;而小麦幼苗的SOD活性在种皮浸提液质量浓度为0.025、0.050 g·mL-1时与CK相比并未显著提高,而在浸提液质量浓度为0.075 g·mL-1时却显著下降。同时,随着胚乳浸提液质量浓度的提高,白菜、小麦和绿豆幼苗的SOD活性同样表现出先升高后降低的趋势,和种皮浸提液类似。其中,白菜、小麦和绿豆幼苗的SOD活性分别在浸提液质量浓度为0.025、0.050、0.050 g·mL-1时达到最大值,与CK相比均显著提高。各个浸提液质量浓度下的白菜和小麦幼苗的SOD活性与CK相比均达到显著水平。
从而可以看出,种皮和胚乳浸提液均能够影响受体植物幼苗的SOD活性,相比于种皮浸提液,胚乳浸提液对受体植物幼苗的SOD活性的影响强于种皮浸提液。
表3紫斑牡丹种皮和胚乳浸提液对受体植物幼苗抗氧化酶活性的影响
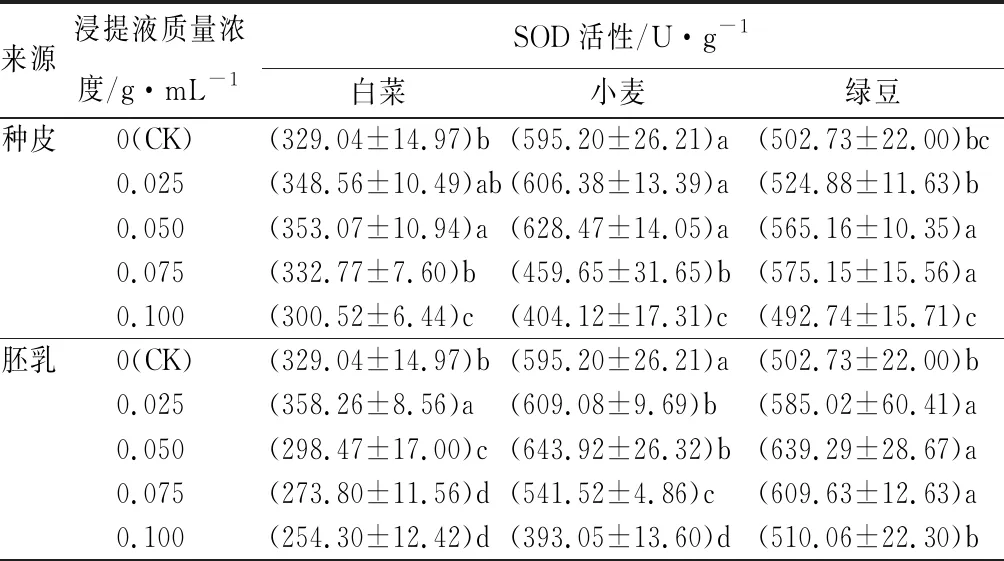
来源浸提液质量浓度/g·mL-1SOD活性/U·g-1白菜小麦绿豆种皮0(CK)(329.04±14.97)b(595.20±26.21)a(502.73±22.00)bc0.025(348.56±10.49)ab(606.38±13.39)a(524.88±11.63)b0.050(353.07±10.94)a(628.47±14.05)a(565.16±10.35)a0.075(332.77±7.60)b(459.65±31.65)b(575.15±15.56)a0.100(300.52±6.44)c(404.12±17.31)c(492.74±15.71)c胚乳0(CK)(329.04±14.97)b(595.20±26.21)a(502.73±22.00)b0.025(358.26±8.56)a(609.08±9.69)b(585.02±60.41)a0.050(298.47±17.00)c(643.92±26.32)b(639.29±28.67)a0.075(273.80±11.56)d(541.52±4.86)c(609.63±12.63)a0.100(254.30±12.42)d(393.05±13.60)d(510.06±22.30)b
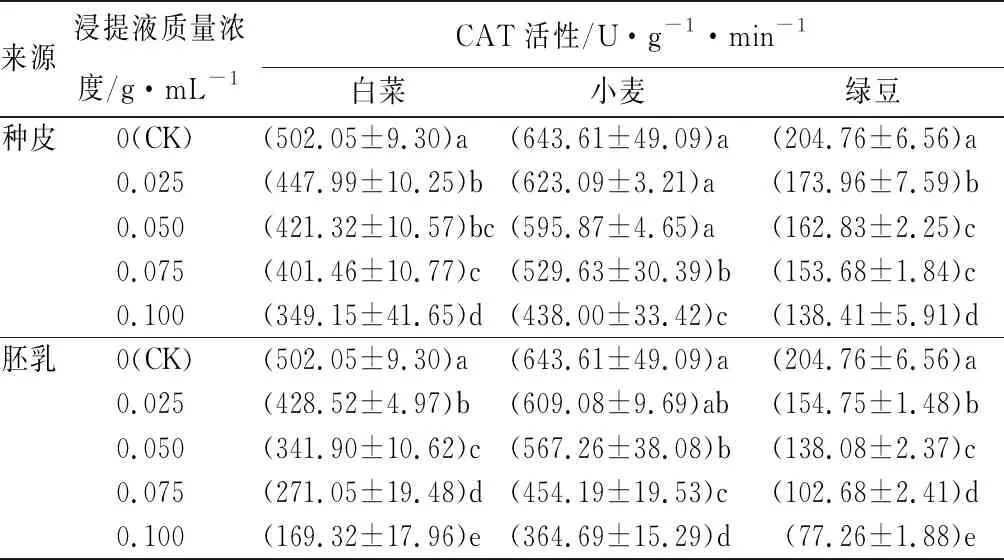
来源浸提液质量浓度/g·mL-1CAT活性/U·g-1·min-1白菜小麦绿豆种皮0(CK)(502.05±9.30)a (643.61±49.09)a(204.76±6.56)a0.025(447.99±10.25)b(623.09±3.21)a(173.96±7.59)b0.050(421.32±10.57)bc(595.87±4.65)a(162.83±2.25)c0.075(401.46±10.77)c(529.63±30.39)b(153.68±1.84)c0.100(349.15±41.65)d(438.00±33.42)c(138.41±5.91)d胚乳0(CK)(502.05±9.30)a(643.61±49.09)a(204.76±6.56)a0.025(428.52±4.97)b(609.08±9.69)ab(154.75±1.48)b0.050(341.90±10.62)c(567.26±38.08)b(138.08±2.37)c0.075(271.05±19.48)d(454.19±19.53)c(102.68±2.41)d0.100(169.32±17.96)e(364.69±15.29)d(77.26±1.88)e

来源浸提液质量浓度/g·mL-1POD活性/U·g-1·min-1白菜小麦绿豆种皮0(CK)(24547.42±260.54)b(12358.33±101.53)c(24354.89±449.84)ab0.025(24467.57±211.82)bc(13259.63±329.59)c(25731.19±513.12)ab0.050(25478.22±393.58)a(15269.54±1087.02)b(22952.27±1763.18)bc0.075(24821.30±202.75)b(16485.94±582.97)a(22577.11±1686.33)bc0.100(23997.30±175.44)c(8159.89±214.50)d(21171.20±381.25)c胚乳0(CK)(24547.42±260.54)a(12358.33±101.53)a(24354.88±449.84)a0.025(19441.95±442.06)b(8924.85±220.98)b(22188.67±701.85)b0.050(11875.69±599.23)c(5487.64±94.32)c(20681.75±832.94)c0.075(5107.13±140.62)d(5296.28±50.82)c(18743.96±741.78)d0.100(4371.11±79.86)e(4667.61±162.82)d(17486.44±1065.68)d
注:表中数据为平均值±标准差,平均值经过反正弦后进行方差分析;同列数据后不同字母表示差异显著(P<0.05)。
由表3可以看出,随着种皮浸提液质量浓度的提高,白菜、小麦和绿豆幼苗的CAT活性出现下降的趋势。其中,白菜和绿豆幼苗的CAT活性与浸提液质量浓度成反比,而且各个处理间具有显著差异,而小麦幼苗的CAT活性在浸提液质量浓度为0.075 g·mL-1时,与CK相比才达到显著差异。同时,随着胚乳浸提液质量浓度的提高,白菜、小麦和绿豆幼苗CAT活性变化与种皮浸提液类似,表现出下降的趋势。其中,白菜和绿豆幼苗的CAT活性在浸提液质量浓度为0.025 g·mL-1时,与CK相比显著降低,同时各个处理间具有显著差异,而小麦幼苗的CAT活性在浸提液质量浓度为0.050 g·mL-1时,与CK相比差异显著。
在种皮浸提液质量浓度为0.100 g·mL-1时,白菜、小麦和绿豆幼苗的CAT活性比CK分别显著降低了30.46%、31.95%和32.41%;而胚乳浸提液在此质量浓度下,3种受体植物幼苗的CAT活性分别降低了66.27%、43.34%和62.27%。以上数据说明,相同质量浓度的胚乳浸提液对受体植物幼苗CAT活性的抑制作用强于种皮浸提液。由此可知,相比于种皮浸提液,胚乳浸提液中的物质能够更显著的抑制受体植物幼苗的CAT活性。
由表3可知,白菜、小麦和绿豆幼苗POD活性随着种皮浸提液质量浓度的提高而表现出先上升后下降的趋势。白菜、小麦和绿豆幼苗POD活性分别在种皮浸提液质量浓度为0.050、0.075、0.025 g·mL-1时达到最大值,但此时绿豆幼苗的POD活性与CK相比并未达到显著性水平。同时,白菜、小麦和绿豆幼苗的POD活性与胚乳浸提液的质量浓度呈反比。当胚乳浸提液质量浓度为0.025 g·mL-1时,3种受体植物幼苗的POD活性与CK相比均达到显著水平。当胚乳浸提液质量浓度为0.100 g·mL-1时,白菜、小麦和绿豆幼苗的CAT活性与CK相比,分别显著下降了82.19%、62.23%和28.20%。
综上所述,紫斑牡丹胚乳浸提液对3种受体植物幼苗的POD活性的影响强于种皮,而且对白菜幼苗POD活性的影响最为显著。说明紫斑牡丹胚乳浸提液中的物质对受体植物幼苗特别是白菜幼苗的POD活性产生了更为显著的影响。
3 结论与讨论
紫斑牡丹种子在自然条件下处于休眠状态,难以萌发。其中种子内部存在内源抑制物质是种子休眠的主要原因之一[7]。丁言等[8]研究表明,同一质量浓度下凤丹胚乳浸提液对白菜种子的萌发和幼苗生长的抑制作用明显高于种皮和种胚浸提液。邓岚等[14]表明,黄牡丹(Paeoniadelavay)胚乳浸提液对白菜种子萌发和幼苗生长的抑制作用最强,推测黄牡丹种子内源抑制物是其休眠的重要原因。邵财等[15]发现,吉林延龄草(Trilliumkamtschaticum)种子浸提液可显著抑制白菜和小麦的根长,推测吉林延龄草种子内可能含有内源抑制物质。本试验通过研究紫斑牡丹种皮和胚乳浸提液对白菜、小麦和绿豆种子的影响发现,低质量浓度的种皮浸提液(0.025、0.050、0.075 g·mL-1)对白菜种子的萌发无影响,高质量浓度的种皮浸提液(0.100 g·mL-1)对白菜种子萌发却有显著抑制作用,而胚乳浸提液在各个质量浓度条件下与CK相比,对白菜种子的萌发一直具有抑制作用,并且各个处理间差异显著。这表明紫斑牡丹种子内部也存在抑制萌发物质,而且同一质量浓度下,胚乳浸提液对3种受体种子萌发抑制作用强于种皮浸提液。同时,种皮和胚乳浸提液对白菜幼苗的根长、苗高和鲜质量均存在一定程度的抑制作用,种皮和胚乳浸提液为0.100 g·mL-1时,白菜幼苗的根长、苗高和鲜质量比CK分别显著降低了92.64%、70.69%、33.33%和97.55%、79.89%、66.66%。这说明胚乳浸提液的抑制作用大于种皮浸提液,其中对于白菜幼苗根长的抑制最为显著。与张翔宇等[11]、周理平等[16]研究结果一致。而种皮和胚乳浸提液对小麦幼苗的影响同样表现为胚乳浸提液对小麦根长的抑制作用最大,但种皮浸提液(0.025、0.050、0.075 g·mL-1)对小麦苗高具有促进作用。这说明紫斑牡丹种皮和胚乳中均含有内源抑制物质,但种皮和胚乳中所含内源物质活性存在差异,具体原因是抑制物质的数量还是种类不同,还有待于进一步研究。
同一种内源物质对不同的受体植物种子作用不尽相同。房海灵等[17]研究了哥王(Wikstroemiaindica)种子萌发抑制物质活性时发现,了哥王种皮浸提液对白菜种子的萌发和幼苗生长的抑制作用明显强于小麦。廖源林等[18]研究野鸦椿(Euscaphisjaponica)种子不同部位抑制物质活性时发现,种壳和胚乳抑制物质主要的作用对象不尽相同,种壳浸提液对小麦种子的萌发和幼苗生长抑制作用最大,而胚乳浸提液对白菜和绿豆抑制作用最大。目前,利用牡丹组植物种子浸提液对受体植物种子萌发和幼苗生长的影响的研究中,常用的种子多为白菜种子[9,11],其中关于紫斑牡丹种子的研究更是少见。而本试验紫斑牡丹种子浸提液对3种受体植物种子作用的结果表明,紫斑牡丹种皮和胚乳浸提液对白菜种子的萌发和幼苗生长的抑制作用明显高于小麦和绿豆种子,说明紫斑牡丹种子内源抑制物质主要作用于白菜种子。
SOD、CAT、POD等抗氧化酶是植物细胞内活性氧清除系统的主要组成部分,当植物受到逆境胁迫时,植物体内的抗氧化酶类的活性会发生变化,及时清除植物产生的活性氧,避免植物体受到伤害[19-20]。而目前,关于紫斑牡丹种子浸提液对受体植物幼苗抗氧化酶活性的影响还未见报道。本试验中,经过紫斑牡丹胚乳浸提液处理后,白菜、小麦和绿豆幼苗的CAT和POD活性均显著下降。随着胚乳浸提液的质量浓度的升高,CAT和POD活性逐渐下降;而SOD活性却表现出先上升后下降的趋势,与大花黄牡丹的研究类似[11]。说明胚乳浸提液中所含的物质,能够直接抑制受体植物CAT和POD活性,降低植物的抗逆性。而种皮浸提液在低质量浓度时可以促进SOD和POD活性的提高,可能是低质量浓度种皮浸提液虽使受体植物体内活性氧积累,但是受体植物可以调控SOD、POD活性予以清除。但当质量浓度继续升高时,超过了受体植物的清理能力,就会导致植物细胞损坏,从而使SOD、POD活性降低,与邓岚等[14]的黄牡丹研究一致。这说明紫斑牡丹种皮和胚乳中均含有影响受体植物幼苗抗氧化酶活性的物质,胚乳中所含化学物质的抑制作用大于种皮。由此可知,紫斑牡丹种皮和胚乳所含的内源抑制物质在活性上存在差异。
本研究通过对紫斑牡丹种皮和胚乳浸提液内源抑制物质活性试验,发现紫斑牡丹种皮和胚乳中含有一些抑制种子萌发的物质,还能影响受体植物幼苗生长和抗氧化酶活性;而且这类物质主要存在于胚乳中。这可能是紫斑牡丹种子休眠的重要原因,而这类物质的具体成分和种类则还需要进一步研究。
