复方扶芳藤合剂含药血清对大鼠体外模拟“造血龛”中造血干细胞增殖的影响
2020-04-09周倍伊谢金玲钟卫干杨力强黄铠琴
周倍伊,万 娟,周 围,谢金玲,钟卫干,杨力强,罗 眈,黄铠琴
(1.广西中医药大学基础医学院,广西 南宁 530200;2.广西中医药大学药学院,广西 南宁 530200;3.广西中医药大学广西中药药效研究重点实验室,广西 南宁 530200)
造血干细胞移植技术成为有效治疗多种疑难血液病的方法,也为中医药现代化研究带来新的切入点。单纯的造血干细胞移植技术一方面给许多绝症患者带来了生存的希望,另一方面因移植所带来的并发症导致的移植失败也给患者带来巨大风险[1]。既往对移植失败研究多侧重在造血干细胞方面,而对造血干细胞赖以生存的造血微环境(造血龛,niche)缺乏足够的重视[2]。实验研究发现,间充质干细胞(MSCs)和造血干细胞(HSC)是造血龛的构成细胞,在“龛”内MSCs对HSC有促增殖作用。研究还发现MSCs与HSC通过细胞接触产生多种可溶性的和膜结合的细胞因子,调节造血干细胞归巢定位、增殖分化及凋亡[3]。临床研究证明,HSC与MSCs共移植能尽快地恢复造血微环境(造血龛)的造血重建[4-5]。中医药副作用低,以及具有较好的调节造血微环境(造血龛)的作用[6-7],有望成为配合治疗血液病的方法之一。
复方扶芳藤合剂是广西中医药大学制药厂的产品,临床用于心脾两虚、气血不足之证。该制剂由扶芳藤、黄芪、人参组成,有研究表明,黄芪的有效成分黄芪甲苷和人参的有效成分人参皂苷Rg1均可促进骨髓间充质干细胞(BMSCs)与HSC的体外增殖[8-9]。本课题前期的研究发现,复方扶芳藤合剂对大鼠BMSCs和HSC均有促增殖作用[10-11],但对大鼠BMSCs和HSC共培养体外模拟的“造血龛”有何影响尚未明了。为探讨不同培养模式体外模拟的“造血龛”中BMSCs对HSC增殖的作用,以及复方扶芳藤合剂含药血清对“龛”内HSC增殖的影响,本文开展如下实验,为研究复方中药对造血微环境(造血龛)的调节作用提供参考。
1 实验材料
1.1 动物 SPF级健康4周龄SD大鼠120只,体质量100±20 g,由湖南斯莱克景达实验动物有限公司提供,许可证号为SCXK(湘)2016-0002,试验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。
1.2 主要试剂与仪器 Attune NxT流式细胞仪(美国Invitrogen公司);美天旎细胞手动分选仪Miltenyi MidiMACS™Starting Kit LS(德国Milteny公司);Transwell共培养板(0.4μm,美国Corning公司);GIBCO DMEM低糖液体培养基(美国Thermo Fisher公司,C11885500BT,LOT:8118190);Phosphate Buffer Saline pH 7.4 basic磷酸缓冲盐溶液(美国Thermo Fisher公司,C10010500BT,LOT:8117069);Percoll®PLUS细胞分层液(美国Sigma公司,1002698877,LOT:#SLBX1265);
CD90.1-APC(Thy-1.1)Monoclonal Antibody(HIS51)(美 国Thermo Fisher公 司,17-0900-82,LOT:4322557);0.25%Trypsin-EDTA胰蛋白酶溶液(美国Thermo Fisher公司,25200-056,LOT:1859509)。
2 方法
2.1 BMSCs的原代分离培养 取4周龄雄性SPF级健康SD大鼠,颈椎脱臼处死,75%乙醇全身浸泡1min,无菌条件下快速去除肌肉等软组织,取出股骨及胫骨,以75%乙醇浸泡清洗1次,磷酸缓冲盐溶液(PBS)浸泡清洗2次。无菌条件下剪去长骨的骨骺端,露出骨髓腔,用含有10%胎牛血清(FBS)的低糖液体培养基(L-DMEM)冲洗骨髓腔,直至骨质发白;将冲出的骨髓内容物制成单细胞悬液,静置后,移取上清液至新离心管中,沉淀物用完全培养基重悬后种瓶,置于37°C、5%CO2的细胞培养箱中培养。
2.2 BMSCs的培养、纯化及传代 在原代细胞培养过程中,24 h后换液更换半数培养基,48 h后换液更换全量培养基。此后每2~3天全量更换1次完全培养基,待细胞铺满培养瓶底约90%时,使用胰酶-EDTA(乙二胺四乙酸)溶液消化,按1∶2的比例进行传代培养。
2.3 BMSCs的形态学观察 细胞培养中,每日用倒置相差显微镜观察细胞形态变化及生长状况[10]。
2.4 BMSCs表面标记物的表达鉴定 收集P3代生长良好的细胞,0.25%胰酶消化,4℃离心,1 000 r/min,3 min,PBS清洗细胞3次,细胞计数,调整浓度为1×106cells/ml,各管加入100μl细胞悬液,各管依次加入单克隆抗体CD29、CD34、CD44、CD45和四染管,同时每管单染管设立阴性对照组,避光孵育15min,每管加入2m l流式缓冲液清洗3次,除去未结合抗体,300 r/min离心5min,弃上清,500μl流式缓冲液重悬细胞,流式细胞仪进行检测分析。
2.5 HSC体外分选与生物学性状鉴定 颈椎脱臼法处死4周龄SD大鼠,75%乙醇浸泡,超净工作台内无菌取胫骨和股骨,剪开两端骨骺,培养基L-DMEM反复冲洗骨髓腔,40μm筛网过滤,离心收集细胞。配制密度为1.087 g/m l的细胞分层液(Percoll),将骨髓细胞小心覆加于Percoll上,室温密度梯度离心,1 000 r/min,25 min,收集中间白膜层细胞,分选缓冲液(MACS Buffer)清洗2次,离心,300 r/min,10min,细胞计数。按1×107cells/90μl MACS Buffer进行重悬,再按1×107cells/10μl加入磁珠CD90.1,混匀,4℃孵育15min;MACSBuffer清洗2次,加入0.3μl CD90.1(Thy-1.1)Monoclonal Antibody(HIS51),4℃孵育5 min;按照1×107cells/2m l加入MACSBuffer清洗2次,300 r/min离心10 min,去上清;按照1×108cells/500μl加入MACSBuffer重悬。置LS柱于MACS(细胞手动分选仪)系统,加MACSBuffer 3m l润湿LS柱,再加入前述经Thy-1.1单抗和磁珠CD90.1标记的细胞悬液,待其自然流下,即为Thy-1.1-细胞。使用3m lMACSBuffer清洗LS柱3次,收集所有流出液体,仍为Thy-1.1-细胞。将LS柱撤离MACS系统,加入5mlMACSBuffer,用配套针芯推出所有液体,收集至另一干净试管,即为Thy-1.1+细胞。使用流式细胞仪检测分选后细胞中Thy-1.1+细胞的百分比。分别取离心分选前后的细胞悬液10μl,加入0.4%台盼蓝染液10μl,混匀,静置3min,取10μl细胞悬液进行活性检测,在荧光显微镜下观察细胞形态。
2.6 BMSCs与HSC共培养 取24孔板和Transwell用于共培养,在90%DMEM-F12+10%胎牛血清的培养基中培养7 d。从第1天起每48 h收集各组HSC细胞,进行荧光拍照,使用CCK-8法检测细胞增殖情况。设置分组如下。①HSC单独培养组:24孔板内单独接种HSC;②Transwell共培养组:24孔板对应规格Transwell内单独接种HSC于上室,接种BMSCs于下室;③2D接触共培养组:24孔板内共同接种HSC与BMSCs。每组设4个复孔,其中间充质干细胞5×105cells/孔;HSC为1×105cells/孔。各组细胞培养1~7 d后,收集HSC单独培养组全部细胞;收集实验组(Transwell共培养组)上室全部细胞并用PBS洗涤3次;2D接触共培养组吸出悬浮于细胞培养液中的荧光细胞,在荧光显微镜下观察细胞形态和增殖情况,每孔样本单独离心并重悬至100μl后添加至96孔培养板中,每孔加入CCK-8试剂10μl,于37℃、5%CO2培养箱中孵育2 h,使用酶标仪在450 nm处检测吸光度值,以培养时间为横轴,吸光度为纵轴绘制细胞生长曲线。
2.7 复方扶芳藤合剂含药血清干预 同2.6项方法,分组如下。①空白血清HSC单独培养组:24孔板内单独接种HSC,使用空白血清干预;②空白血清Transwell共培养组:24孔板对应规格Transwell内单独接种HSC于上室,接种BMSCs于下室,使用空白血清干预;③空白血清2D接触共培养组:24孔板内共同接种HSC与BMSCs,使用空白血清干预;④含药血清HSC单独培养组:24孔板内单独接种HSC,使用含药血清干预;⑤含药血清Transwell共培养组:24孔板对应规格Transwell内单独接种HSC于上室,接种BMSCs于下室,使用含药血清干预;⑥含药血清2D接触共培养组:24孔板内共同接种HSC与BMSCs,使用含药血清干预。每组设4个复孔,其中间充质干细胞5×105cells/孔;HSC为1×105cells/孔。各组细胞培养1~7 d后,收集HSC单独培养组全部细胞;收集实验组(Transwell共培养组)上室全部细胞并用PBS洗涤3次;2D接触共培养组吸出悬浮于细胞培养液中的荧光细胞,在荧光显微镜下观察细胞形态和增殖情况,每孔样本单独离心并重悬至100μl后添加至96孔培养板中,每孔加入CCK-8试剂10μl,于37℃、5%CO2培养箱中孵育2 h,使用酶标仪在450 nm处检测吸光度值,以培养时间为横轴,吸光度为纵轴绘制细胞生长曲线。
3 结 果
3.1 BMSCs形态学观察结果 使用全骨髓贴壁培养法接种骨髓细胞于培养瓶后观察发现,镜下检查细胞数量多,种类杂,圆形透亮的为红细胞且占大多数。24 h后观察发现存在部分细胞已经贴壁分散生长,通过半换液去除未贴壁的细胞。48 h后观察发现,培养瓶底出现多个细胞集落,呈放射状,伸出长短不一、粗细不均的突起,未出现融合生长,单个细胞形态呈梭形(图1A)。继续培养,细胞集落面积不断增大,且与周边集落逐渐融合生长,培养7 d后长梭形细胞集落呈漩涡状或放射状,同向排列(图1B)。传代前记录发现,细胞排列紧密,均匀铺满培养瓶底,约占据90%瓶底空间,部分细胞没有生长空间,出现重叠或漂浮情况(图1C)。传代培养:1∶2消化传代后,传代细胞24 h即完全贴壁生长。细胞形态均一,呈典型梭形,旋涡状或放射状排列生长,细胞生长旺盛,每5 d即可传代1次。
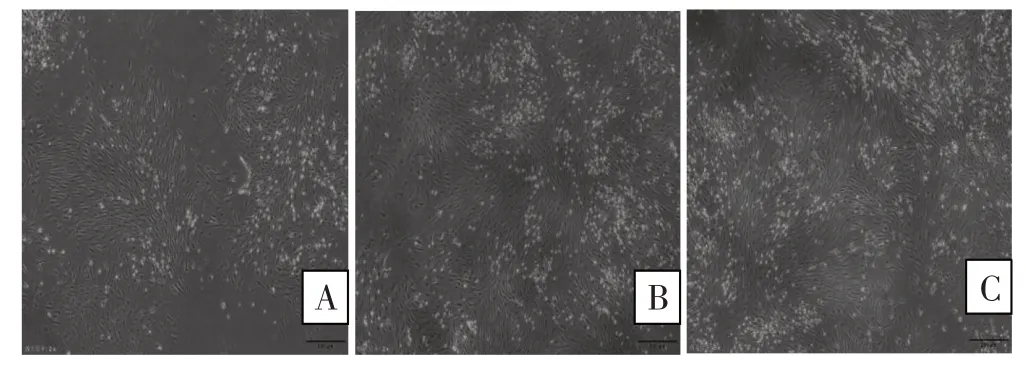
图1 BMSCs形态学特征
3.2 BMSCs表面标记物的表达 流式细胞仪检测结果显示,培养的第3代大鼠BMSCs均一表达CD29、CD44,阳性率分别为99.709%、99.734%,而CD34、CD45呈阴性,阳性率分别为0.114%、0.013%。见图2。

图2 BMSCs表面标志物的表达
3.3 大鼠CD90.1+细胞纯度及鉴定 分选出的CD90.1+细胞呈球形,体积偏小;台盼蓝拒染得出细胞存活率为97%;荧光显微镜下可激发绿色荧光;流式检测细胞纯度,分选后细胞纯度为为99.071%。见图3。
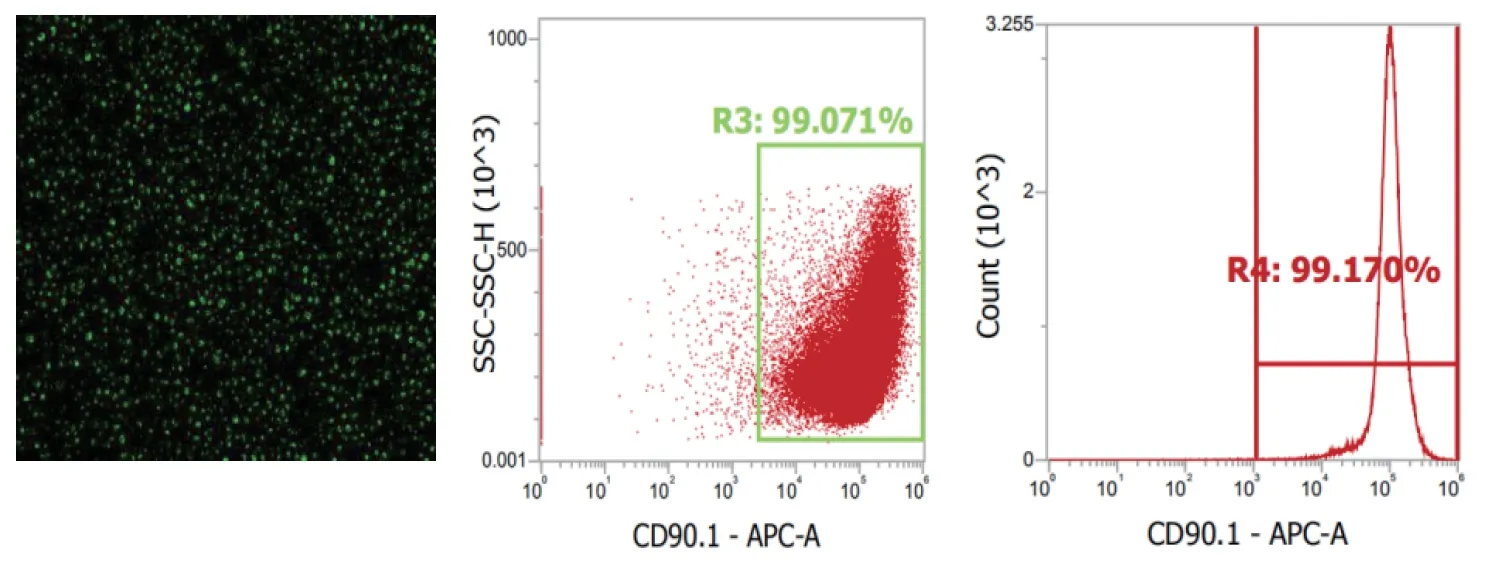
图3 HSC荧光图像与表面标志物的表达
3.4 BMSCs与HSC共培养与生长曲线测定 对不同天数测得的吸光度值进行组间比较,见表1。结果显示:各组HSC数量均随着培养时间的增加而增加(P<0.05);自第5 d起,Transwell共培养组及2D接触共培养组的HSC吸光度值均高于HSC单独培养组(P<0.05)。在应用不同共培养模式下,2D接触共培养组细胞增殖数量最多,其对应荧光图像也呈现相似趋势。见图4、图5。
表1 各组HSC吸光度比较()
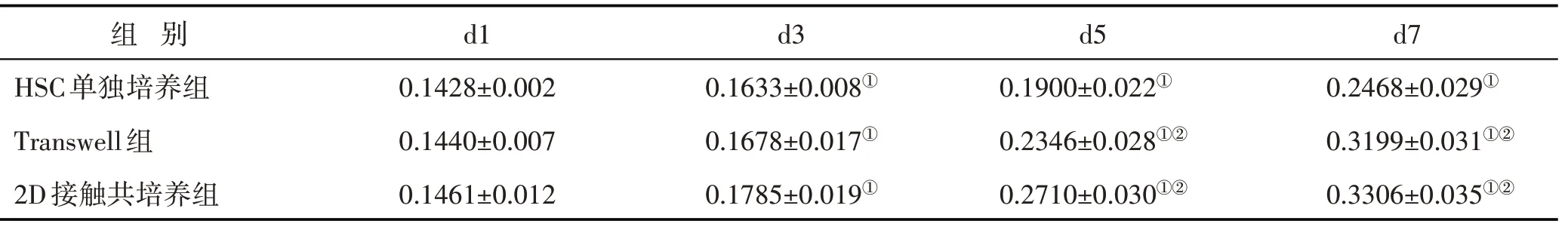
表1 各组HSC吸光度比较()
注:与同组d1比较,①P<0.05;与HSC单独培养组比较,②P<0.05
组 别HSC单独培养组Transwell组2D接触共培养组d1 0.1428±0.002 0.1440±0.007 0.1461±0.012 d3 0.1633±0.008①0.1678±0.017①0.1785±0.019①d5 0.1900±0.022①0.2346±0.028①②0.2710±0.030①②d7 0.2468±0.029①0.3199±0.031①②0.3306±0.035①②

图4 各组HSC吸光度值随时间的变化情况
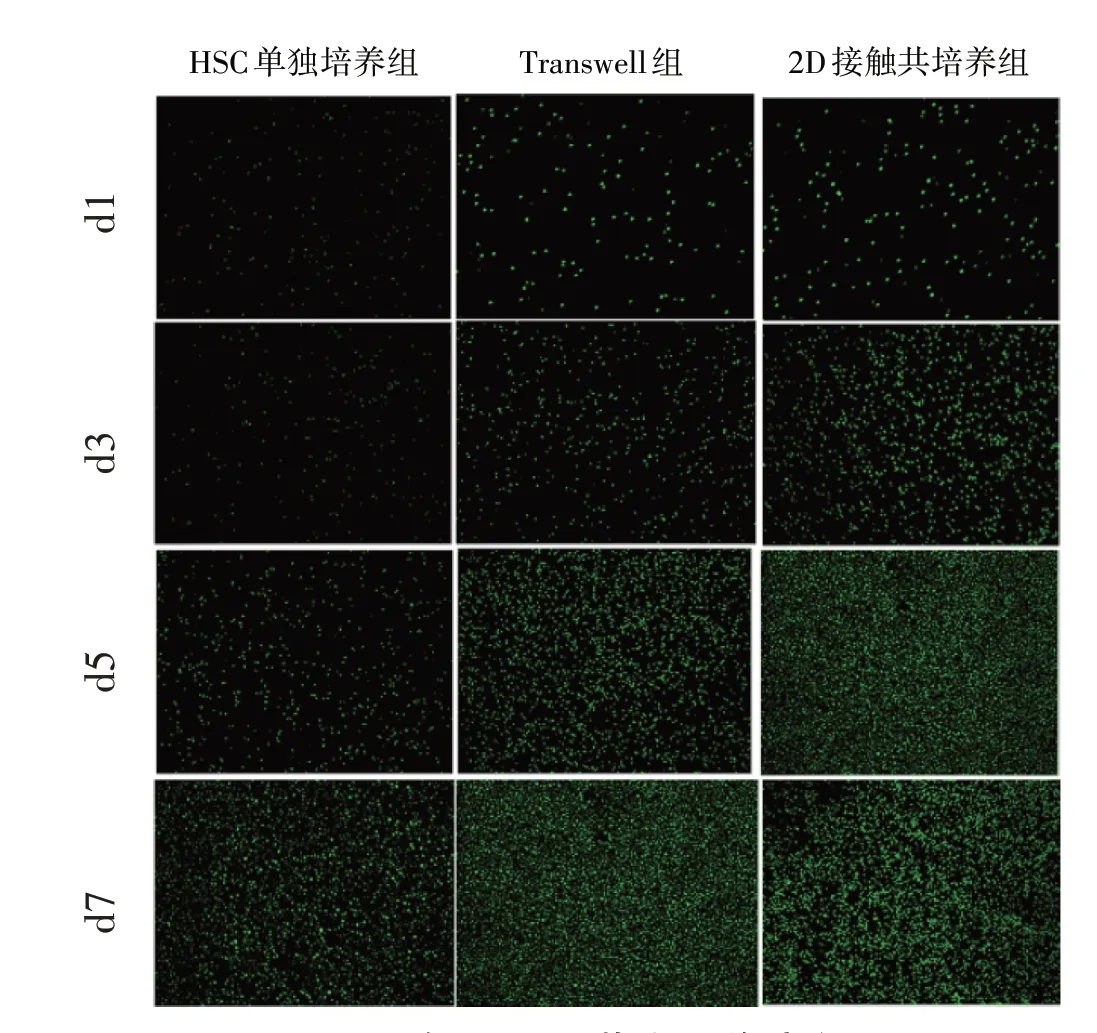
图5 各组HSC荧光图像变化
3.5 复方扶芳藤合剂含药血清干预与生长曲线测定 对共培养1 d、3 d、5 d、7 d的HSC样本进行CCK-8检测,统计每一天的吸光度值并进行组间比较(见表2、图6),各组荧光图像见图7。结果显示:含药血清HSC单独培养组吸光度值高于空白血清HSC单独培养组(P<0.05);含药血清Transwell组的HSC吸光度值高于空白血清Transwell组(P<0.05);含药血清2D接触共培养组HSC吸光度值高于空白血清2D接触共培养组(P<0.05)。以上结果说明:复方扶芳藤合剂含药血清能进一步增强各培养模式中HSC增殖能力。
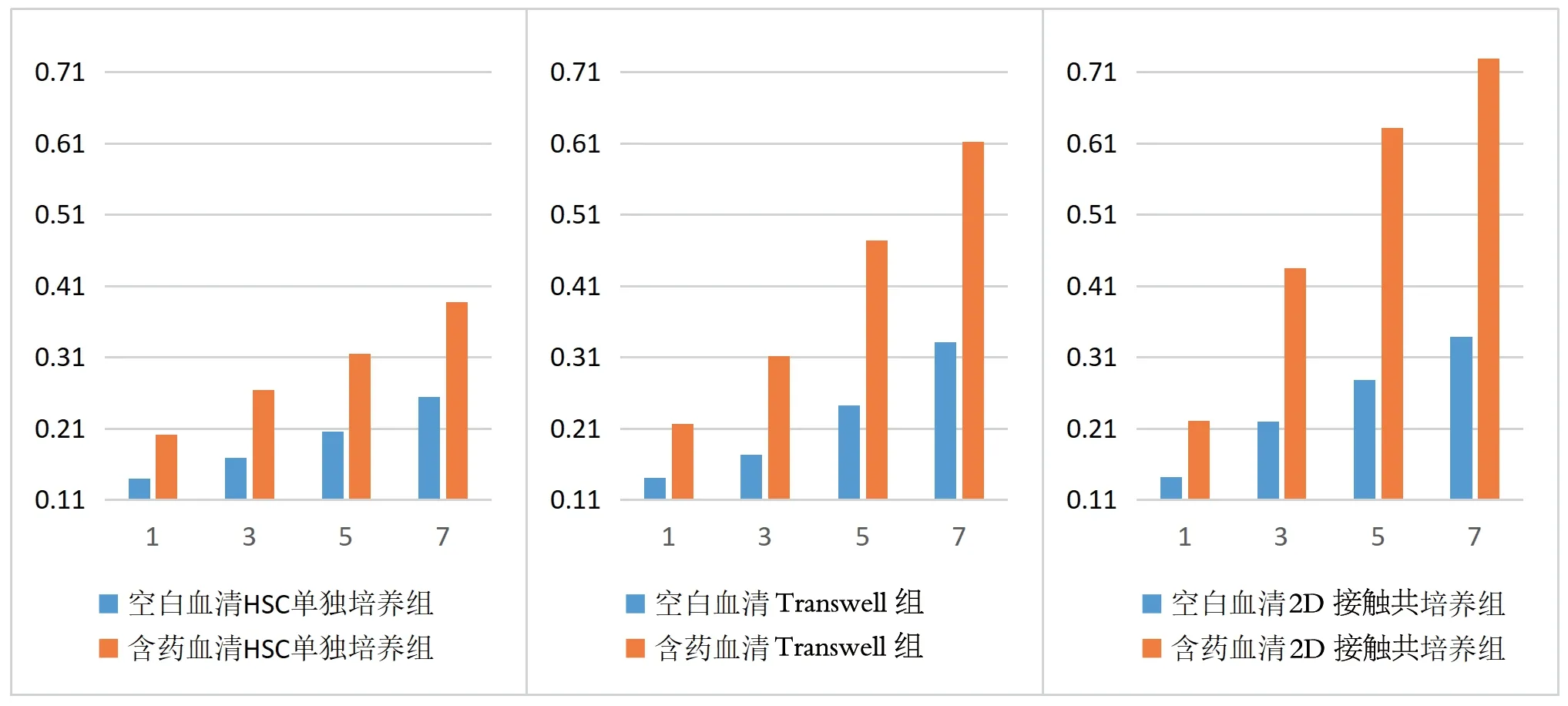
图6 经干预后各组HSC吸光度值随时间的变化情况
4 讨 论
国内外研究证明,HSC与MSCs共培养的二维(2D)和三维培养体系均可以体外模拟造血龛,在一定程度上都可反映造血龛的功能。三维模拟造血龛在空间上更与体内造血龛相近,但是不利于细胞回收作进一步分析。二维模拟造血龛体系,MSCs属贴壁细胞,HSC属非贴壁细胞,所以容易分离细胞作进一步研究[12-15]。目前国内外公认的,研究最多的造血龛有三种:HSC与MSCs组成的造血龛、HSC与成骨细胞组成的造血龛以及由HSC与内皮细胞组成的造血龛。无论从临床运用,还是体外二维、三维模拟造血龛都以HSC与MSCs最多。临床研究发现,HSC与MSCs共移植治疗恶性血液病,可以加快骨髓造血干细胞微环境(造血龛)造血功能的重建,能促进机体免疫调节功能,降低最主要的并发症——移植物抗宿主病(GVHD)的发生,提高造血干细胞移植成功率[2]。实验研究证明,是间充质干细胞(MSCs)和造血干细胞(HSC)构成造血龛,“龛”内细胞MSCs数量增多时HSC数量增多,MSCs对HSC有促增殖作用。MSCs与HSC通过细胞接触产生多种可溶性的和膜结合的细胞因子,调节造血干细胞归巢定位、增殖分化及凋亡[3]。本实验中HSC+BMSCs Transwell共培养组HSC吸光度值高于HSC单独培养组HSC吸光度值(P<0.05);HSC+BMSCs 2D接触共培养组HSC吸光度值高于Transwell共培养组(P<0.05)。实验证明BMSCs+HSC共培养组均能促进HSC增殖,BMSCs+HSC接触共培养促HSC增殖效果最明显。
表2 经干预后各组HSC吸光度值的变化情况()

表2 经干预后各组HSC吸光度值的变化情况()
注:与空白血清HSC单独培养组比较,①P<0.05;与空白血清Transwell组比较,②P<0.05;与空白血清2D接触共培养组比较,③P<0.05
组 别空白血清HSC单独培养组含药血清HSC单独培养组空白血清Transwell组含药血清Transwell组空白血清2D接触共培养组含药血清2D接触共培养组d1 0.1397±0.004 0.2014±0.019①0.1414±0.006 0.2163±0.020②0.1421±0.011 0.2208±0.023③d3 0.1685±0.007 0.2644±0.021①0.1738±0.015 0.3113±0.025②0.2201±0.021 0.4346±0.034③d5 0.2054±0.011 0.3147±0.029①0.2430±0.019 0.4744±0.039②0.2781±0.032 0.6317±0.047③d7 0.2547±0.016 0.3878±0.033①0.3314±0.029 0.6125±0.041②0.3392±0.035 0.7287±0.052③
中医推测认为,BMSCs是“脾肾相关”细胞层次的表达形式,但究其实质仍属于“先天之精”范畴[16]。唐宗海在《血证论·藏府病机论》中提出:“心之能事,又主生血,而心窍中数点血液,则又血中之最精微者,乃生血之源泉,亦出神之渊海。”[17]其对“血中之最精微者”“生血之源泉”的描述与现在的外周血HSC极为相似。中医认为,“脾为气血生化之源,为后天之本”“后天济先天”“精气互化”“精血相生”[18],所以中医在临床上对血液病的治疗多以补肾填精、益气健脾的扶正固本方法为主。本实验中,复方扶芳藤合剂含药血清干预的Transwell共培养组HSC吸光度值高于空白血清干预的Transwell共培养组(P<0.05);复方扶芳藤合剂含药血清干预的2D接触共培养组HSC吸光度值高于Transwell共培养组(P<0.05),说明BMSCs与HSC共培养使BMSCs对HSC有促增殖作用,复方扶芳藤合剂含药血清的干预加强了这种促增殖作用,为我们进一步研究复方中药对造血微环境(造血龛)的调节作用提供参考。

图7 经干预后各组1、3、5、7 d的HSC荧光图像
