壮药龙钻通痹方对佐剂性关节炎大鼠成骨转录因子BMP2和Smad1的影响
2020-04-09庞宇舟唐秀松
庞宇舟,田 照,方 刚,张 曼,唐秀松
(1.广西中医药大学壮医药学院,广西 南宁 530001;2.湖北民族大学医学部,湖北 恩施 445000)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性炎症性疾病,以滑膜衬里细胞显著增生、关节软骨及软骨下骨进行性破坏为其主要特征[1-2]。其病程主要分为三个阶段,一是环境因素作用于具有遗传背景的个体,打破免疫耐受,启动适应性免疫应答;二是关节滑膜衬里细胞异常增殖,关节腔血管翳形成;三是软骨和骨组织遭受破坏,骨质重构,关节畸形[3-4]。RA有高度的致残风险,探索此病的有效治疗措施仍是当今急需解决的医学难题之一。龙钻通痹方(LZTB)由飞龙掌血、大钻、两面针等八味药构成,前期研究证实,龙钻通痹方可明显降低肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素(Interferon-γ,IFN-γ),上调白介素6(Interleukin-6,IL-6)、白介素10(Interleukin-10,IL-10)的表达水平,从而发挥抗炎镇痛的作用,同时可延缓骨质破坏,有效保护患者关节结构,对RA患者的有效率达到85%[5-7],但本方在治疗RA中发挥骨保护的作用机制尚不清晰。
成骨细胞形成新骨受到多条通路和多个转录因子的调控,其中骨形态发生蛋白2(bone morphogeneticprotein 2,BMP2)和Smad同源物1(Smad1)转录因子在骨髓间充质干细胞向成骨细胞分化过程中起着重要的作用[8-9]。BMP2作为上游的转录因子,可磷酸化Smad1来刺激靶基因的表达,从而促进成骨细胞分化与成熟[10]。鉴于此,本研究建立佐剂性关节炎大鼠模型,通过观察LZTB对成骨细胞分化BMP2、Smad1转录因子的表达影响,探讨其有效性及干预机制,以期为类风湿性关节炎临床防治提供理论依据。
1 实验材料
1.1 动物 SPF级雄性SD大鼠48只,体质量约180~220 g,购自湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2016-002。
1.2 试药与试剂 LZTB(颗粒剂,每克干粉相当于含生药9.266 g),由广西中医药大学制药厂生产,批号:20180508;BMP2抗体(英国abcam公司,批号:ab6285);Smad1抗体(英国abcam公司,批号:ab108965);弗氏完全佐剂(美国Sigma公司);逆转录盒(北京TIANGEN,批号:KR180123);扩增盒(北京TIANGEN,批号:FP171206)等。
1.3 仪器 足跖容积检测仪(成都泰盟,PV-200);荧光万能显微镜(日本尼康,尼康80iD-FUW-PA);高速冷冻离心机(德国Sigma,3K15);电泳槽(Bio-Rad,MIni-SubCellGT);全自动实时荧光定量PCR仪(瑞士罗氏,LightCycler96)等。
2 方法
2.1 模型制备 将48只SD大鼠适应性喂养1周,随机分为正常组(Normal)、模型组(Model)、甲氨蝶呤对照组(Control)、壮药高剂量组(Experimental-H)、中剂量组(Experimental-M)、低剂量组(Experimental-L),每组8只。除正常组外,余组按文献[11]所述方法制备佐剂性类风湿关节炎大鼠模型,即在大鼠右后足底注射完全弗氏佐剂0.15m l,3 d后再次免疫,即尾根部注射完全弗氏佐剂0.1m l。壮药组灌胃龙钻通痹颗粒高、中、低剂量分别是5.4 g/(kg·d)、2.7 g/(kg·d)、1.35 g/(kg·d),稀释浓度为0.54 g/ml,甲氨蝶呤对照组灌胃甲氨蝶呤(MTX)2.7mg/kg,正常组、模型组分别灌胃等体积蒸馏水。
2.2 实验取材 灌胃21 d后处死大鼠取材,抽取全血,取左右膝关节滑膜、软骨(备用)及踝关节以下骨组织。造模期间未见动物死亡,全部纳入数据分析。
2.3 观察指标
2.3.1 RA模型大鼠足跖容积测量 为保证测量准确性,每只大鼠在测量前在踝关节相同处做标记,以足跖容积检测仪每4 d测量1次,比较各组大鼠的足跖容积动态变化情况。
2.3.2 Westert blot检测RA大鼠滑膜BMP2、Smad1蛋白的表达影响 从-80℃冰箱取出滑膜,冰上低温匀浆,提取蛋白,用试剂盒检测蛋白浓度。分别进行电泳,洗膜3次后转膜,以5%脱脂牛奶溶解液封闭2 h,洗膜后孵育一抗摇晃过夜,第二天洗膜孵育二抗,最后化学发光显影。
2.3.3 RT-PCR检测RA大鼠滑膜BMP2 mRNA、Smad1mRNA的表达影响 用滑膜提取总RNA,测定总RNA浓度,按逆转录试剂盒合成cDNA,反应条件为42℃15min,95℃3min。目的与内参正反引物委托生工公司合成,按扩增试剂盒配制扩增体系(20μl),采用两步法扩增,共40个循环。

表1 引物序列信息
2.3.4 大鼠踝关节形态学检测 踝关节组织以4%多聚甲醛固定,室温24 h以后转移至脱钙中,制备石蜡,包埋切片,HE染色,光镜下观察滑膜组织形态学改变。
2.4 统计学方法 采用SPSS 20.0统计软件进行分析,计量资料以均数±标准差()表示,组间比较以单因素方差分析,组间两两比较采用t检验,以P<0.05为差异有统计学意义。
3 结 果
3.1 各组大鼠足跖容积的测定结果 见表2。与正常组比较,模型组大鼠足跖容积明显增大(P<0.05),与模型组比较,壮药高剂量组与甲氨蝶呤对照组足跖容积明显减小(P<0.05)。
表2 各组大鼠足跖容积比较(unit/m l,)

表2 各组大鼠足跖容积比较(unit/m l,)
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05
组 别模型组甲氨蝶呤对照组壮药高剂量组壮药中剂量组壮药低剂量组正常组n 8 8 8 8 8 8第1 d 1.68±0.20①1.71±0.15 1.65±0.19 1.55±0.26 1.60±0.12 1.30±0.22第4 d 3.32±0.29①3.31±0.30 3.32±0.17 3.31±0.29 3.30±0.36 1.35±0.25第7 d 3.35±0.21①2.99±0.16 3.10±0.38 2.29±0.30 3.28±0.21 1.38±0.25第10 d 3.45±0.28①2.68±0.21②2.89±0.21②3.01±0.26 3.28±0.28 1.38±0.21第13 d 3.60±0.26①2.30±0.18②2.67±0.26②2.92±0.29 3.26±0.25 1.41±0.25第16 d 3.79±0.30①2.09±0.25②2.35±0.30②2.75±0.24 3.23±0.21 1.42±0.25第19 d 3.86±0.25①1.98±0.19②2.28±0.20②2.72±0.21 3.21±0.23 1.44±0.24第21 d 3.86±0.30①1.97±0.20②2.25±0.19②2.72±0.28 3.20±0.20 1.44±0.20
3.2 Westert blot检测各组大鼠滑膜BMP2、Smad1蛋白的表达结果 见图1与表3。与正常组比较,模型组BMP2和Smad1均明显下调(P<0.05);与模型组比较,甲氨蝶呤对照组与壮药高剂量组BMP2和Smad1表达均显著提高(P<0.05),壮药中、低剂量组未见明显性差异;与甲氨蝶呤对照组比较,壮药高剂量组差异不明显。

图1 各组大鼠BMP2和Smad1蛋白的表达
表3 各组大鼠BMP2和Smad1蛋白的表达()

表3 各组大鼠BMP2和Smad1蛋白的表达()
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与甲氨蝶呤对照组比较,③P>0.05
蛋白名称BMP2 Smad1正常组1.01±0.19 1.19±0.21模型组0.26±0.0①0.28±0.11①甲氨蝶呤对照组0.81±0.11②0.80±0.19②壮药高剂量组0.76±0.10②③0.72±0.15②③壮药中剂量组0.49±0.14 0.47±0.12壮药低剂量组0.28±0.05 0.31±0.16
3.3 RT-PCR检测各组大鼠滑膜BMP2 mRNA、Smad1mRNA的表达结果 结果见表4与图2。与正常组比较,模型组BMP2mRNA、Smad1mRNA表达均明显下调(P<0.05);与模型组比较,甲氨蝶呤对照组与壮药高剂量组BMP2mRNA和Smad1mRNA均表达上调(P<0.05),壮药中、低剂量组差异不显著。
表4 各组大鼠BMP2mRNA/Smad1mRNA相对性表达()

表4 各组大鼠BMP2mRNA/Smad1mRNA相对性表达()
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与甲氨蝶呤对照组比较,③P>0.05
基因名称BMP2mRNA Smad1mRNA正常组1.00±0.29 1.10±0.25模型组0.28±0.10①0.23±0.07①甲氨蝶呤对照组0.88±0.20②0.84±0.16②壮药高剂量组0.76±0.16②③0.79±0.12②③壮药中剂量组0.60±0.20 0.47±0.14壮药低剂量组0.38±0.09 0.29±0.11

图2 各组大鼠BMP2mRNA/Smad1mRNA相对性表达
3.4 各组大鼠踝关节病理形态 结果见图3。正常组踝关节滑膜表面光滑,关节腔结构清晰,未见炎症细胞浸润。模型组滑膜边缘毛糙,层次不清,充满炎性物质,成骨细胞明显减少。甲氨蝶呤对照组滑膜边缘较清晰,有较多成骨细胞分布。壮药低剂量组滑膜增厚(星号处),边缘欠光滑,成骨细胞排列杂乱;壮药高剂量组可见滑膜边缘较为光滑,关节腔清晰,炎症细胞较少,成骨细胞排列相对整齐。
4 讨 论
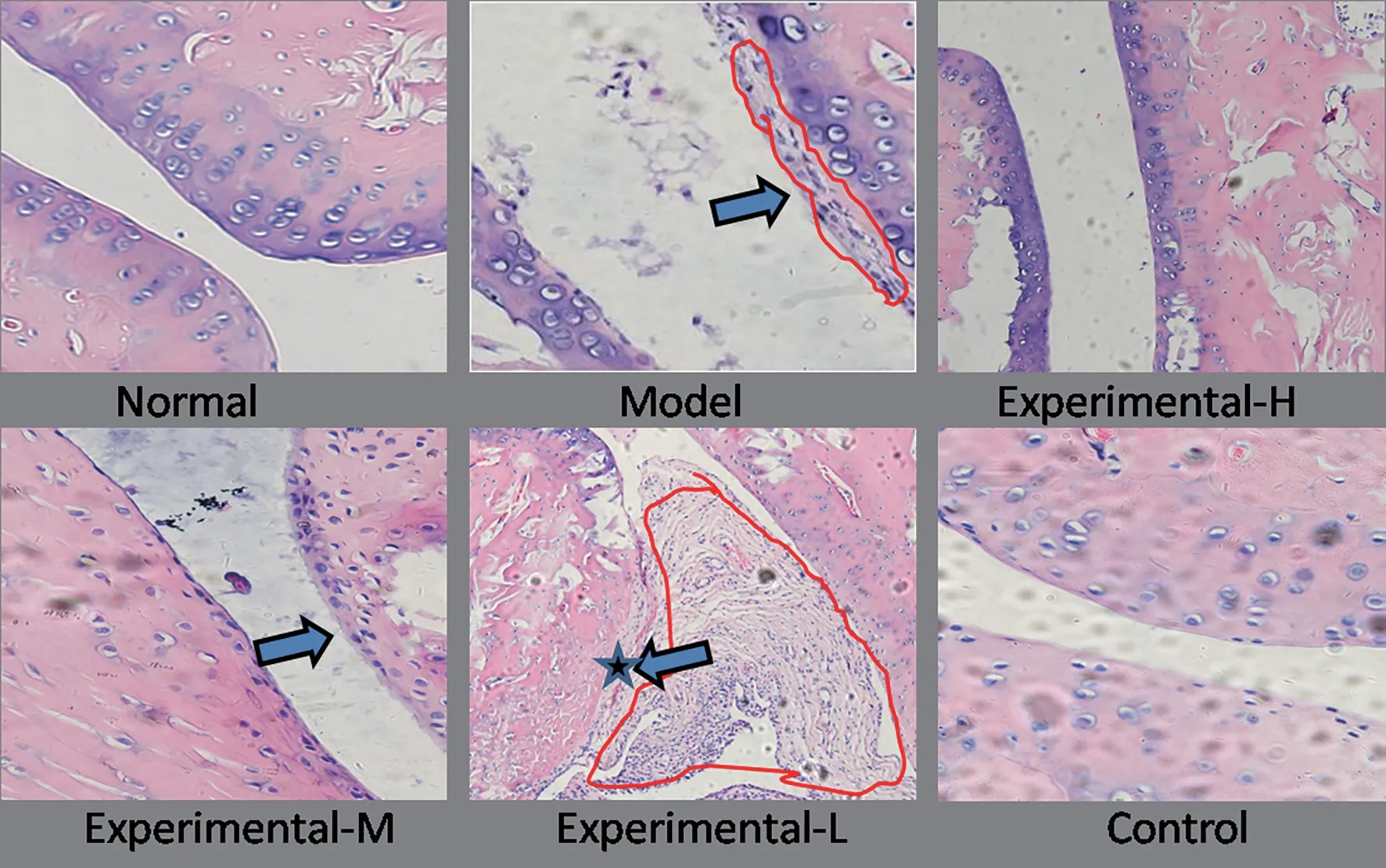
图3 各组大鼠踝关节病理切片(HE×100)
RA以滑膜炎、血管炎和骨质破坏为其主要病理基础,具有患病率高、致残率高、治疗费用高的特点[12],现代医学主要在非甾体抗炎药或改善病情的抗风湿药基础上联用糖皮质激素、生物制剂等予以治疗,可有效缓解患者疼痛、晨僵麻木等症状,有助于延缓病情进展,降低致残风险。但由于本病需要长期服药,糖皮质激素带来的一系列副作用如青光眼、骨质疏松、高血压等风险亦随之加大。故探寻疗效可靠且费用较为低廉的治疗方法已刻不容缓。传统医学内外并调,标本兼治,费用相对较低,已逐渐得到患者的认可[13]。民族医药如藏、蒙、壮、苗等对类风湿关节炎都有较深入的研究,特色方药和技法普世济仁,造福一方[14-15]。壮医认为“毒虚致百病”,风毒、寒毒、湿毒等侵袭人体,阻滞经络,使三道两路运行不畅;久病体虚,素体不足,后天消耗过度等致使正气虚损,正不胜邪,影响三气同步,本虚复感毒邪共同导致了RA的发生[16-17]。
已有研究显示:在RA关节中,正常的薄滑液关节衬里层被炎症性、高血管化浸润性纤维胶原酶组织所取代,刺激产生大量IL-1、IL-6、TNF-α等炎性因子,促使破骨细胞大量吸收,成骨细胞无法填补破骨细胞吸收遗留的蜂窝凹陷,导致关节骨的破坏和畸形[18]。成骨因子可由骨细胞分泌或在骨重建过程中释放,这些因子在吸收后释放包括TGF-β、BMP等在内的多个成骨信号家族成员,细胞表面的BMP信号由Smad转录因子家族直接转导调控,其下游BMP2靶基因Runx2、Osterix等均属于成骨细胞转录因子,更重要的是,BMPs在骨再生中的作用于动物模型和临床应用中皆是众所周知,如骨折愈合、脊柱融合、颅面骨缺损等[19-20]。故BMP2与Smad1作为中上游转录因子对于成骨细胞的分化与骨重建是尤为关键的。
本研究发现,与模型组比较,壮药高剂量组与甲氨蝶呤对照组大鼠的足跖容积自给药15 d后下降明显,而壮药中、低剂量组改善不明显,说明甲氨蝶呤与高剂量龙钻通痹方这两种干预方法对RA模型大鼠均有一定治疗效果且与给药时间有一定关系。甲氨蝶呤对照组BMP2与Smad1滑膜蛋白表达均稍高于壮药高剂量组,进一步证明甲氨蝶呤片作为RA的基础常用药的可靠性,也验证了本研究以甲氨蝶呤片作为对照药物是科学可取的。RT-PCR检测结果说明LZTB高剂量给药更有利于RA大鼠滑膜分子层面的改变。HE染色提示正常组关节滑膜光滑无增生,软骨细胞排列整齐,无炎症细胞;模型组可见滑膜组织增生,关节腔狭窄,结构模糊不清,软骨及软骨下骨遭受破坏,结合足跖容积的改变,验证了模型制备成功。壮药组病理改变与给药剂量有一定依赖性,壮药高剂量组的关节结构及滑膜形态明显好于壮药中、低剂量组。综上所述,壮药高剂量治疗活动期RA可显著提高成骨细胞转录因子BMP2与Smad1的蛋白和基因表达,可改善模型大鼠足跖容积,对软骨及软骨下骨有一定修复能力,其作用机制可能是上调成骨细胞转录因子BMP2和Smad1的表达,从而发挥骨保护作用。由于没有进行更长时间的给药观察,RA患者在服药21 d后是否在相应研究指标中有类似的改变还不得而知,后续研究将予以完善。
