长链非编码RNA 与mRNA 在烟雾吸入性损伤小鼠肺组织中的差异表达
2020-04-09刘欣健崔正军夏斯曼王常印郭鹏飞余祖改
刘欣健 崔正军 夏斯曼 王常印 郭鹏飞 王 旭 余祖改 钱 坤
(郑州大学第一附属医院烧伤修复重建外科,河南 郑州 450000)
烟雾吸入性损伤是指热力和(或)烟雾导致呼吸系统发生炎症细胞浸润、肺泡壁增厚、肺水肿及肺泡腔蛋白渗出等一系列的病理生理改变。火灾现场中烧伤常合并烟雾吸入性损伤,导致病死率增高。烟雾吸入性急性肺损伤一直是烧伤治疗的难点,亦是热点[1-2]。长链非编码RNA(lncRNA)是指一类长度大于200 碱基的非编码RNA。lncRNA参与机体多种生理病理过程,包括炎症、免疫反应、肿瘤、细胞凋亡、自身免疫反应等,是当前研究领域的热点[3-4]。目前,国内外尚未见到lncRNA 在烟雾吸入性肺损伤中的相关研究。本研究中拟对烟雾吸入性损伤小鼠和正常小鼠肺组织进行RNA 高通量测序,通过对其中表达量发生变化的RNA 进行比较,获得烟雾吸入性损伤小鼠肺组织中差异表达的mRNA 和lncRNA 以及它们之间的协同关系,找出可能参与烟雾吸入性肺损伤的lncRNA,为烟雾吸入性肺损伤的治疗提供新的潜在靶点。
1 材料与方法
1.1 烟雾吸入性损伤小鼠动物模型的制备 按照文献[5]的方法制备动物模型。C57BL/6 小鼠30 只,雄性,6 ~8 周,体重(18±2)g。随机分为致伤14 min 组(n=15)和对照组(n=15)。自行研制致伤设备:发烟室为密闭铁质带盖圆筒状容器,直径25 cm,高55 cm,盖与容器相连处有橡皮垫以增强密闭性。内部分上下两层,中间由铁网隔开,上层体积占整个容器的40%,为发烟室;下层体积约占60%,为致伤室。致伤室底部有一个小孔,通过一根直径1 cm,长约10 cm“L”型铁质管道连接外部,管道内置1 只温度计。致伤过程为:将经过腹腔注射1% 戊巴比妥钠(50 mg/kg) 麻醉后的小鼠放入下层致伤室(每次随机放入10 只小鼠),发烟材料(50 g 干燥松木屑与10 ml 煤油混合物)置入一托盘内,均匀铺平、点燃,燃烧1 min 后,熄灭火焰,材料开始阴燃时,迅速将托盘放入上层发烟室,密闭致伤装置,通过发烟室旁侧孔观察发烟材料阴燃情况,并在发烟材料发烟较差时打开侧孔,以小型电风扇往侧孔内通风,并翻动发烟材料,促使其发烟。烟雾吸入期间,致伤室底部温度始终稳定保持在20 ~25 ℃。于14 min后取出小鼠,置于通风的鼠笼内,允许自由摄入食水。对照组小鼠麻醉后置入未点燃发烟材料的密闭致伤室内,14 min 后取出。24 h 后,取存活小鼠双侧肺组织,液氮冻存后,-80 ℃冻存。拟取6 只实验组和3 只对照组小鼠双侧肺组织行RNA 高通量测序,其余小鼠取双侧肺组织行病理学检测。
1.2 烟雾吸入性损伤小鼠肺组织病理学观察 建模成功后24 h 取小鼠双侧肺组织,常规制作苏木素-伊红(HE)染色组织切片[6],显微镜下观察肺支气管上皮细胞和肺泡上皮细胞坏死、脱落及炎性细胞浸润等情况。
1.3 提取小鼠肺组织总RNA 将小鼠肺组织研磨成粉,用TRIZOL 等试剂提取小鼠肺组织总RNA。以苯酚- 氯仿处理进一步纯化RNA,然后用RQ1 DNase(Promega,美国)处理以除去DNA。 用Smartspec Plus 系 统(BioRad,美国) 对标本进行质检,质控标准如下:RNA 完整性计数(RNA integrity number,RIN)>6.0,吸 光 度(A)260/A280>2.0, 样 品 完 整 性 指 标28S/18S>1.5。通过1.5%琼脂糖凝胶电泳进一步验证了RNA 的完整性[7]。
对于每个样品,通过VAHTS 链式mRNAseq 文库制备试剂盒(Vazyme)将1 μg 总RNA用于RNA-seq 文库制备。纯化和片段化聚腺苷酸化的mRNA,然后将其转化为双链cDNA。在末端修复和A 拖尾步骤之后,将DNA 连接到VAHTS RNA 衔接子(Vazyme)。用热不稳定的UDG消化对应于200 ~500 bps 的纯化的连接产物,对单链cDNA 进行扩增,纯化,定量并在-80 ℃下保存,然后再测序。对于高通量测序,按照制造商的说明制备文库,并将其应用于Illumina HiSeq X Ten 系统进行150 nt 配对末端测序[8-9]。
1.4 RNA-Seq 原始数据清洁和比对 首先丢弃包含超过2-N 个碱基的原始读物。然后,使用FASTX-Toolkit(0.0.13 版)从原始测序读数中修剪出适配器和低质量碱基。小于16 nt 的短读删除。之后,通过Tophat2 将干净的读数与GRch38 基因组比对,从而允许4 个错配。独特映射的读段用于基因读段数计数和FPKM 计算(每百万个片段映射的转录本每千碱基片段数)[10]。
1.5 差异表达基因分析 使用R Bioconductor软件包edgeR 筛选出差异表达的基因[11]。将错误发现率<0.05 和倍数变化>2 或<0.5 设置为识别差异表达基因的截止标准。
1.6 功能富集分析 为了整理差异表达基因的功能类别,使用KOBAS 2.0 服务器对差异表达的基因行GO 分析和KEGG 分析[12]。对显著差异表达lncRNA(DElncRNA),提取其上下游10 kb范围内的基因信息,同时计算差异表达lncRNA和mRNA 之间的皮尔森相关系数(Pearson correlation coefficient) 进 行 共 表 达(coexpression)分析,筛选满足相关系数绝对值大于0.6 且P<0.05 的lncRNA-靶标关系对(pair),再对这两个数据收集分析,得到差异表达lncRNA的作用靶标。
1.7 实时定量聚合酶链式反应(qRT-PCR)验证 根据拟验证的差异表达lncRNA 序列,采用primer5.0 软件和同源性比较分析网站http://blast.ncbi.nlm.nih.gov/Blast.cgi 设计引物。将之前提取的总RNA 备份,并以逆转录试剂盒逆转录产生cDNA,接着行PCR 扩增。 内 参 采 用GAPDH(F:AGGTCGGTGTGAACGGATTTG;R:GGGGTCGTTGATGGCA ACA),对于每个拟验证的差异表达的lncRNA,均做3 个复孔,重复3 次试验。
1.8 统计学分析 采用SPSS 19.0 统计学软件进行分析,结果以 表示,使用单因素方差分析,P <0.05 为差异有统计学意义。
2 结 果
2.1 对照组与烟雾吸入性损伤小鼠肺组织病理学变化 HE 染色显示,对照组大鼠肺泡腔完整,结构清晰,间质内未见大量炎性细胞浸润(图1A,见封二);吸入组可见肺组织间质内大量炎性细胞浸润,充血,肺组织结构破坏(图1B,见封二)。
2.2 小鼠烟雾吸入性损伤差异表达的mRNA RNA高通量测序发现:烟雾吸入小鼠肺组织与正常小鼠肺组织相比有1 008 个mRNA 差异表达,其中上调369 个,下调639 个,差异表达mRNA 高度富集到与炎症、免疫相关的信号通路(图2,见封二)。
对差异表达mRNA 行GO 分析发现:上调mRNA 的十大代表性GO 生物过程通路为:中性粒细胞趋化、免疫反应、急性期反应、炎症反应、血管生成的正调控、脂质代谢过程、细胞凋亡过程的正调控和负调控、细胞表面受体调节、细胞凋亡的外源性信号通路。下调mRNA 的十大代表性GO 生物过程通路为:免疫系统过程、免疫反应、T 细胞激活通路、B细胞激活通路、干扰素γ生成的正调控、干扰素γ 生成、肌肉收缩、细胞表面受体信号通路、T 细胞增殖的正调控、细胞黏附(图3A,3B)。
对差异表达mRNA 行KEGG 分析发现:上调mRNA 的十大代表性KEGG 通路为:咖啡因代谢、视黄醇代谢、细胞因子-细胞因子受体作用通路、细胞色素P450 药物代谢途径、昼夜节律调节、PI3K-Akt 信号通路、PPAR 信号通路、神经活性配体-受体相互作用、阿米巴病相关通路、化学致癌作用。下调mRNA 的十大代表性KEGG 通路为:造血细胞谱系、原发性免疫缺陷、细胞因子-细胞因子受体相互作用、移植物抗宿主病、自然杀伤细胞介导的细胞毒性、同种异体移植排斥、T 细胞受体信号通路、产生IgA 的肠免疫网络、炎症性肠病(IBD)和病毒性心肌病(图3C,3D)。
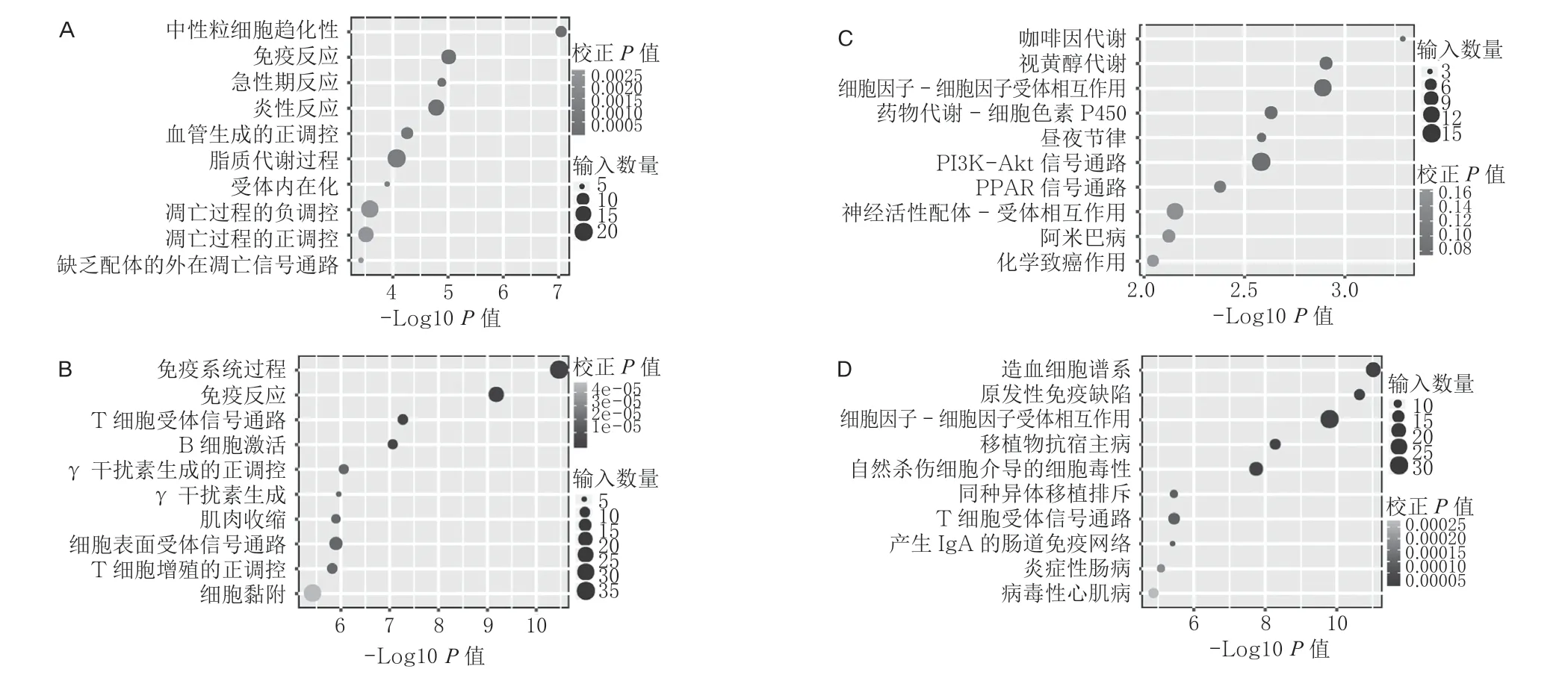
图3 烟雾吸入性损伤小鼠肺组织mRNA RNA-seq 分析显示上调或下调基因的十大代表性GO 生物过程通路和十大代表性KEGG 通路(A:差异上调表达mRNA 的GO 分析图;B:差异下调表达mRNA 的GO 分析图;C:差异上调表达mRNA的KEGG 分析图;D:差异下调表达mRNA 的KEGG 分析图)
2.3 小鼠烟雾吸入性损伤差异表达的lncRNA 烟雾吸入性损伤小鼠肺组织与正常小鼠肺组织相比有2 071 个lncRNA 差异表达,其中上调286 个,下调1 785 个(图4,图5,见封二)。
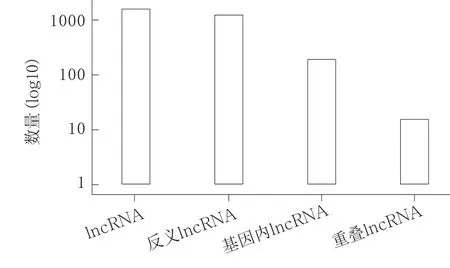
图4 通过烟雾吸入调节的lncRNA 的分类
差异表达lncRNA 顺式调控靶标基因见图6和图7A(封二)。GO 富集分析发现,富集通路主要包括:DNA 依赖性转录、DNA 依赖性转录调控、中性粒细胞趋化性、DNA 依赖的转录负调控、精子生成、免疫系统进程、RNA 聚合酶II 启动子转录的正调控、RNA 聚合酶II 启动子转录的负调控、DNA 依赖转录的正调控、RNA 聚合酶II 启动子转录的调控(图8A)。差异表达lncRNA 顺式调控靶标基因的KEGG 富集分析发现,富集通路主要包括:IBD、利什曼病、癌症中的转录失调、金黄色葡萄球菌感染、产生IgA 的肠道免疫网络、氰氨基酸代谢、哮喘、间隙连接、同种异体移植排斥、1 型糖尿病(图8B)。
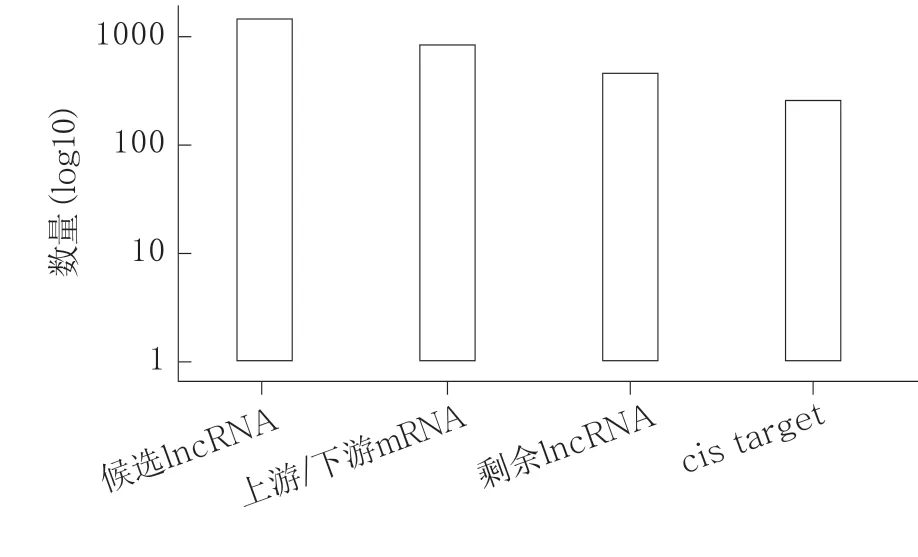
图6 差异表达lncRNA 顺式作用靶标的分类
差异表达lncRNA 反式调控靶标基因见图7B(封二)。GO 富集分析发现,富集通路主要包括:免疫反应、免疫系统进程、炎症反应、细胞黏附、细胞表面受体信号通路、趋化性、横纹肌收缩、T细胞受体信号通路、B 细胞活化和干扰素γ 生成的正调控(图9A)。差异表达lncRNA 反式调控靶标基因的KEGG 富集分析发现,富集通路主要包括:造血细胞谱系、细胞因子-细胞因子受体相互作用通路、移植物抗宿主病通路、原发性免疫缺陷、同种异体移植排斥、1 型糖尿病、自然杀伤细胞介导的细胞毒性、IBD、麻疹和病毒性心肌炎等(图9B)。
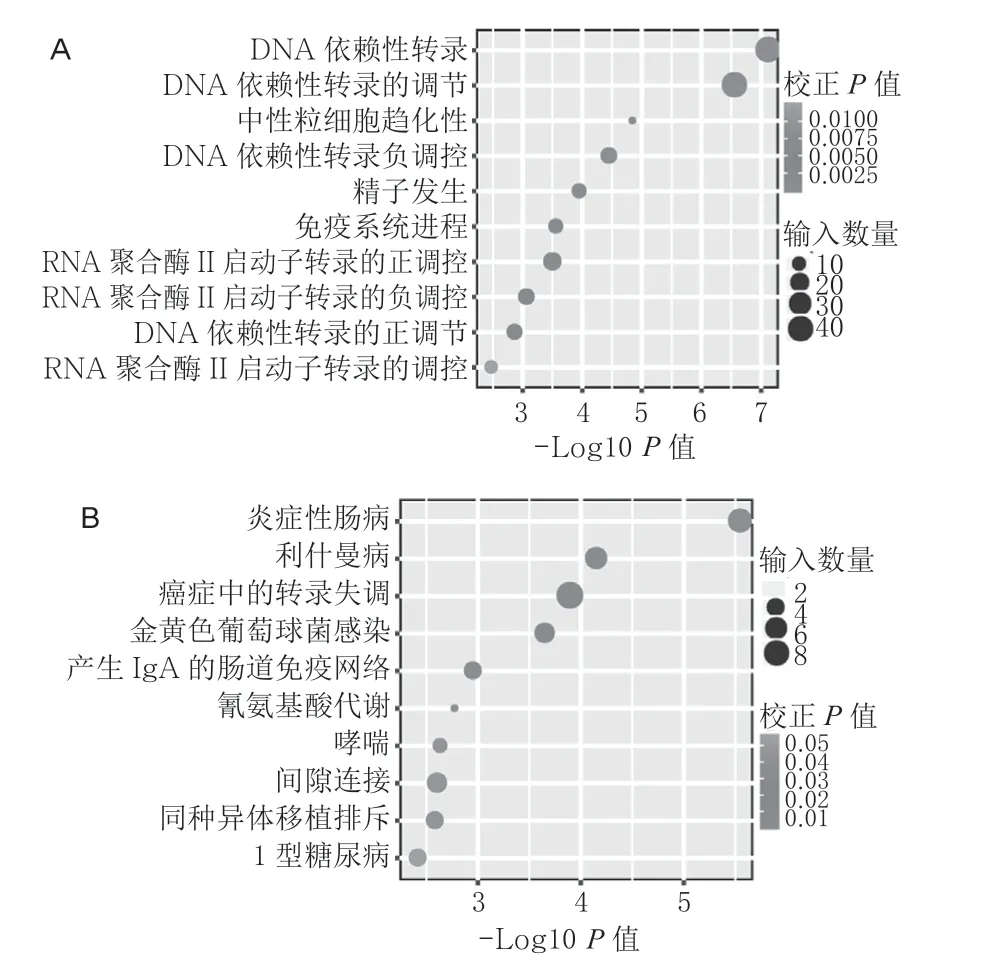
图8 差异表达lncRNA 顺式作用靶标的GO 分析图(A)和KEGG 分析图(B,图中列出前10 位代表性的生物信号通路)
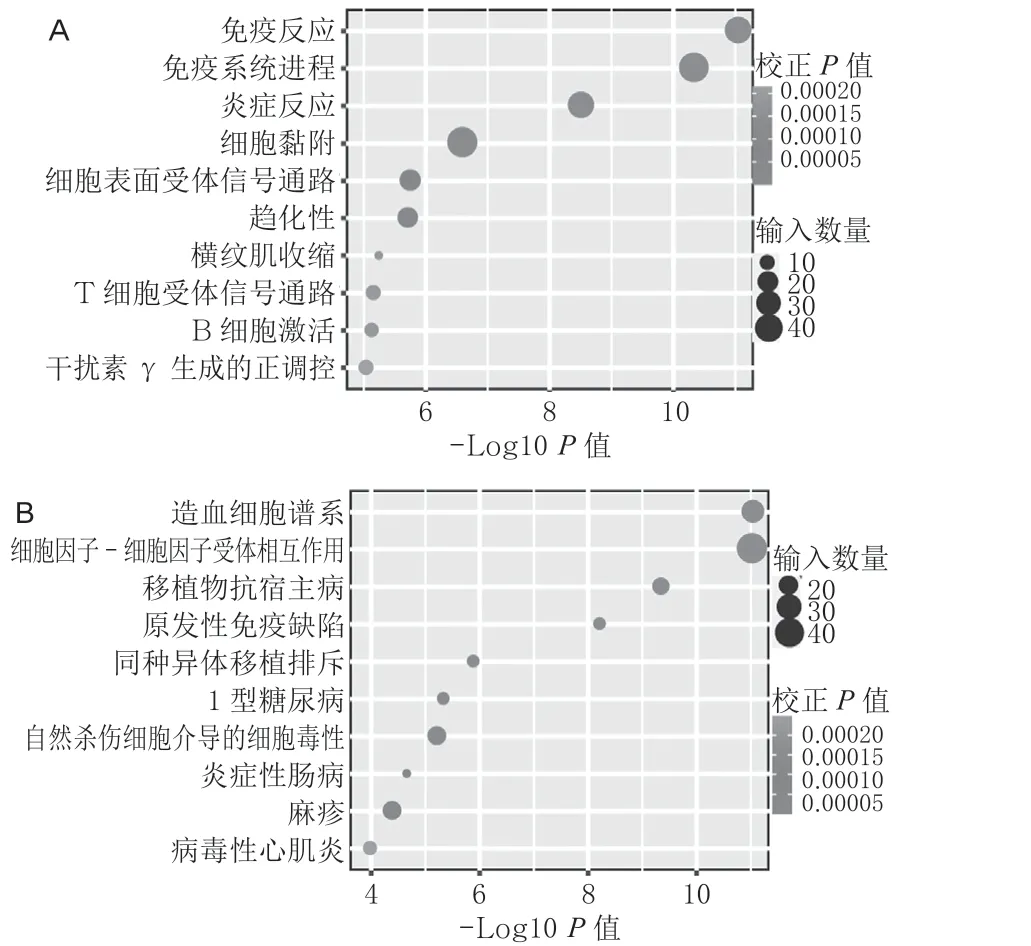
图9 差异表达lncRNA 反式作用靶标的GO 分析图(A)和KEGG分析图(B,图中列出前10位代表性的生物信号通路)
2.4 差异表达lncRNA 的qRT-PCR 验证 差异表达的lncRNA-mRNA 共表达关系见图10。通过分析差异表达较大、在其他相关文献中有报道的差异lncRNA,我们以qRT-PCR 的方法验证烟雾吸入性损伤后小鼠肺组织中差异表达的4 个lncRNA:与对照组相比,烟雾吸入性损伤后的小鼠肺组织中lncRNA AU019990 升高,lncRNA Gm29264 升高,lncRNA Gm28707 降 低,lncRNA 5830405F06Rik降低。经生物信息学初步分析发现,差异表达的lncRNA AU019990 与Trem1、II1r2 基 因 存 在共表达关系;差异表达的lncRNA Gm29264 与Trem1 基因存在共表达关系;差异表达的lncRNA Gm28707 与Bcl2l1 基因存在共表达关系;差异表达 的lncRNA 5830405F06Rik 与II12A 基 因 存 在共表达关系。每个差异表达lncRNA 可能与多个mRNA 存在共表达关系。
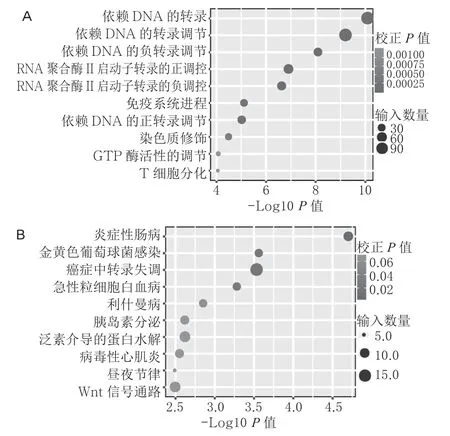
图10 差异表达的lncRNA-mRNA 的GO 分析图(A)和KEGG分析图(B,图中列出前10 位代表性的生物信号通路)
3 讨 论
烟雾吸入性损伤患者,病症较轻者表现为咳嗽、胸闷、呼吸不适,重症患者表现为气道阻塞、肺部急症,有的甚至出现急性呼吸性窘迫综合征(ARDS)而危及生命[13]。烟雾吸入引起的急性肺损伤的机制尚未明确,目前无有效的治疗措施[14]。呼吸道是烟雾吸入的直接损伤部位,烟雾吸入导致的肺急性损伤病理过程较为复杂。研究发现,在烟雾吸入性早期,热力、烟雾中的多种化学物质,中性粒细胞、巨噬细胞等各种炎症细胞及其释放的多种炎性介质和细胞因子如白细胞介素-1(IL-1)、IL-6、IL-8、IL-10、单核细胞趋化蛋白1、肿瘤坏死因子-α(TNF-α)、核转录因子-κB(NF-κB)、髓过氧化物酶等,会诱发广泛且剧烈的肺局部组织急性炎症反应,导致急性呼吸功能障碍,并会进一步引起多器官功能障碍[15]。近年来研究发现,烟雾吸入也可导致肺组织多种细胞的凋亡,如血管内皮细胞、肺内炎症细胞和肺泡Ⅱ型细胞等[16]。
人类基因组约90%的区域可被转录,而只有约1.2%编码蛋白,这表明真核基因组产生的大多数RNA 分子没有蛋白编码能力,被称为非编码RNA(ncRNAs)[17]。ncRNAs 分为2 类,短链非编码RNA(<200 nt)和长链非编码RNA(lncRNA,>200 nt)。短链非编码RNA,如siRNA、miRNA和piRNA,在基因转录和转录后调控中的作用已有充分认识;而lncRNA 的作用尚未完全研究清楚[18]。已有一些实验研究结果证实,lncRNA 以多种方式参与转录调控以及转录后调控。lncRNA 的调控作用形式更加复杂,参与机体的生长发育、细胞凋亡、增殖、分化等,在肿瘤、感染、自身免疫、慢性代谢性疾病等多种疾病中起重要作用[19]。
lncRNA 在急性肺损伤、肺纤维化及慢性阻塞性肺疾病等相关疾病模型中有报道,但在烟雾吸入性损伤中的作用尚未检索到。Wang 等[20]研究发现,脂多糖诱导的小鼠急性肺损伤模型肺组织中lncRNA 和mRNA 有明显变化,干预部分lncRNA可减轻脂多糖诱导的炎症反应。Li 等[21]对放射性肺炎小鼠肺组织进行了差异表达lncRNA 的相关研究,发现小鼠放射性肺炎后信号通路发生显著变化的有Th1 和Th2 细胞分化、Th17 细胞分化和造血细胞系相关通路,提示辅助性T 细胞可能参与肺纤维化及放射性肺损伤等病理过程。
本研究中建立烟雾吸入性损伤小鼠动物模型采用了文献[5]的方法,已证实,在烟雾吸入致伤14 min 后,小鼠肺组织间质内有大量炎性细胞浸润,肺组织充血、结构破坏,提示烟雾吸入对小鼠造成了中、重度肺损伤。本研究通过高通量测序及生物信息学分析发现,烟雾吸入性小鼠肺组织相比正常小鼠肺组织有1 008 个mRNA 差异表达(其中上调369 个,下调639 个),有2 071 个lncRNA 差异表达(其中上调286 个,下调1 785个)。GO 分析和KEGG 分析分别通过GO 数据库和KEGG 数据库对基因产物从功能、参与的生物途径及细胞中的定位进行标准化描述,即对基因产物进行简单注释。通过GO 分析和KEGG 分析发现,差异表达mRNA 与lncRNA 高度富集到与炎症、免疫、转录调控等相关的通路。在随后分析筛选得到差异lncRNA 后,通过qRT-PCR 验证了4 个lncRNA 分子:与对照组相比,烟雾吸入性损伤后的小鼠肺组织中lncRNA AU019990 升高,lncRNA Gm29264 升 高,lncRNA Gm28707降低,lncRNA 5830405F06Rik 降低。其中差异表达的lncRNA AU019990 与Trem1、II1r2 基因存在共表达关系;差异表达的lncRNA Gm29264 与Trem1 基因存在共表达关系;差异表达的lncRNA Gm28707 与Bcl2l1 基因存在共表达关系;差异表达的lncRNA 5830405F06Rik 与II12A 基因存在共表达关系。Trem1 是一种在中性粒细胞和单核细胞上表达的信号受体,在炎症中起重要作用。Trem1与DAP12 结合以诱导细胞内信号通路[22]。Liu 等[23]发现,Trem1 通过激活NLRP3 来加剧急性肺损伤的肺部炎症。Bcl2l1 属于Bcl-2 家族。Bcl-2 蛋白通过蛋白-蛋白相互作用的方式调节线粒体凋亡的激活[24]。II12A 基因在炎性相关通路中也发挥重要作用[25]。这些改变的基因在烟雾吸入性损伤中可能发挥上述作用,也可能以目前未知的方式发挥作用。这些发现有助于潜在药物靶标的发现。
综上,烟雾吸入性损伤后,lncRNA 显著差异性表达,参与介导了转录调控、炎症免疫等相关生理病理过程。本研究为进一步深入研究奠定了基础。
