复方中药对流感病毒A/PR/8/34(H1N1)感染小鼠淋巴细胞功能和细胞因子的影响*
2020-04-09王学文刘佐民王劲松李永清
王学文 刘佐民 王劲松 李永清
(1. 中国食品药品检定研究院实验动物资源研究所,北京 102629)(2. 北京市农林科学院畜牧兽医研究所,北京 100097)
流行性感冒简称流感,是一种由甲型流感病毒引起的急性呼吸道传染病。甲型流感病毒可以引起人和多种动物感染发病。由于流感病毒具有高突变率和高变异性,病毒的不断变异[1-3]往往导致疾病的大暴发与大流行,给人类的健康乃至生命安全构成了严重威胁,经济发展造成了重大损失。另外,抗流感病毒药物的研发是流感防治的重要目标,然而该病毒的这种高突变率与高变异性为抗病毒药物的研发带来很大困难,抗流感病毒药物研发是流感防治研究的重要目标之一。
中药是我国医药的宝贵资源,从古到今在防治流感疾病方面发挥了重大的作用,不仅对流感病毒有直接杀伤作用,还能调动机体特异性和非特异性免疫功能来增强抗病毒能力。由蒲公英、百部、白薇、白术等多味中药组成的复方中药是北京洪天力药业有限公司提供的临床经验方,该复方中药具有解热镇痛、抗病毒、抗感染、抗氧化和调节免疫功能等作用[4-7]。前期对该复方中药抗流感病毒作用进行了研究,证实了该中药具有体外多环节抗流感病毒作用[8],体内具有抑制流感病毒在肺内增殖,减轻流感病毒造成的肺损伤的功效[9]。但有关该药对流感病毒感染后免疫功能的影响尚不明确,因此,本实验以流感病毒A/PR/8/34(H1N1)滴鼻。感染小鼠造模,进一步观察免疫器官指数,T、B淋巴细胞转化率和肺组织中的细胞因子水平,以期进一步明确复方中药抗流感病毒作用,探索作用机理,为该复方中药的临床应用提供更多理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物:SPF级BALB/c小鼠,雌性90只,6~8周龄,18~22 g,由北京大学医学部实验动物科学部提供,实验动物生产许可证号:SCXK(京)2016-0010。饲养于北京市农林科学院畜牧兽医研究所隔离器中,实验动物实验许可证号:SYXK(京)2017-0039。环境参数:温度(25±1)℃,相对湿度(55±15)%,压差≥50 Pa,洁净度5级,明暗交替12 h/12 h。适应性喂养5 d后开始进入正式实验。实验福利伦理审查号:20150316-3。实验期间,根据实验动物使用的3R原则给予人道关怀。
1.1.2病毒:H1N1鼠肺适应株全称流感病毒A/PR/8/34(H1N1),简称流感病毒PR8,由中国农业大学刘金华老师馈赠。经鸡胚传代增殖2轮,过滤后,-80 ℃保存备用。经测定LD50为10-3.375/50 μL。
1.2 试剂及仪器
复方中药(北京洪天力药业有限公司提供的临床经验方);盐酸金刚烷胺、刀豆蛋白(ConA)、脂多糖(LPS)、淋巴细胞分离液Histopaque 1083、RPMI 1640 培养基、四甲基偶氮唑盐(MTT)(Sigma公司);小鼠IL-6、IL-10、TNF-α和IFN-γ酶联免疫试剂盒(Ebioscience公司)。
CO2培养箱HF151(上海力申科学仪器有限公司);酶标仪Model 550(Bio-Rad公司);生物安全柜BHC-1300IIA2(苏州安泰空气技术有限公司);-80 ℃冰箱DW-HL828(中科美菱低温科技有限责任公司);超纯水系统Milli-Q Integral(Millipore公司)。
1.3 方法
1.3.1实验动物分组及流感病毒模型的建立:将90只雌性BALB/c小鼠,适应性喂养5 d。称量记录后随机分为6组:空白对照组,模型对照组,盐酸金刚烷胺对照组,复方中药高、中、低剂量组,每组15只,5只/笼。分组及给药剂量见表1。按人和小鼠剂量关系[10]转换成复方中药中剂量组剂量为0.75 g/kg,并以中剂量的2倍作为复方中药高剂量组剂量,中剂量的1/2作为复方中药低剂量组剂量。试验前用100 ℃去离子水进行稀释配制,复方中药制剂高、中、低剂量浓度分别为75 mg/mL,37.5 mg/mL和18.8 mg/mL。
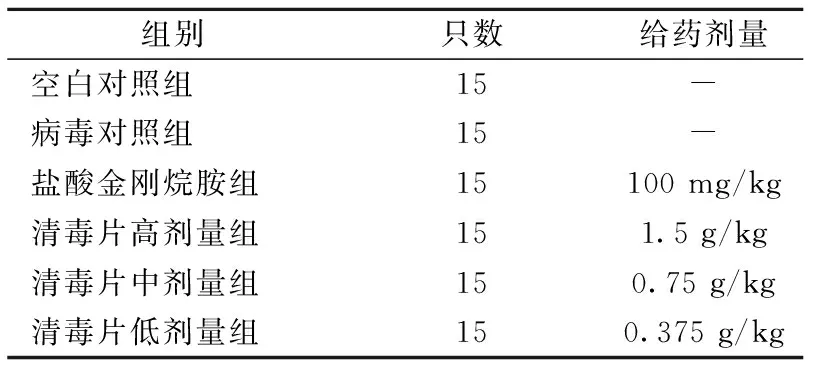
表1 实验动物分组Table 1 The group of experimental animals
复方中药组灌胃2 d后,空白对照组小鼠滴鼻生理盐水50 μL/只,其他各组攻毒流感病毒PR8 10LD50/50 μL。病毒感染4 h后,中药各组灌胃给药,连续灌胃5 d,1次/d,0.2 mL/10 g。空白对照组和模型对照组灌胃给予去离子水,盐酸金刚烷胺组灌胃10 mg/mL盐酸金刚烷胺,灌胃体积、时间和方式同中药三个剂量组。
1.3.2复方中药对流感病毒PR8感染BALB/c小鼠脾脏指数和胸腺指数的测定流感病毒PR8感染BALB/c小鼠5 d后,小鼠禁食不禁水12 h后,称体质量,无菌取血。然后颈椎脱臼处死,摘取胸腺和脾脏并称质量,按下列公式计算胸腺指数和脾脏指数:
脾脏指数=(小鼠脾质量/小鼠体质量)×100%
胸腺指数=(小鼠胸腺质量/小鼠体质量)×100%
1.3.3复方中药对流感病毒PR8感染BALB/c小鼠T、B淋巴细胞增殖的测定:流感病毒PR8感染BALB/c小鼠5 d后的小鼠无菌取外周血于肝素钠润湿的2 mL离心管中,加入PBS混匀后,将混匀后的血样轻轻加到淋巴细胞分离液的液面上。2 000 r/min离心20 min,小心吸取分离液和PBS之间的白色雾状细胞至新的试管中,即为外周血单核细胞。沉淀再用1 mL 1640完全营养液重悬,制得淋巴细胞悬液。台盼蓝染色,显微镜计数其中的活细胞数,调整至2×106个/mL。细胞悬液内一份加入ConA,每孔100 μL,每组4个重复,ConA最终浓度为5 μg/mL,用于测定T淋巴细胞转化率;另一份加入LPS,每孔100 μL,每组4个重复,调整LPS最终浓度为10 μg/mL,用于测定B淋巴细胞转化率。细胞板置于37 ℃ 5%CO2培养箱2 d后,加入5 mg/mL 20 μL,MTT,继续培养4 h后取出,置于超净工作台上,加150 μL,DMSO震荡溶解10 min,用酶标仪A570读数。以各样本A值表示T、B淋巴细胞的增殖能力[11]。
1.3.4复方中药对流感病毒PR8感染BALB/c小鼠肺组织中细胞因子水平的测定:流感病毒PR8感染BALB/c小鼠5 d后,小鼠禁食不禁水12 h后处死,打开胸腔并摘取全肺,用生理盐水冲洗干净,再用滤纸吸干水分,电子天平称质量。分别取肺脏置匀浆器中加冷生理盐水,肺脏质量与生理盐水体积比为1∶9,在冰浴中研磨制成匀浆,4 ℃离心后取上清准备检测细胞因子。IL-6、IL-10、TNF-α和IFN-γ细胞因子测定方法均是采用双抗夹心法测定,操作严格按照试剂盒说明书要求进行。
1.4 统计方法
2 结果
2.1 复方中药对流感病毒PR8感染BALB/c小鼠脾脏指数和胸腺指数的影响
流感病毒PR8感染BALB/c小鼠后,与空白对照组相比,模型对照组脾脏指数和胸腺指数显著降低 (P<0.01)。采用复方中药和盐酸金刚烷胺治疗后,与模型对照组相比,复方中药中剂量组胸腺指数显著升高 (P<0.01),复方中药中剂量组脾脏指数显著升高(P<0.05);其他组脾脏指数和胸腺指数也都有所增高,但无统计学意义(P>0.05);复方中药高、中、低剂量组的脾脏指数和胸腺指数两两比较无统计学意义(P>0.05)。结果见表2。
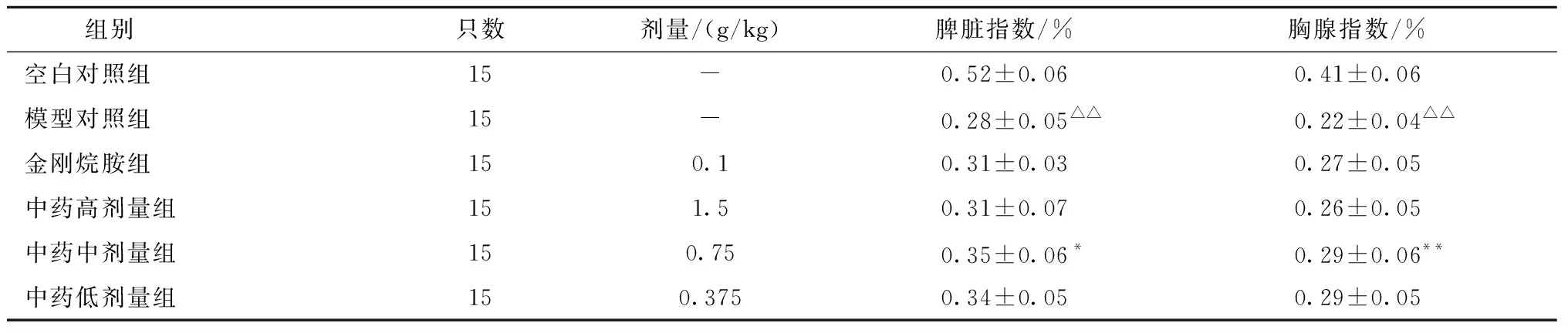
表2 复方中药对PR8感染BALB/c小鼠脾脏指数和胸腺指数的影响Table 2 Influence of compound traditional Chinese medicine on the spleen index and thymus index of PR8 infected BALB/c mice
2.2 复方中药对流感病毒PR8感染BALB/c小鼠的T、B淋巴细胞增殖的影响
流感病毒PR8感染小鼠后,与空白对照组比较,模型对照组T、B淋巴细胞A值显著降低(P<0.01);经药物治疗后,与模型对照组相比,复方中药中剂量组T、B淋巴细胞A值显著增高(P<0.05),其他组T、B淋巴细胞A值均有不同程度的增高,但无统计学意义(P>0.05);复方中药高、中、低剂量组之间的T、B淋巴细胞A值两两比较无统计学意义(P>0.05)。结果见表3。
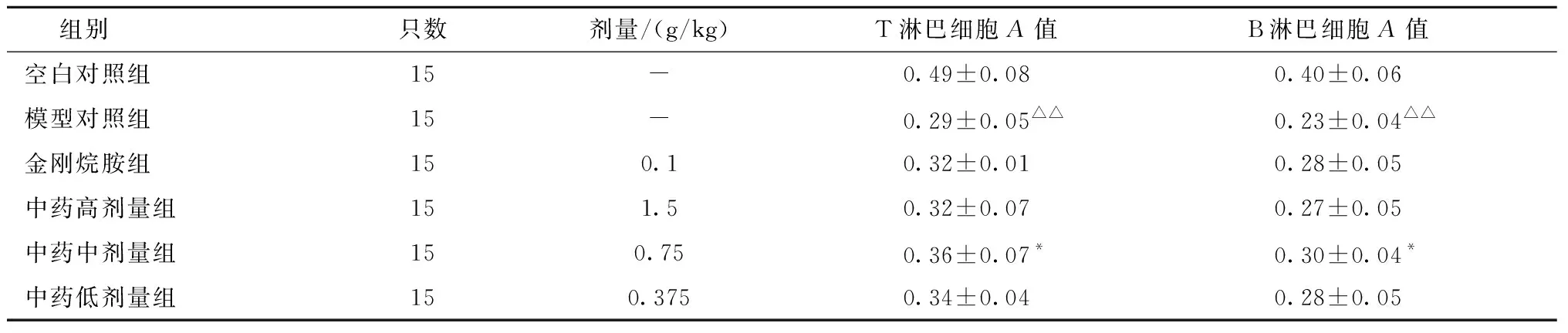
表3 复方中药对PR8感染小鼠T、B淋巴细胞增殖的影响Table 3 Influence of compound traditional Chinese medicine on multiplication of T and B lymphocytes in PR8 infected mice
2.3 复方中药对流感病毒PR8感染BALB/c小鼠肺组织中细胞因子水平的影响结果
2.3.1复方中药对流感病毒PR8感染BALB/c小鼠肺组织中TNF-α和IL-6含量的影响
流感病毒感染小鼠5 d后,与空白对照组相比,模型对照组TNF-α和IL-6显著升高(P<0.01);与模型对照组相比,复方中药中剂量组和复方中药低剂量组TNF-α显著降低 (P<0.01),复方中药中剂量组IL-6显著降低 (P<0.05),其他组均有不同程度的降低,但无统计学意义(P>0.05);复方中药高、中、低剂量组的TNF-α和IL-6含量两两比较无统计学意义(P>0.05)。结果见表4。
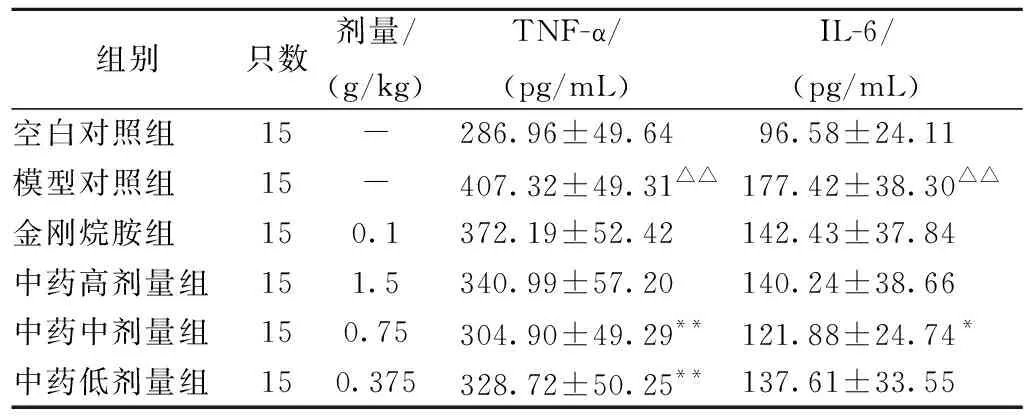
表4 复方中药对PR8感染BALB/c小鼠肺组织中TNF-α和IL-6含量的影响Table 4 Impact of compound traditional Chinese medicine on lung tissue TNF-α和IL-6 concent in PR8 infected BALB/c mice
2.3.2复方中药对流感病毒PR8感染BALB/c小鼠肺组织中IL-10含量的影响:模型对照组与空白对照组相比,IL-10显著降低(P<0.01);与模型对照组相比,灌胃给药后,复方中药中剂量组IL-10显著升高 (P<0.05),其他组均有不同程度的升高,但是没有统计学意义(P>0.05);复方中药高、中、低剂量组的IL-10含量两两比较无统计学意义(P>0.05)。结果见表5。
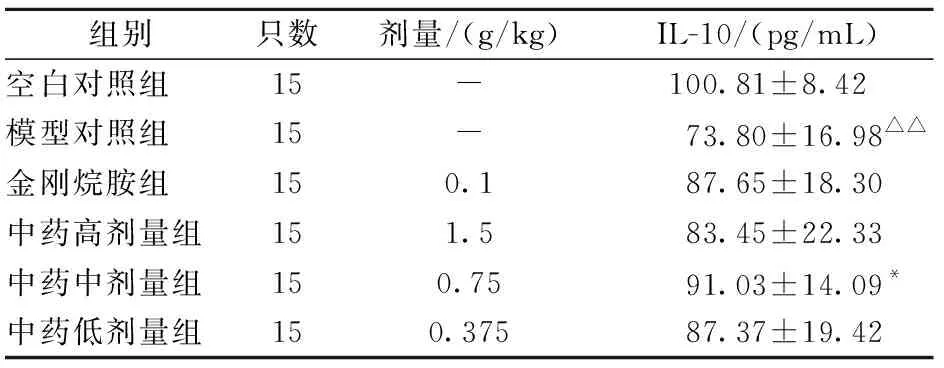
表5 复方中药对PR8感染BALB/c小鼠肺组织中IL-10含量的影响Table 5 Impact of compound traditional Chinese medicine on lung tissue IL-10 concent in PR8 infected BALB/c mice
2.3.3复方中药对PR8感染BALB/c小鼠肺组织中IFN-γ含量的影响:与空白对照组相比,模型对照组IFN-γ显著降低(P<0.01);与模型对照组相比,复方中药中、低剂量组IFN-γ显著升高(P<0.01),复方中药高剂量组IFN-γ显著升高(P<0.05);复方中药高、中、低剂量组的IFN-γ含量两两比较无统计学意义(P>0.05)。结果见表6。

表6 复方中药对PR8感染BALB/c小鼠肺组织中IFN-γ含量的影响Table 6 Impact of compound traditional Chinese medicine on lung tissue IFN-γ concent in PR8 infected BALB/c mice
3 讨论
脾脏是机体识别异物,促进免疫细胞分化增殖,进而发生免疫应答的场所;脾脏指数能够反映机体免疫细胞分化增殖能力。胸腺是T淋巴细胞的发生成熟的场所,流感病毒能通过树突状细胞从肺转移到胸腺并干扰 T 淋巴细胞的合成[12],胸腺指数能初步反映机体的免疫状况。 实验中流感病毒PR8感染BALB/c小鼠5 d后,与空白对照组相比,模型对照组小鼠脾脏指数和胸腺指数显著降低,进一步证明小鼠流感病毒感染模型建立成功。各组小鼠连续灌胃药物7 d后,与模型对照组相比,复方中药中剂量组小鼠胸腺指数和脾脏指数显著升高,原因有可能是复方中药中剂量组的小鼠病毒感染后引起免疫应答,引起胸腺和脾脏内部结构的变化,抑制其免疫器官的萎缩。其他药物组小鼠脾脏指数和胸腺指数均有不同程度的升高,但无统计学意义,可能是其引起的免疫应答不足以抑制PR8感染小鼠的免疫器官胸腺和脾脏发生内部结构变化。
淋巴细胞增殖实验是检测机体免疫功能的常用指标,淋巴细胞增殖能力高低反应细胞免疫和体液免疫水平的变化。T淋巴细胞和B淋巴细胞都是特异性免疫的主要细胞,ConA体外可诱导T淋巴细胞增殖,LPS能诱导B淋巴细胞的增殖。由实验结果可见,流感病毒PR8感染BALB/c小鼠5 d后,与空白对照组相比,模型对照组小鼠的T、B淋巴细胞A值均显著降低,表明流感病毒可以明显抑制小鼠淋巴细胞增殖,抑制了机体免疫功能;小鼠攻毒后继续灌胃药物5 d后,与模型对照组相比,复方中药中剂量组小鼠T、B淋巴细胞显著升高,表明复方中药中剂量组可改善小鼠细胞功能,提高机体的免疫能力。而其他药物组T、B淋巴细胞A值均有不同程度的升高,但无统计学意义,表明可能其不足以改善小鼠细胞功能,提高机体的免疫能力。
机体感染流感病毒可引起肺部间质性肺炎,对肺部造成一定损伤,生成一些超出生理浓度的细胞因子,过多的细胞因子导致内皮细胞活化,白细胞迁移和毛细血管的渗漏等,增加对肾脏毒性,严重的可以引起心肾衰竭,引起死亡[13-14]。细胞因子按功能可以分为促炎因子与抗炎因子两类。复方中药治疗病毒感染性疾病并不是单纯抗病毒,还可以抑制或调节机体炎症免疫病理反应[15-16]。因为肺脏是流感病毒的靶器官,本实验测定小鼠连续灌胃药物5 d后肺组织匀浆中的细胞因子,可更直接反应药物调节细胞因子分泌改变机体的炎症损伤的状态。
TNF-α是重要的炎症促进因子,被认为是前炎症因子的关键因子,可以控制后来的前炎症细胞因子如IL-6的产生。当TNF-α的浓度升高时,可以介导炎性反应的许多病变过程,比如引起局部炎性反应,造成器官甚至系统的损害。IL-6是一种小分子糖蛋白,也是一种重要的促炎性因子。二者均为致炎因子,它们是构成免疫性病理损害的重要因素[17],阻断二者的过量产生,可以减轻或清除其对器官的损伤。本实验研究结果显示,流感病毒PR8感染BALB/c小鼠5 d后,肺组织中TNF-α和IL-6均明显高于空白对照组,说明病毒感染可引起机体免疫功能紊乱,通过引起TNF-α及IL-6的大量释放,造成肺部炎症损伤。经复方中药干预治疗后,与模型对照组相比,复方中药中剂量组小鼠肺组织中IL-6和TNF-α显著降低;复方中药低剂量组小鼠肺组织中TNF-α显著降低。表明复方中药能调节机体免疫功能,使机体对病毒产生了免疫应答,并将其进行清除,从而减轻小鼠感染流感病毒过程中降低炎性因子的表达,减少了局部或全身的炎症损伤。
伴随着炎性细胞因子的趋化、活化和释放,机体同时会分泌炎症抑制因子对其进行反向调节。IL-10近些年来受到大量关注,针对炎症反应的调节起着非常重要的作用[18]。该研究结果发现BALB/c小鼠感染流感病毒后IL-10明显降低,表明流感病毒可以导致机体抗炎性细胞因子IL-10的表达降低。可能由于细菌或病毒吸附在呼吸道黏膜表面或上皮细胞上,直接造成损害,影响细胞因子的产生和释放,致使其分泌水平的下降,这与胡旭[19]报道一致。经复方中药干预治疗后,各组小鼠肺组织IL-10基因的表达相对模型对照组均有不同程度的增加,且复方中药中剂量组IL-10显著升高,表明了复方中药能明显上调流感病毒感染小鼠过程中肺组织中抗炎因子IL-10的表达。
IFN-γ是一种广泛的抗病毒物质,有着广泛的免疫调节作用的抗病毒物质,几乎对所有病毒都有一定程度的抑制作用,被认为是抑制宿主病毒感染的第一道防线[20]。本研究结果显示流感病毒PR8感染小鼠后,肺组织中IFN-γ的含量明显降低,说明流感病毒PR8感染BALB/c小鼠后,可抑制其免疫调节功能,降低抗病毒能力。经复方中药干预治疗后,复方中药中、低剂量组IFN-γ含量均明显升高,都具有统计学意义,表明复方中药具有免疫调节和抗病毒,清除病原体等作用。
此外,实验结果表明复方中药中剂量调节细胞因子分泌能力优于复方中药高剂量组和复方中药低剂量组,这有可能是复方中药高剂量组本身对机体产生一定的副作用,复方中药低剂量组药物有效浓度不够,不能显著调节细胞因子分子。与模型对照组相比,盐酸金刚烷胺在降低促炎性因子TNF-α和IL-6,提高抗炎性因子IL-10和提高抗病毒因子IFN-γ方面,均无统计学意义,说明盐酸金刚烷胺并不是通过调节细胞因子分泌的途径来抑制流感病毒的增殖。
复方中药可以减轻免疫器官脾脏和胸腺萎缩程度,通过改善流感感染小鼠的T细胞免疫和B淋巴细胞体液免疫功能,调节细胞因子浓度来发挥其抗病毒作用。然而复方中药抗流感病毒作用是否还存在其他作用机制还有待进一步证实。
