模板法制备多孔交联脂肪酶聚集体碳酸钙及其特性
2020-04-09苗长林吕鹏梅王忠铭李惠文杨玲梅
苗长林,吕鹏梅,王忠铭,李惠文,杨玲梅,罗 文
模板法制备多孔交联脂肪酶聚集体碳酸钙及其特性
苗长林,吕鹏梅,王忠铭,李惠文※,杨玲梅,罗 文
(中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640)
针对传统交联脂肪酶聚集体(cross-linked lipase aggregates,CLEAs)表面密实、比表面积小、无太多孔隙结构、在催化过程中存在扩散限制、影响酶催化效率等问题,该文通过脂肪酶、氯化钙、碳酸钠、硫酸铵共沉淀制备脂肪酶/碳酸钙微球,再加入二硫苏糖醇(dithiothreitol,DTT)进行脂肪酶交联自组装,然后用乙二胺四乙酸二钠(EDTA)去除碳酸钙模板剂,制得多孔交联脂肪酶聚集体微球(p-CLEAs),对其制备条件、结构特征、酶学性质进行研究。结果表明,最佳制备条件为:Ca2+浓度0.35 mol/L、脂肪酶与Ca2+比例5:1、沉淀剂饱和度80%、沉淀pH值为 8、沉淀时间45 min、DTT体积分数0.2%、交联时间40 min。与常规CLEAs相比,所制备的p-CLEAs在甲醇耐受性、热稳定性和pH值稳定性方面均有明显改善,4 ℃保藏6个月,仍保持较高的活性。其结构稳定,形貌、孔道尺寸可调控,呈多孔结构,这种多孔结构使得底物分子更容易进入脂肪酶的活性位点,不仅降低了传质限制,还提高了催化效率,具有较高的催化活性。
催化剂;酶;交联酶聚集体;脂肪酶;固定化;碳酸钙;多孔
0 引 言
脂肪酶催化因具有反应条件温和、专一性强、效率高等优势而得到广泛关注[1],但直接使用游离的脂肪酶作催化剂,存在操作稳定性差,对热、强酸、强碱均不稳定,易失活、不易重复使用、分离纯化操作复杂等问题[2]。而酶的固定化不仅可以提高酶的稳定性,还有利于酶的回收和重复利用及连续自动化生产,这对降低生产成本、提高生产效率具有重要意义[3-4]。但常用的有载体固定化方法中,由于较强烈的化学反应,通常对脂肪酶的性质造成极大的影响[5],另外酶又具有一定的高级空间结构,极易受到载体表面物理性状、化学接枝等因素的影响,对酶的空间结构或活性中心造成不可逆的破坏,使得酶活力下降或失活,严重影响了固定化酶的效果和使用。交联酶聚集体[6](CLEAs)技术是一种利用盐等沉淀剂沉淀酶蛋白获得酶聚集体,然后用交联剂对酶聚集体进行交联制备的无载体固定化酶方法。该固定化方法获得的固定化酶无需载体,因而单位体积活性大、空间效率高,稳定性好、活性高[7-8]。但CLEAs也存在一定的局限性:CLEAs没有一定的物理形态,粒径分布范围宽,颗粒大小不均,形貌不规则[9];表面密实平整,比表面积小,无太多孔隙结构,而大多数具有催化活性的酶分子被隐蔽于CLEAs内部,在催化过程中存在扩散限制效应、空间位阻和分配效应,这些会影响酶的催化特性,进而影响其使用效率[10-11]。鉴于CLEAs技术存在上述缺陷,一些研究者[12-14]提出新的固定化酶的思路——固载化CLEAs技术:即先将酶分子吸附在有孔载体材料里,然后进行交联,在孔材料内部形成CLEAs。这种方法制备的CLEAs大小可由孔材料的孔径来控制,而且很容易回收和再分散。如Wilson等[15]和Sangeetha 等[16]将CLEAs包埋于有机或无机凝胶中以提高CLEAs活性和稳定性。Lee等[17]和Wang等[18]采用介孔和大孔材料固载化CLEAs,可有效地改善CLEAs的性质,使其热稳定性、储存稳定性和操作稳定性等明显提高。但这种方法违背了CLEAs技术的“无载体”固定化方式,又回到了传统“有载体”固定化方式。同时,由于大量孔材料载体的存在,会“稀释”脂肪酶的活性,严重降低了单位体积内酶的浓度(在整个固定化酶重量中,载体一般占90%以上),降低酶的结合容量和反应能力,并且载体固定化也会引起扩散限制效应、空间位阻、分配效应等传质问题[19]。
针对载体固定化酶制备过程中存在的单位质量酶活低、负载量低以及CLEAs固定化酶形貌、粒径、孔径可控性差等问题,本研究提出通过模板法设计制备多孔无载体固定化酶微球的思路[20-21]:以碳酸钙为模板,脂肪酶为模型酶,通过酶分子、氯化钙和碳酸钠共沉淀制备酶/碳酸钙微球,再加入交联剂进行交联或组装,而后去除碳酸钙模板,制备多孔无载体交联脂肪酶聚集体(p-CLEAs),以改善常规载体法和CLEAs在固定化酶中存在的问题。并考察固定化条件对p-CLEAs的影响,探索酶所处微环境与催化特性间关系,以实现高性能多孔脂肪酶微球可控制备。
1 材料与方法
1.1 材 料
脂肪酶(RML),实验室自制;二硫苏糖醇(DTT),生化试剂,Sigma公司;戊二醛(25%溶液)分析纯,天津科密欧化学试剂有限公司;橄榄油,分析纯,国药集团化学试剂有限公司;氯化钙、碳酸钠、硫酸铵、甲醇、EDTA,分析纯,国药集团化学试剂有限公司;其他试剂均为市售,分析纯。
NewClassic电子天平:上海梅特勒-托利多仪器有限公司;RE-52型旋转蒸发仪:上海亚荣生化仪器厂;DF–101S型恒温磁力搅拌器:上海智诚实验设备公司;DZF–6020型真空干燥箱:上海一恒科技有限公司;TGL16G台式高速离心机,上海医用仪器分析厂;S-3400N 型扫描电镜日本,Hitachi公司;FTS–40傅里叶红外光谱仪:BIORAD 公司。
1.2 试验方法
1.2.1 可控多孔交联脂肪酶聚集体(p-CLEAs)制备
1)脂肪酶共沉淀模板化制备:将游离态脂肪酶溶于磷酸盐缓冲液,加入氯化钙水溶液中,混合均匀后,快速加入与氯化钙等量等摩尔浓度碳酸钠溶液,在4~25 ℃条件下磁力搅拌1~2 min,之后,再滴加一定量硫酸铵溶液沉淀剂,在4~25 ℃下缓慢震荡1~2 min后静止10~60 min,通过共沉淀让游离态酶分子均匀分散于氯化钙与碳酸钠反应生成的CaCO3微粒内部,形成稳定球形脂肪酶凝聚碳酸钙颗粒沉淀,3 000 r/min离心洗涤3 min得共沉淀颗粒。
2)模板化酶蛋白共沉淀颗粒共价交联:将上述共沉淀颗粒中溶于磷酸缓冲液中,在4~25 ℃条件下,滴加二硫苏糖醇(DTT)溶液,缓慢震荡1~2 min,静止5~10 min,用以打开脂肪酶“分子内部”的二硫键,然后3 000 r/min离心洗涤3 min,去除DTT,将获得的沉淀物重新用磷酸盐缓冲液悬浮分散,静止10~60 min,使被打开的二硫键在酶分子间形成新的二硫键,进而得到形成“分子间”交联自组装固定化酶微粒沉淀。
3)CaCO3模板剂去除:向上述分子间交联自组装固定化酶微粒沉淀中加入0.25 mol/L EDTA溶液,4~25 ℃下震荡洗涤1 h,离心分离,洗涤,反复3~5次,用以彻底去除CaCO3模板剂,即获孔多孔交联脂肪酶聚集体微球,标记为p-CLEAs。
1.2.2 常规交联脂肪酶聚集体(CLEAs)的制备
按照已有文献进行制备[22-23],具体如下:将游离态脂肪酶溶于pH值为7.5,摩尔浓度为0.5 mol/L的磷酸盐缓冲液中,滴加饱和硫酸铵溶液沉淀剂,在4~25 ℃下缓慢震荡1~2 min后静置40 min,进行脂肪酶凝聚沉淀,3 000 r/min离心洗涤3 min,将获得的沉淀再悬浮于磷酸盐缓冲液中,向其中缓慢滴加5%的戊二醛溶液,并轻微搅拌,交联120 min,3 000 r/min离心5 min,弃去上清液,经磷酸盐缓冲液洗涤数3~5次,得到交联脂肪酶聚集体,标记为CLEAs,用于和上述制备的p-CLEAs进行对照。相关制备流程如图1。
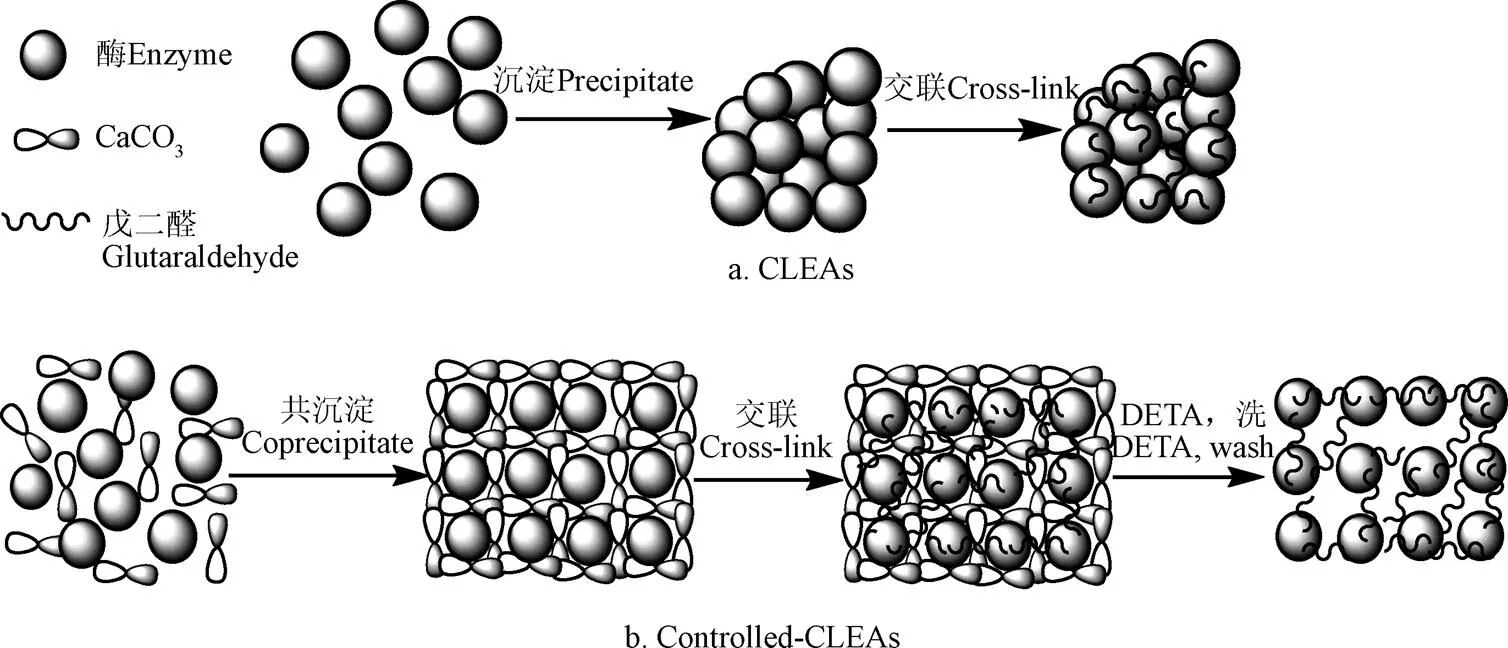
图1 传统CLEAs及controlled-CLEAs制备流程
1.2.3 脂肪酶酶活测定及回收率计算
游离酶和固定化酶的活性均采用改进的橄榄油乳化法进行测定[24]。脂肪酶活力单位定义为:在37 ℃,pH值为8.0条件下,橄榄油水解每分钟释放出1mol脂肪酸所需的酶量定义为1个脂肪酶活力单位(U)。酶活性可由下式计算得出:
(1)
式中为脂肪酶活力,U/g;1为脂肪酸浓度,mol/mL;1为脂肪酸溶液的体积,mL;2为酶液用量,mL;为作用时间,min。
固定化酶酶活回收率,按下式计算:

式中为酶活回收率,%;2为实际固定化酶的酶活力,U/g;1为固定时使用的游离酶总活力,U/g。
1.2.4 脂肪酶沉淀率测定
采用考马斯亮蓝染色法[25]测定蛋白质含量,再根据以下公式求得固定化脂肪酶沉淀率:

式中为脂肪酶沉淀率,%;2为固定化前脂肪酶含量,g;1为固定化后溶液中剩余游离的脂肪酶含量,g。
1.2.5 p-CLEAs红外测定与分析
取适量试样微球于研钵中,加入KBr并混合后压制成透明薄片,在25 ℃下,波数为400~4 000 cm-1范围内进行傅立叶变换红外光谱仪检测,仪器分辨率为4 cm-1,扫描次数32次,每个样品至少检测5次。观察脂肪酶固定化前后固体样品红外图谱,并分析其结构变化。通过相应软件对图谱进行处理,观察二级结构变化。
1.2.6 p-CLEAs扫描电镜分析
采用扫描电镜观察聚集体微球和游离脂肪酶的表面形貌,首先将经过真空冷冻干燥后的2种酶均匀撒在带有导电胶的扫描电镜的样品台上,对2种酶进行固定,然后在真空条件下进行喷金,最后放入样品室,用扫描电镜观察微球表面形态及粒径的大小。
2 结果与分析
2.1 模板化脂肪酶共沉淀颗粒制备条件优化
2.1.1 模板剂对模板化脂肪酶共沉淀颗粒活性的影响
在脂肪酶溶液质量浓度为0.06 g/mL,硫酸铵沉淀剂饱和度为80%、沉淀pH值为7、反应温度为20 ℃、沉淀时间为40 min的条件下,考察不同Ca2+浓度对脂肪酶酶活回收率和沉淀率的影响,结果见图2。

注:脂肪酶溶液质量浓度为0.06 g·mL-1,硫酸铵沉淀剂饱和度为80%、沉淀pH值为7、反应温度为20 ℃、沉淀时间为40 min。
由图2可知,随着Ca2+浓度增加,固定化酶活回收率、脂肪酶沉淀量增加,这是由于氯化钙与碳酸钠作用,形成CaCO3微晶,可将酶固定化在微晶网络中。当Ca2+浓度小于0.35 mol/L时,Ca2+质量浓度过小会导致微晶网络孔径较大,强度过小,Ca2+对酶包埋不完全,导致更多酶流失。而当Ca2+浓度大于0.35 mol/L时,Ca2+浓度过高时,形成的CaCO3模板剂微球强度越大,不利于形成均匀的孔隙结构,影响脂肪酶与模板剂微球的结合。再有,Ca2+浓度过高,会与酶作用而使酶易变性失活,相对酶活力降低。因此,Ca2+浓度选择在0.35 mol/L为最佳[26]。
2.1.2 脂肪酶酶液量与Ca2+比例的选择
在Ca2+浓度为在0.35 mol/L,硫酸铵沉淀剂饱和度为80%、沉淀pH值为7、反应温度为20 ℃、沉淀时间为40 min的条件下,考察不同酶液量与Ca2+浓度比对脂肪酶沉淀量及酶活回收率影响,结果见图3。
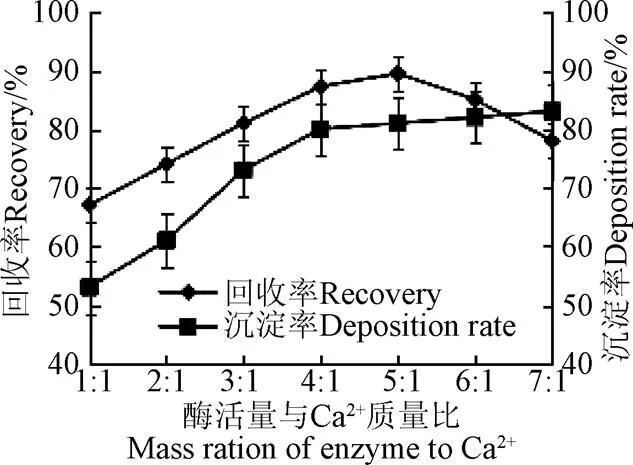
注:Ca2+浓度为在0.35 mol·L-1,硫酸铵沉淀剂饱和度为80%、沉淀pH值为7、反应温度为20 ℃、沉淀时间为40 min。
从图3中可以看出,随着酶液量的增加,脂肪酶固定化率逐步增大,在开始阶段增加速度比较快,当酶液增加到4:1后,脂肪酶沉淀率增长趋势开始缓慢,超过以后,沉淀率基本保持不变,这说明脂肪酶沉淀量已经达到模板剂的最大负载量。对于酶活回收率,在开始阶段,回收率增加迅速,在5:1时达到最大值,之后,再增加酶液的量,酶活力回收率开始下降,这可能是因为过多的酶液造成吸附在模板剂孔道内部的脂肪酶堆积在一起形成致密的团块,导致扩散阻力的增大,酶活力无法表现出来。因此脂肪酶与Ca2+比例5:1时为最佳选择[27]。
2.1.3 沉淀剂饱和度的确定
于50 mL酶液(Ca2+浓度为0.35 mol/L,脂肪酶与Ca2+比例5:1,pH 值7)中分别加入65%、70%、75%、80%、85%、90%饱和度硫酸铵沉淀剂10 mL,于20 ℃,沉淀40 min,考察其对酶活回收率的变化规律,结果见图4。由图4可知,随着沉淀剂饱和度的增加,脂肪酶分子逐步聚集成簇,然后小簇聚集为大簇。当饱和度超过80%时,脂肪酶沉淀率增长趋势开始缓慢。而酶聚集体回收率则呈现先增高后降低的趋势,当饱和度为80%时,酶聚集体酶活力最高。这可能是因为当硫酸铵浓度较低时,酶沉淀速度慢,致使大量游离酶的活性中心暴露于沉淀剂中而遭到破坏,酶聚集需要更长时间,即使形成聚集体,这些聚集体也发生了变性,从而失去活性。而高浓度的硫酸铵使游离酶立即沉淀完全,活性中心被包围在聚集体中,不易受到沉淀剂的进一步破坏,从而使酶的活性中心瞬时被锁定在高酶活状态,在一定程度上避免酶活的剧烈损失。但是,如果沉淀剂浓度过高,虽然游离酶能立即沉淀,但酶的活性也遭到了破坏,因此,选择最佳沉淀剂饱和度为80%[28]。

注:Ca2+浓度为0.35 mol·L -1,脂肪酶与Ca2+比例5:1、沉淀pH值为7、反应温度为20 ℃、沉淀时间为40 min。
2.1.4 沉淀pH值的影响
采用不同pH值(3.0~10.0)的磷酸缓冲液配制50 mL酶液,于50 mL酶液(Ca2+浓度为0.35mol/L,脂肪酶与Ca2+比例5:1)中加入80%饱和度硫酸铵沉淀剂10 mL,于20 ℃,磁力搅拌1~2 min,沉淀40 min,考察不同pH对酶活变化规律影响,结果见图5。

注:Ca2+浓度为0.35 mol·L -1,脂肪酶与Ca2+比例5:1、硫酸铵沉淀剂饱和度为80%、反应温度为20 ℃、沉淀时间为40 min。
由图5可知,随着pH值增大,脂肪酶固定化率和酶活力回收率都增加,但当pH值超过8.0以后,固定化率和酶活力回收率开始下降,这可解释为该脂肪酶的等电点在pH=8.0附近,在此条件下制备的CLEAs,酶活性中心瞬时被锁定在高酶活状态,酶活性中心不易被破坏。而pH过高,会导致脂肪酶变性失活。因此,pH=8.0为最佳缓冲液[29]。
2.1.5 沉淀时间的确定
在Ca2+浓度为0.35 mol/L,脂肪酶与Ca2+比例5:1,pH值为8,硫酸铵沉淀剂饱和度为80%、反应温度为20 ℃的条件下,对脂肪酶进行沉淀,考察不同沉淀时间对酶活变化规律影响,结果见图6。
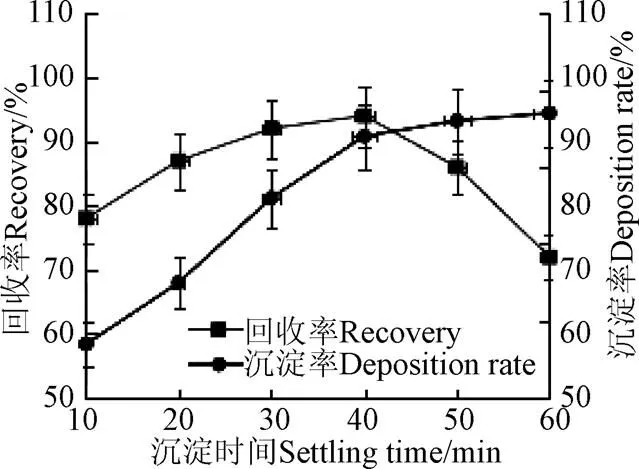
注:Ca2+浓度为0.35 mol·L -1,脂肪酶与Ca2+比例5:1、硫酸铵沉淀剂饱和度为80%、反应温度为20 ℃、沉淀pH值为7。
在酶液中加入沉淀剂进行沉淀是为了使酶液在沉淀剂的作用下形成聚集体,时间过短酶分子还没有形成聚集体,随着反应的进行,虽然脂肪酶沉淀率不断增大,后趋于稳定,但反应体系的Ca2+以及硫酸铵沉淀剂与酶作用而使酶逐渐变性失活,导致酶活较低,从图6中看出,酶活回收率随着沉淀时间的增加而逐渐增大,在沉淀40 min时,酶活回收率达到最大值,而后随着沉淀时间的增加而降低。因此选择沉淀时间为40 min最佳。
2.2 模板化共沉淀颗粒交联制备条件优化
考察不同浓度的二硫苏糖醇(DTT)溶液(0.05%~0.4%)和交联不同时间(10~60 min)对酶活影响。

注:交联时间为40 min。
由图7可知,随着二硫苏糖醇(DTT)浓度的增加,CLEAs的酶活先升高后降低。这是由于当DTT的浓度较小时,酶聚集体交联不充分不能将足够多的酶交联,酶活力回收率较低。而当浓度大于时,酶活随着DTT浓度的增大而减小,这是因为DTT的增多,酶分子之间的交联过于紧密,使得酶的空间位阻增大,导致酶聚集体内部的酶蛋白活力无法被检测到,不利于酶活性的发挥。同时DTT也是蛋白质变性剂,低浓度时有利于酶聚集体交联,而高浓度会加剧酶蛋白中毒,导致酶失活,从而引起酶活下降。因此通过试验得出,DTT浓度为0.2%为最佳交联浓度[30]。

注:交联剂浓度为0.2%。
在交联过程中,交联时间和交联剂浓度一样起着至关重要的作用,如果交联时间过短,大部分酶还没有被交联上,交联的酶比较少,酶与酶结合不牢固,而交联时间过长,脂肪酶将长时间处于交联剂的混合溶液中,而使脂肪酶变性失活,从而降低酶的活性,从图8的研究结果可以看出,最佳交联时间为40 min。
2.3 多孔交联脂肪酶聚集体微球扫描电镜分析
从图9可以看出,常规方法制备的CLEAs是由一个个粒径较小的单个聚集体组成的团簇结构,单个聚集体颗粒直径约1m,单个聚集体颗粒之间再发生交联作用,使多个单个聚集体堆积在一起,形成更大的团簇结构,团簇大小会达到300m以上,且表面光滑,结构排列紧凑,形状不规则,空隙相对较少。这种结构可能造成酶促反应传质阻力,底物难以进入酶活性中心进行反应,影响酶活力,从而导致催化效率下降。而经过碳酸钙模板法制备的p-CLEAs形成了网络状的结构,具有粗糙的更大的比表面积和丰富的空隙孔道,经测定p-CLEAs的粒径大部分在2~3m范围内,孔洞直径在60~100 nm之间,这些孔洞能够让反应底物进入酶内部与酶催化位点接触,从而提高p-CLEAs催化效率。

图9 SEM分析
2.4 CLSM分析
为了进一步表征所得的p-CLEAs脂肪酶的孔隙度,使用荧光标记的高分子量葡聚糖和纳米级荧光聚苯乙烯微球浸泡p-CLEAs脂肪酶。(葡聚糖的分子量分别为500和2 000 kDa,直径分别为29 kDa和56 nm;纳米级荧光聚苯乙烯微球直径75~100 nm)。
由图10可知,即使分子量小于500 kDa(29 nm)的葡聚糖也不能自由扩散到CLEAs脂肪酶颗粒中,而分子量为2 000 kDa(56 nm)的葡聚糖可以自由扩散到p-CLEAs脂肪酶颗粒中。此外,纳米级荧光聚苯乙烯珠的透性研究表明,75 nm级聚苯乙烯微球可以穿透p-CLEAs内部,而100 nm级聚苯乙烯珠不能进入p-CLEAs内部,而是粘在p-CLEAs表面。以上研究表明,p-CLEAs脂肪酶颗粒为介孔,孔径小于100 nm。这再次印证了上述SEM分析,p-CLEAs脂肪酶为多孔结构,p-CLEAs脂肪酶的多孔结构有利于反应物的扩散,提高反应效率。
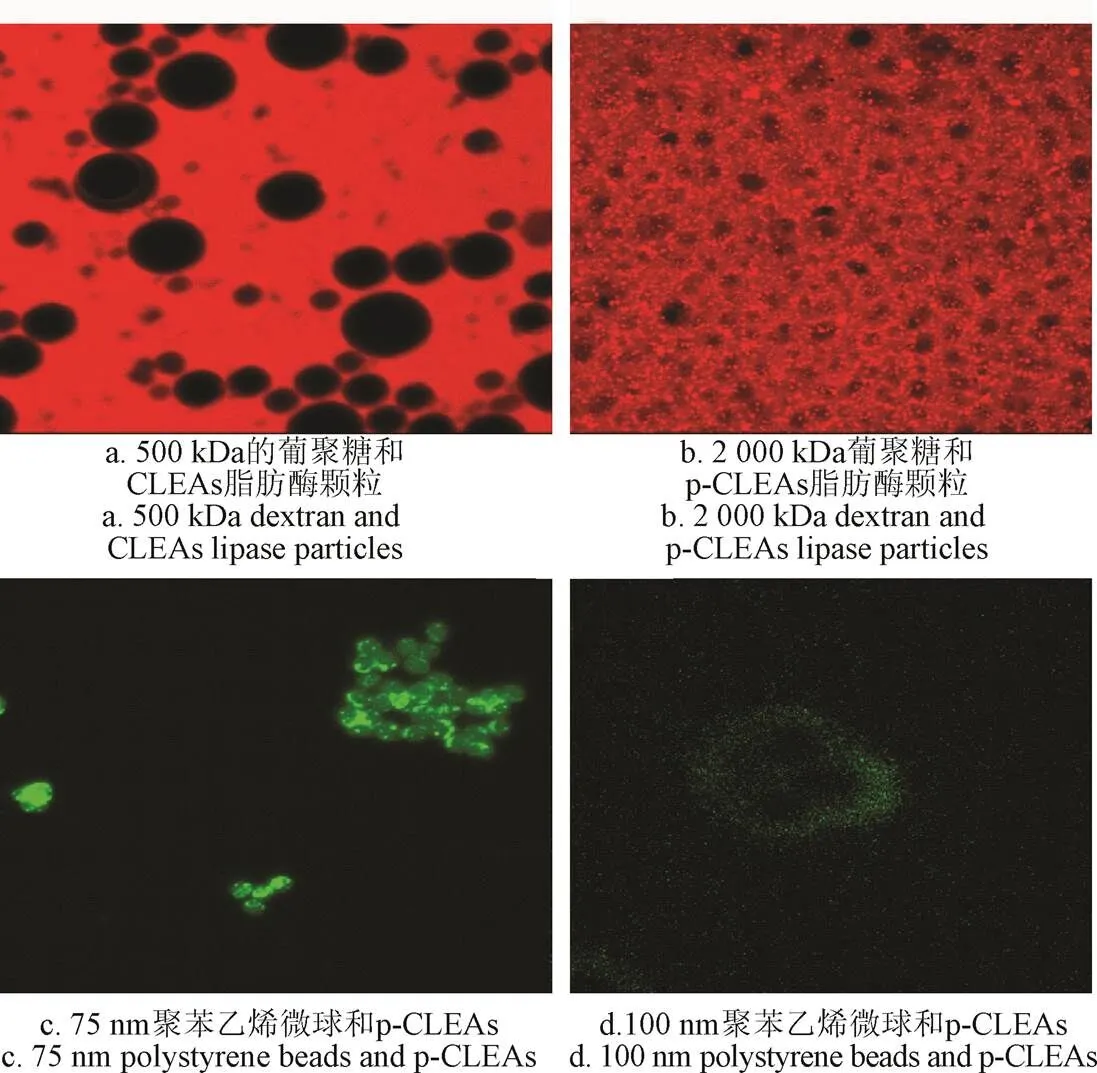
图10 样品形貌分析
2.5 多孔交联脂肪酶聚集体微球红外分析
由图11红外谱图可知,吸附峰在3 406或3 477 cm-1处为羟基吸收峰,吸附峰在2 918 cm-1处为脂肪酶分子中出现的CH2键伸缩振动带,吸附峰在1 311 cm-1处为CH2弯曲和摇摆吸收峰。由图11b可知,在1 456 cm-1处为戊二醛交联形成的C=N振动吸收峰,这是因为,在脂肪酶交联制备过程中,戊二醛有2个醛基,它可以与脂肪酶的末端胺基反应,形成席夫碱键。通过以上吸收峰可判断,已成功地制备了CLEAs脂肪酶。而由图10c可知,572 cm-1处为二硫键S-S吸附带,这表明p-CLEAs脂肪酶已成功交联制备[8]。
利用软件Peakfit 4.2对游离脂肪酶及p-CLEAs所得红外光谱谱图进行分析,根据二阶导数结果选取红外光谱中各峰的峰位和峰宽,对红外光谱中的酰胺Ⅰ带(1 700~1 600 cm-1)进行基线校正,Gaussian去卷积,然后进行曲线拟合,通过各子峰的位置及峰面积计算出各种二级结构的相对百分含量。
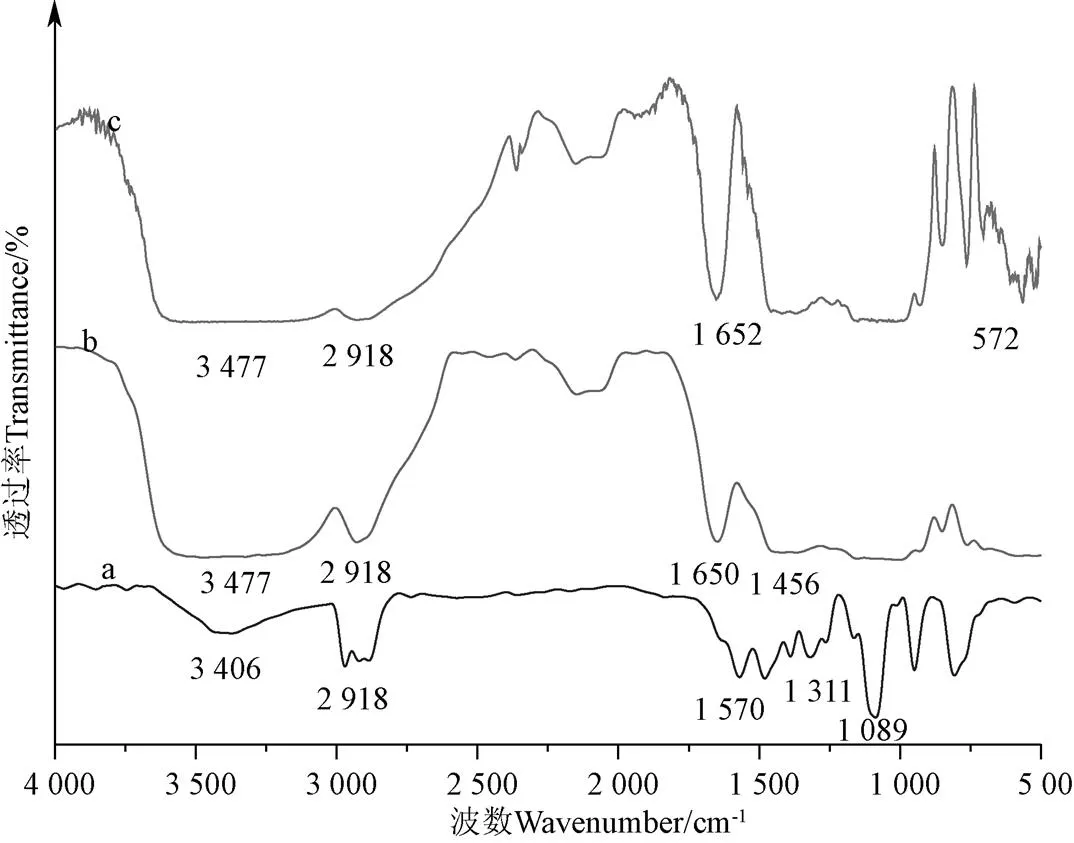
注:a为游离脂肪酶;b为CLEAs;c为p-CLEAs,下同。
从表1可以看出,经过交联酶聚集固定化后,-螺旋、-折叠、无规则卷曲分别减少−1.23%、−0.83%、−1.61%,整体变化不大,但-转角却增加了7.22%,发生较大变化。这表明,经过交联之后p-CLEAs的刚性有所增强,脂肪酶分子中残基柔性基本保持不变,这使得结构更加稳定,耐受性增强。

表1 p-CLEAs 二级结构变化 Table 1 Secondary structures changes of p-CLEAs
注:差值*= p-CLEAs –游离脂肪酶。
2.6 交联酶凝聚体的性能考察
2.6.1 不同固定化酶活对比
在上述最优条件下制备CLEAs和p-CLEAs,采用橄榄油乳化法进行酶活测定,对比分析游离脂肪酶、CLEAs和p-CLEAs的酶活,将游离脂肪酶初始酶活力定为100%,结果见图12。
从图12可以看出,固定化脂肪酶较游离脂肪酶活力有所降低的,这主要是因为在固定化过程中有所损失造成的。而p-CLEAs酶活比CLEAs的活性高,这是由于CLEAs没有一定的物理形态,颗粒会凝聚成致密的团块,大多数具有催化活性的酶分子被隐蔽于团块内部,进而影响其活性。而由于碳酸钙模板剂制备的p-CLEAs,内部具有规则蜂窝状通孔结构,孔径都在几微米以下,尺寸形貌均一、可控。因而,其具有很大的内表面积,可提高脂肪酶与底物接触的界面面积,且底物可很容易接近内p-CLEAs脂肪酶的活性位点,减小了内部扩散阻力,提高了催化效率。
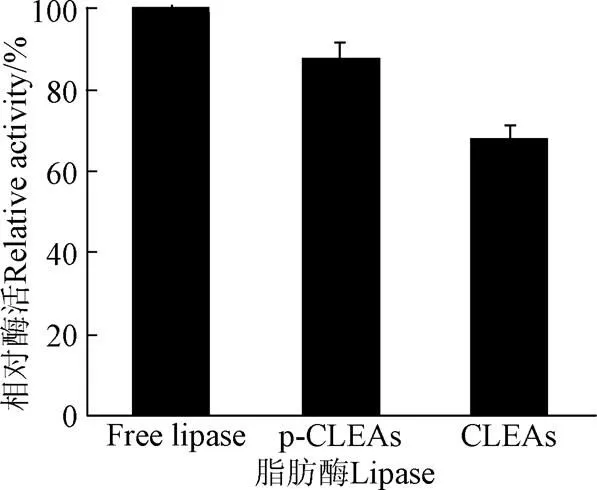
图12 不同固定化方式对酶活影响
2.6.2 最适温度
取1 g上述最优条件下制备的CLEAs和p-CLEAs,孵化于磷酸盐缓冲液(0.1 mol/L,pH=7.0)中,30~70 ℃恒温水浴中孵育脂肪酶样品30 min,每隔5 ℃测定固定化酶和游离酶的相对酶活力,以各自的初始酶活力定为100%。
从图13a中可以看出,随着温度的不断升高,游离酶、CLEAs和p-CLEAs酶活性都不断升高,最适温度都为45 ℃,但与游离脂肪酶相比,CLEAs和p-CLEAs最适温度范围比游离酶宽,在65 ℃孵育后,CLEAs和p-CLEAs脂肪酶的相对活性分别保留了63%和86%,而游离脂肪酶仅保留了33.67%的相对活性。这应该是脂肪酶的交联作用,改变了酶的空间构象,从游离状态变成了一种更加稳定的聚集状态。此外,进一步比较了CLEAs和p-CLEAs在70 ℃条件下的孵育结果,p-CLEAs的初始相对活性约为81%,而常规CLEAs的残留活性约为54%,明显低于p-CLEAs活性。究其原因,p-CLEAs热稳定性的提高可能是由于脂肪酶分子内分子间二硫键在脂肪酶分子内诱导形成分子间二硫键,酶分子二级结构刚性增强,导致脂肪酶分子间的共价交联更加稳定,这表明,在极端条件下,p-CLEAs高稳定性便于大规模工业应用。
2.6.3 最适pH值
在0.1 mol/L磷酸盐缓冲液中,45 ℃孵育5 h,在pH值5.5~9范围考察游离脂肪酶、CLEAs和p-CLEAs酶的相对酶活力,结果如图13b所示。
从图13b中可以看出,游离酶、CLEAs和p-CLEAs酶活性都随着pH值增大而增加,在pH值为7时游离酶、CLEAs的酶活性达到最大,在pH值为7~9之间,酶活性都表现出下降趋势,但CLEAs仍保持在90%以上,而游离脂肪酶,相对酶活在72%~89%之间,游离酶酶活性比CLEAs的酶活性下降迅速,这表明,经交联固定化后其最适pH值没有发生变,但最适pH值范围变宽,这和最适温度范围变宽的原因一样,都是因为交联固定化后处于一种更稳定的状态,对pH值的变化变得不敏感。p-CLEAs的pH值适用范围的增宽,使得酶在实际生产中将具有更广泛的应用范围。另外,与p-CLEAs相比,CLEAs最适pH值有所偏移变为8,这种变化可能是由于脂肪酶表面氨基酸基团与戊二醛交联,使得脂肪酶表面带有负电荷,最终使最适pH值发生了较大的变化。

注:各单因素试验固定因素值为:磷酸盐缓冲液0.1 mol·L-1,pH 值7.0,45℃,30 min。
2.6.4 贮存稳定性
将游离脂肪酶、CLEAs和p-CLEAs脂肪酶样品在4 ℃磷酸盐缓冲液(pH值为7)中孵育至180 d,每隔10天测定其酶活,评价其贮存稳定性。以各自的初始酶活力定为100%,结果如图13c所示。
由图13c可知,常规CLEAs和p-CLEAs脂肪酶的活性在0~60 d的贮藏期间没有明显的下降。但在相同的贮藏条件下,60 d后,游离脂肪酶活性显著下降,酶活性下降90%以上。因此,与游离脂肪酶相比,常规固定化CLEAs和p-CLEAs脂肪酶具有更好的贮藏稳定性。究其原因,CLEAs和p-CLEAs脂肪酶储存稳定性的提高可能是由于交联共价键的形成,导致酶更加稳定,限制了脂肪酶的运动。此外,进一步比较了传统CLEAs和p-CLEAs脂肪酶。在经过4 ℃,180 d贮藏后孵育,常规CLEAs残留活性约为10%,而p-CLEAs相对活性约为71%,明显高于常规CLEAs残留活性。另外,贮藏60 d后,p-CLEAs活性随贮藏时间略有增加,其p-CLEAs活性在贮藏80~100 d时最高。这种活性的增加可能是因为酶蛋白质分子间形成稳定的二硫键,使其不易生物降解。
2.6.5 甲醇对酶活性的影响
在酯化、酯交换中脂肪酶常受到有机溶剂的毒害作用,本文采用浓度为10%的甲醇磷酸缓冲液处理交联酶聚集体,研究交联酶聚集体对甲醇耐受性。从图13b可知,CLEAs和p-CLEAs对甲醇有较强的耐受性,经甲醇处理150 h后,CLEAs和p-CLEAs相对酶活力分别为83%和76%,而游离脂肪酶甲醇处理50 h后,活力仅剩余34%。这可能是由于经交联后形成超分子结构,减弱了甲醇对酶活性中心的影响,使得交联酶聚集体的酶活力相对较高。而游离的脂肪酶酶蛋白是完全暴露在环境中,直接与甲醇接触,酶的活性中心遭到破坏,因而酶活力损失较大。另外,于CLEAs相比,p-CLEAs的甲醇的耐受性也是有一定的降低,这可能是因为p-CLEAs具有丰富的孔道,甲酯与p-CLEAs作用面积更大,导致酶活力损失更快,但整体降低幅度较小。因此,p-CLEAs对甲醇耐受性拓展了脂肪酶在酯化、酯交换中的应用。
2.6.6 p-CLEAs交联酶的重复使用性能
固定化酶的主要优点是昂贵的酶可以重复利用。因此,有必要对p-CLEAs脂肪酶催化剂可重复使用性进行评价。本研究采用菜籽油和甲醇转酯化反应来评价p-CLEAs脂肪酶的催化活性。反应条件:菜籽油(10 g),油与甲醇摩尔比1:6,脂肪酶催化剂用量20%,含水率3%,温度45 ℃,反应时间24 h。每批反应后,离心回收固定化脂肪酶,然后加入一批新的菜籽油和甲醇到反应器中,进行下一批次反应,分析了各批次反应后油脂转化率。p-CLEAs脂肪酶重复利用变化如图14所示。

图14 常规CLEAs和p-CLEAs脂肪酶的重复利用
从图14可以看出,CLEAs和p-CLEAs脂肪酶在重复8次利用后,其催化反应活性均有所下降,但程度不同。p-CLEAs脂肪酶重复使用8次,FAME转化率仍保持在70%以上。与常规CLEAs相比,具有更好的重复利用性和稳定性。p-CLEAs脂肪酶活性的丧失可以从以下3方面来解释:1)在反应过程中,脂肪酶构象发生变化。为了验证这一现象,本研究对重复使用8次的p-CLEAs脂肪酶进行SEM分析。从图15可以看出,重复8次使用后的p-CLEAs脂肪酶,有部分p-CLEAs脂肪酶颗粒发生了破碎,且有一些孔隙结构发生塌陷,不再保持原来的多孔形态。p-CLEAs脂肪酶颗粒的破碎和塌缩使底物无法进入p-CLEAs脂肪酶的内部,降低了脂肪酶的催化反应性能。因此,在今后的工作中,有必要对提高p-CLEAs脂肪酶颗粒的结构稳定性进行更深入的研究。2)甲醇对p-CLEAs脂肪酶的毒害作用使其活性降低。3)反应产物吸附在p-CLEAs脂肪酶表面,从而限制底物与脂肪酶分子活性位点的接触。
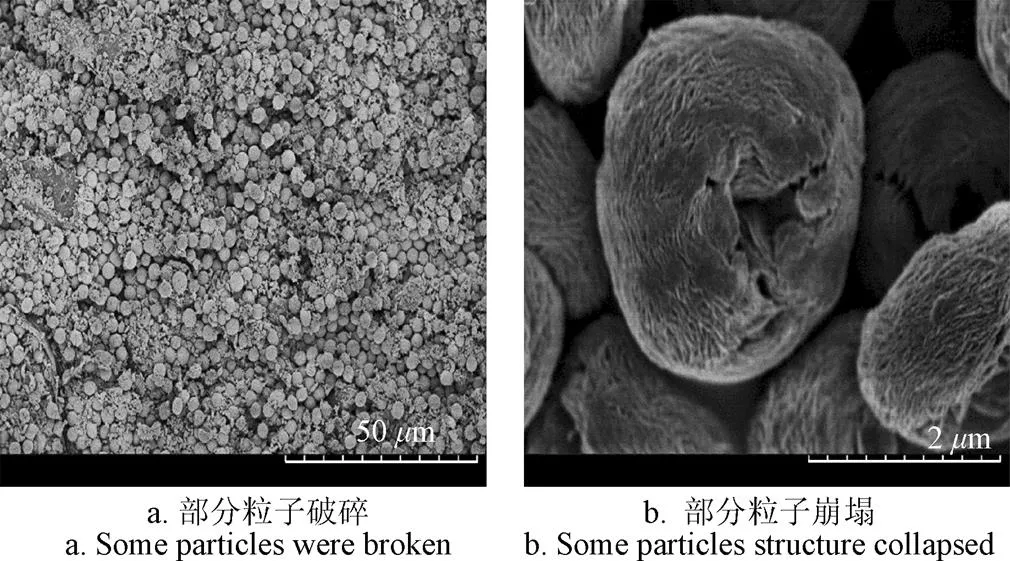
图15 SEM分析
3 结 论
本研究以CaCO3为模板共沉淀制得脂肪酶微球,然后通过DTT诱导脂肪酶分子“内部”二硫键交联成“分子间”二硫键,在用EDTA去除CaCO3模板,得到的多孔p-CLEAs,形态学表征结果表明,与常规CLEAs相比,具有形状规则、颗粒小、孔径大、空间位阻小、比表面积大的特点;其温度耐受性、稳定性、甲醇溶剂耐受性、贮存稳定性均有明显改善,因此,p-CLEAs脂肪酶在生物催化中具有更好的实用前景,其催化油脂转化,重复使用8次,转化率保持在70%左右。然而,p-CLEAs脂肪酶颗粒在重复利用过程中,颗粒容易破碎和坍塌,影响了实际应用效果。因此,在今后的工作中,有必要进一步研究p-CLEAs脂肪酶颗粒损耗的原因和改进措施。
[1]Bansode S R, Rathod V K. An Investigation of lipase catalysed sonochemical synthesis: A review[J]. Ultrasonics Sonochemistry, 2017, 38: 503-529.
[2]Miao C, Yang L, Wang Z, et al. Lipase immobilization on amino-silane modified superparamagnetic Fe3O4nanoparticles as biocatalyst for biodiesel production[J]. Fuel, 2018, 224: 774-782.
[3]Bonet-Ragel K, Canet A, Benaiges M D, et al. Synthesis of biodiesel from high FFA alperujo, oil catalysed by immobilised lipase[J]. Fuel, 2015, 161: 12-17.
[4]Bai F, Yan W, Zhang S, et al. Immobilized lipase of reconstructed oil bodies and its potential application in biodiesel production[J]. Fuel, 2014, 128(14): 340-346.
[5]Sirisha V L, Jain A, Jain A. Enzyme immobilization: an overview on methods, support material, and applications of immobilized enzymes[J]. Advances in Food & Nutrition Research, 2016, 79: 179.
[6]Rehman S, Bhatti H N, Bilal M, et al. Cross-linked enzyme aggregates (CLEAs) of Pencilluim notatum lipase enzyme with improved activity, stability and reusability characteristics[J]. International Journal of Biological Macromolecules, 2016, 91: 1161-1169.
[7]Velascolozano S, Lópezgallego F, Mateosdíaz J C, et al. Cross- linked enzyme aggregates (CLEA) in enzymeimprovement-a review[J]. Biocatalysis, 2016, 1(1): 166-177.
[8]Chen Z, Wang Y, Liu W, et al. A novel cross-linked enzyme aggregates (CLEAs) of papain and neutrase-production, partial characterization and application[J]. International Journal of Biological Macromolecules, 2016, 95: 650-657.
[9]Wang M, Jia C, Qi W, et al. Porous-CLEAs of papain: Application to enzymatic hydrolysis of macromolecules[J]. Bioresource Technology, 2011, 102(3): 3541-3545.
[10]Talekar S, Shah V, Patil S, et al. Porous cross linked enzyme aggregates (p-CLEAs) of saccharomyces cerevisiae invertase[J]. Catalysis Science & Technology, 2012, 2(8): 1575-1579.
[11]Kumar V V, Sivanesan S, Kumar P S, et al. Preparation and characterization of porous-CLEAs laccase: Robust biocatalysts for the decolorization of triphenyl methane and reactive dyes[J]. Bioresource Technology, 2012, 119(9): 28-34.
[12]Gilani S L, Najafpour G D, Moghadamnia A, et al. Stability of immobilized porcine pancreas lipase on mesoporous chitosan beads: A comparative study[J]. Journal of Molecular Catalysis B Enzymatic, 2016, 133: 144-153.
[13]Jiang Y, Sun W, Zhou L, et al. Improved Performance of Lipase Immobilized on Tannic Acid-Templated Mesoporous Silica Nanoparticles[J]. Applied Biochemistry & Biotechnology, 2016, 179(7): 1-15.
[14]Voběrková S, Solčány V, Vršanská M, et al. Immobilization of ligninolytic enzymes from white-rot fungi in cross-linked aggregates[J]. Chemosphere, 2018, 202: 694-707.
[15]Wilson L, Illanes, Andrés, Abián, Olga, et al. Co-aggregation of penicillin g acylase and polyionic polymers: an easy methodology to prepare enzyme biocatalysts stable in organic media[J]. Biomacromolecules, 2004, 5(3): 852-857.
[16]Sangeetha K, Abraham T E . Preparation and characterization of cross-linked enzyme aggregates (CLEA) of Subtilisin for controlled release applications[J]. International Journal of Biological Macromolecules, 2008, 43(3): 314-319.
[17]Lee J, Kim J, Kim J, et al. Simple Synthesis of Hierarchically Ordered Mesocellular Mesoporous Silica Materials Hosting Crosslinked Enzyme Aggregates[J]. Small, 2005, 1(7): 744-753.
[18]Wang M , Qi W , Yu Q , et al. Cross-linking enzyme aggregates in the macropores of silica gel: A practical and efficient method for enzyme stabilization[J]. Biochemical Engineering Journal, 2010, 52(2/3): 168-174.
[19]Kumar V V, Kumar M P P, Thiruvenkadaravi K V, et al. Preparation and characterization of porous cross linked laccase aggregates for the decolorization of triphenyl methane and reactive dyes[J]. Bioresource Technology, 2012, 119(9): 28.
[20]Cui J, Zhao Y, Tan Z, et al. Mesoporous phenylalanine ammonia lyase microspheres with improved stability through calcium carbonate templating[J]. International Journal of Biological Macromolecules, 2017, 98: 887-896.
[21]Schmidt S, Behra M, Uhlig K, et al. Mesoporous protein particles through colloidal CaCO3templates[J]. Advanced Functional Materials, 2013, 23(1): 116-123.
[22]Schmidt S, Volodkin D. Microparticulate biomolecules by mild CaCO3templating[J]. Journal of Materials Chemistry B, 2013, 1(9): 1210-1218.
[23]Talekar S, Joshi A, Joshi G, et al. Parameters in preparation and characterization of cross linked enzyme aggregates (CLEAs)[J]. Rsc Advances, 2013, 3(31): 12485-12511.
[24]Kushiro H, Takano K, Soyama H, et al. Determination of lipoprotein lipase activity[J]. Rinsho Byori the Japanese Journal of Clinical Pathology, 1971, 19(Supp.): 291.
[25]王文平,郭祀远,李琳,等. 考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J]. 食品研究与开发,2008,29(1):115-117.
Wang Wenping, Guo Siyuan, Li lin, et al.The determination of protein content in polysaccharides from stanuntonia chinensiswith coomassie brilliant blue method[J]. Food research and development, 2008, 29(1): 115-117. (in Chinese with English abstract)
[26]Volodkin D V, Larionova N I, Sukhorukov G B. Protein encapsulation via porous CaCO3microparticles templating[J]. Biomacromolecules, 2004, 5(5): 1962-1972.
[27]Balabushevich N G, Av L D G, Feoktistova N A, et al. Protein loading into porous CaCO3microspheres: adsorption equilibrium and bioactivity retention[J]. Physical Chemistry Chemical Physics, 2015, 17(4): 2523-2530.
[28]Schoevaart R, Wolbers M W, Golubovic M, et al. Preparation, optimization, and structures of cross-linked enzyme aggregates (CLEAs)[J]. Biotechnology and Bioengineering, 2004, 87(6): 754-762.
[29]Caballero Valdés E, Wilson Soto L, Aroca Arcaya G. Influence of the pH of glutaraldehyde and the use of dextran aldehyde on the preparation of cross-linked enzyme aggregates (CLEAs) of lipase from Burkholderia cepacia[J]. Electronic Journal of Biotechnology, 2011, 14(3): 4226-4233.
[30]Neves-Petersen M T, Snabe T, Klitgaard S, et al. Photonic activation of disulfide bridges achieves oriented protein immobilization on biosensor surfaces[J]. Protein Science, 2006, 15(2): 343-351.
Preparation and properties of porous crosslinked lipase polymeric by calcium carbonate template method
Miao Changlin, Lü Pengmei, Wang Zhongming, Li Huiwen※, Yang Lingmei, Luo Wen
(510640,)
In view of the problems such as compact surface, small specific surface area and lack of much pore structure of traditional cross-linked lipase aggregates (CLEAs), which further affects the catalytic efficiency of the enzyme in the catalytic process. To solve above problems, this study prepared porous-cross linked enzyme aggregates (p-CLEAs) were synthesized by in-situ co-precipitation method using CaCO3microparticles as templates. The preparation procedure involves crude lipase was immobilized as CLEAs via precipitation with ammonium sulfate and entrapping this lipase molecules into CaCO3templates, followed by DTT (dithiothreitol) induced assemble of lipase molecules to from lipase microparticles (Lipase molecules were assembled into a microparticle by the internal using disulfide bonds within lipase molecules as molecular linkers and stimulated by dithiothreitol) and finally the removal of CaCO3templates by EDTA to form pores in the CLEAs. The preparation conditions, structural characteristics and enzymatic properties were studied. The results showed that the best preparation conditions were: mass concentration of concentration of Ca2+0.35 mol/L, the ratio of lipase to Ca2+is 5:1, saturation of precipitator is 80%, precipitation pH value is 8, precipitation time is 40 min, DTT volume fraction is 0.2%, and crosslinking time is 40 min, Compared with conventional CLEAs, the prepared p-CLEAs presented a porous structure and showed significant improvement in methanol tolerance, thermal stability and pH value stability. It was preserved at 4 ℃ for 6 months and still maintained a high activity. This porous structure makes it easier for substrate molecules to enter the active site of lipase, which not only reduces the mass transfer limitation, but also improves the catalytic efficiency. Therefore, p-CLEAs lipase has a high catalytic activity.
catalyst; enzyme; cross linked enzyme aggregates; lipase; immobilization; CaCO3; porous
苗长林,吕鹏梅,王忠铭,李惠文,杨玲梅,罗 文. 模板法制备多孔交联脂肪酶聚集体碳酸钙及其特性[J]. 农业工程学报,2020,36(3):218-226.doi:10.11975/j.issn.1002-6819.2020.03.027 http://www.tcsae.org
Miao Changlin, Lü Pengmei, Wang Zhongming, Li Huiwen, Yang Lingmei, Luo Wen. Preparation and properties of porous crosslinked lipase polymeric by calcium carbonate template method[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(3): 218-226. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.03.027 http://www.tcsae.org
2019-09-25
2019-10-14
国家重点研发计划(2017YFD0601003);国家自然科学基金项目(21506217)
苗长林,副研究员,主要从事生物质生化转化研究。Email:miaocl@ms.giec.ac.cn
李惠文,高级工程师,主要从事生物质能源利用研究。Email:huiwl@ms.giec.ac.cn
10.11975/j.issn.1002-6819.2020.03.027
TE667
A
1002-6819(2020)-03-0218-09
