大气CO2浓度升高对小麦蒸腾耗水与根系吸水的影响
2020-04-09范金杰俞杨浏范豫川石建初
范金杰,俞杨浏,左 强,范豫川,吴 训,石建初
大气CO2浓度升高对小麦蒸腾耗水与根系吸水的影响
范金杰,俞杨浏,左 强,范豫川,吴 训,石建初※
(中国农业大学土地科学与技术学院,北京 100193)
为了探索大气CO2浓度升高对作物蒸腾耗水与根系吸水的影响,该文布置了春小麦室内水培试验,试验共设置3个CO2浓度梯度(400±50、625±50、850±50mol/mol),期间对各处理条件下小麦生长与蒸腾耗水的动态变化过程进行监测,包括水气交换、干物重、叶面积、根长、蒸腾速率等。试验结果表明:当CO2浓度从400mol/mol升高至625、850mol/mol时,短期(约3 d)内叶片气孔导度迅速降低,蒸腾耗水减弱,光合作用增强,导致水分利用效率升高;随着小麦被置于高CO2浓度条件下时间的延长,叶片气孔导度与蒸腾速率的降低幅度以及光合速率的增大幅度都逐渐缩小,即发生了CO2驯化现象。此时小麦生长仍然很旺盛,但蒸腾耗水并未发生显著变化,因此水分利用效率升高。CO2浓度升高可显著促进根系生长发育,导致单位根长潜在吸水系数显著降低(<0.05),但其与单位根长氮含量之间仍呈线性正相关关系(2=0.83)。研究结果可为改进根系吸水模型与作物生长模型提供参考依据,并有助于系统理解土壤-作物-大气连续体。
作物;蒸腾;光合;CO2浓度升高;根系吸水
0 引 言
中国水资源供需矛盾日益突出[1],尤其农业用水更是面临着越来越严峻的挑战[2]。另外,自工业革命以来,大气二氧化碳(CO2)浓度已从1750年的280mol/mol升高至2018年的400mol/mol[3],并且仍将继续保持加速攀升趋势,预计至21世纪末将达到530~970mol/mol[4]。大气CO2作为水气交换的物质基础,其浓度升高除了可以促进作物光合作用与生长外,势必会对作物蒸腾耗水产生较大影响[5-6]。在全球大气CO2浓度不断升高、水资源日益紧缺的大背景下,针对作物吸水、耗水规律开展一些前瞻性研究显得尤为重要。
叶片气孔是植物与外界进行水气交换的主要通道,其行为很容易受到环境CO2浓度的影响。当大气CO2浓度升高时,植物最先做出的自适应生理响应就是在一定程度上关闭气孔,使叶片气孔导度与单位叶面积蒸腾速率迅速下降[7-9]。伴随着单位叶面积光呼吸速率的降低以及核酮糖二磷酸羧化速率的升高,单位叶面积净光合速率(即固碳速率)升高[7-10]。研究表明,短期内(小于1周)CO2浓度升高1倍可分别降低气孔导度50%、单位叶面积蒸腾速率30%左右[9-11],同时可提高单位叶面积净光合速率65%左右[12]。CO2浓度升高对光合作用的刺激效应短期内很难使干物重与叶面积迅速增大,因此,单位叶面积蒸腾速率的降低势必会导致作物蒸腾耗水减弱。然而,随着CO2浓度升高的时间的不断延长,植物的这种自适应生理响应会随之发生变化,主要表现为叶片气孔导度与单位叶面积蒸腾速率的降低幅度以及单位叶面积光合速率的升高幅度都逐渐缩小甚至消失,即发生光合适应现象(photosynthetic acclimation)或CO2驯化现象(CO2acclimation)[11-13]。研究表明春小麦在高CO2浓度条件下15 d后就开始发生CO2驯化现象[14]。从长期效应来看,尽管与高CO2浓度相伴随的驯化过程会导致光合速率所受到的刺激效应逐渐减弱甚至消失,但CO2浓度升高确实会加速碳水化合物的形成与积累,即干物重与叶面积逐步增大,植物生长更为旺盛[10-11, 15-17],从而在一定程度上抵消气孔导度降低对蒸腾耗水所造成的影响[11, 18-19]。迄今为止,CO2浓度升高对植物蒸腾耗水长期影响的研究结果尚无统一结论。部分研究结果表明高CO2浓度条件下作物蒸腾耗水显著增大[19],但也有研究表明作物蒸腾耗水降低[5]或不发生显著变化[6, 20],这可能是特定条件下决定作物蒸腾的2个主要因素(即叶面积指数与单位叶面积蒸腾速率)受CO2浓度的影响程度不同所致。因此,有必要对高CO2浓度条件下作物蒸腾耗水的动态变化过程及其影响机理进行进一步探索与分析。
根系作为植物光合产物重要的库以及吸收水分的主要器官,当大气CO2浓度升高时,其生长分布及其吸水功能也同样会受到影响以适应作物需水耗水的变化。短期内,CO2浓度升高尚来不及对根系生长分布(比如根长)产生显著影响,但从长期效应来看,可促进根系生长[11-13, 20],导致根长与根干质量增大[21-22]。由于蒸腾速率的变化趋势尚不明朗,仍很难准确地描述根系吸水速率(单位时间内根系从单位土体中吸收水的体积)与吸水性能所受到的影响。小麦是中国乃至全球播种面积最大、分布最广、产量最高的主要粮食作物之一,并占有相当高的水资源消耗份额[23]。该研究拟选用小麦作为供试作物,进一步探索CO2浓度升高对根系生长与吸水性能及蒸腾耗水的影响。
1 材料与方法
1.1 试验设计
试验于2014年5—7月在中国农业科学院农业环境与可持续发展研究所人工气候模拟实验室中进行。播种前用0.83 mol/L的过氧化氢(H2O2)溶液对小麦种子(云麦42)进行30 min表面消毒,用去离子水冲洗3遍后在饱和硫酸钙(CaSO4)溶液中浸泡4 h,再将种子转移到浸透过饱和硫酸钙溶液的纱布上并放置在25 ℃的黑暗培养箱中催芽,48 h后(2014年5月24日)将种子从培养箱中取出并种植在石英砂中,浇灌半浓度Hoagland营养液[24-25](即标准营养液)以保证供应充足的水分与养分,营养液配方如表1所示。

表1 营养液配方
2014年6月6日20:00,将生长在石英砂中的小麦移植到9个装有标准营养液、上覆塑料盖板的培养皿(直径25.5 cm,高10 cm)中,盖板上均匀分布10个内径2 cm的圆孔,每个孔中放置1株小麦,由海绵包扎固定,保持根系浸没在营养液之中(图1)。2014年6月21日8:00将培养皿分为3组(每组3个),分别放置在CO2浓度设定为(400±50)、(625±50)、(850±50)mol/mol的人工气候室中。因室内生长条件所限,本文只选取在小麦生长较为旺盛的阶段(分蘖期和拔节期)予以研究。试验共持续了69 d,至2014年7月31日结束。试验期间,采用抽气机24 h不间断地向营养液中输入空气。为保证各营养元素的持续稳定供应,营养液每2 d补加1次、每4 d更换一次。人工气候室内小麦的生长条件统一设置为:日光照时间10 h(8:00~18:00),冠层顶部有效光强400mol/(m2·s),日/夜温度(30/20±2)℃,相对湿度(40±5)%。

图1 培养皿中小麦种植示意图
1.2 取样与测定
初始取样时间为2014年6月21日,即播种后第29 d(29 days after planting (DAP)),此后每隔8 d取样1次,试验期内共取样6次。每次从各培养皿中随机选择1株小麦,在10:00~12:00之间测定最新完全展开叶的光合速率、气孔导度、蒸腾速率等指标(美国,LI-COR,LI-6400XT)。苗期小麦叶片较小,当叶片未能充满叶室时,待测量完成后将处于叶室内的叶片扫描(德国,AGFA,SNAPSCAN 1236)以获取其实际面积,最终根据实际面积转换获得各项指标。采集地上部和根系并分别扫描,然后用根系分析软件(加拿大,Regent Instruments Inc,WinRHIZO)获取叶面积、根长。在75 ℃条件下烘48 h后称取地上部与根干质量,经球磨仪粉碎后,再利用元素分析仪(意大利,Carlo Erba,CHNSO EA1108)分别测量其含氮量。
每天20:00采用电子天平(德国,Sartorius,LA64001S)定时称量各处理条件下的培养皿,以获取相应的日蒸散量。尽管培养皿盖板上的小孔均塞有海绵,但仍存在少量的水面蒸发损失。为了估计蒸发损失水量,针对各处理条件平行布置一个没有种植小麦的培养皿(除无小麦外其他条件与对应处理保持一致),每天20:00定时称质量以获取日蒸发量。将上述日蒸散量与日蒸发量之差近似为相应处理条件下小麦的日蒸腾量。
1.3 平均单位叶面积蒸腾速率评估
假设小麦所有叶片的蒸腾速率一致,可根据单株小麦的日蒸腾量与叶面积计算获得:
T=V/A(1)
式中T为平均单位叶面积蒸腾速率,cm3/(cm2·d);V为单株小麦的日蒸腾量,cm3/d;A为单株小麦叶面积,cm2。
1.4 根系吸水性能评估
假定最优水分条件下根系吸水速率与根长密度成线性正比[26-27],则根系吸水性能可采用单位根长潜在吸水系数即最优水分条件下单位长度根系在单位时间内吸收水的体积予以评估[28-29]:
c=V/L(2)
式中c为单位根长潜在根系吸水系数,cm3/(m·d);L为单株小麦总根长,m。
1.5 水分利用效率评估
以叶片尺度及单株尺度分别探索CO2浓度升高对小麦水分利用效率的影响[30],估算如下:
WUE=P/T(3)
WUE=/(4)
式中WUE为单位叶片水分利用效率,mol/mmol;WUE为单株小麦水分利用效率,g/L;P为最新完全展开叶的单位叶面积净光合速率,mol/(m2·s);T为最新完全展开叶的单位叶面积蒸腾速率,mmol/(m2·s);为2次取样之间单株小麦干物质量增加量,g;为2次取样期间累积蒸腾耗水量,L。
1.6 数据处理方法
采用统计分析软件(美国,International Business Machines Corporation,SPSS 22.0)对所获得的试验数据进行方差分析(单因素对比分析最小显著性差异法,置信水平设为0.05),并采用制图软件(美国,Systat Software,Sigmaplot 12.5)绘图。
2 结果与讨论
2.1 CO2浓度升高对小麦叶片水气交换的影响
各CO2浓度处理条件下,小麦最新完全展开叶的单位叶面积光合速率、气孔导度和蒸腾速率的动态变化情况如图2所示。试验期内,小麦最新完全展开叶的单位叶面积净光合速率随外界CO2浓度的升高而升高(图2a)。当CO2浓度从400mol/mol升高至625mol/mol时,试验期内叶片光合速率平均升高32%,当CO2浓度从625mol/mol升高至850mol/mol时,光合速率仅平均升高12%。然而,CO2浓度升高对小麦光合的促进作用随着被置于高CO2浓度条件下时间的延长而逐渐减弱,即发生了CO2驯化现象。相对于CO2浓度为400mol/mol,浓度升高为625850mol/mol的第一天(29 DAP),小麦最新完全展开叶的光合速率分别升高了60%和65%,之后升高幅度总体呈下降趋势,直到40 d后(69 DAP),光合速率升高幅度分别降为31%和35%(图3a)。
当CO2浓度从400mol/mol升高至625850mol/mol时,叶片气孔导度(图2b)和蒸腾速率(图2c)均降低,表明叶片气孔在一定程度上处于关闭状态。CO2浓度从400mol/mol升至625mol/mol,试验期内最新完全展开叶的平均气孔导度和蒸腾速率分别降低16%与18%;CO2浓度从625mol/mol升高至850mol/mol,平均气孔导度和蒸腾速率分别降低11%与9%(图2b,2c)。与光合作用一样,气孔导度与蒸腾也同样发生了CO2驯化现象(图3b,3c):相对于400mol/mol,在CO2浓度升高为625和850mol/mol的第1天,气孔导度分别下降19%和38%,蒸腾速率分别下降23%和32%;但40 d后,气孔导度仅分别下降9%和13%,蒸腾速率仅分别下降9%和11%。从图3可以看出,相对于CO2浓度为400mol/mol,虽然高浓度条件下上述3个水气交换参数的变化幅度在试验期内总体都呈缩小趋势,但在个别取样期仍存在较大波动,这可能是样本(如小麦个体、最新完全展开叶或测定部位等)差异所致。

注:不同字母表示同一生育时期不同 CO2浓度下的各指标差异显著(P<0.05),下同。
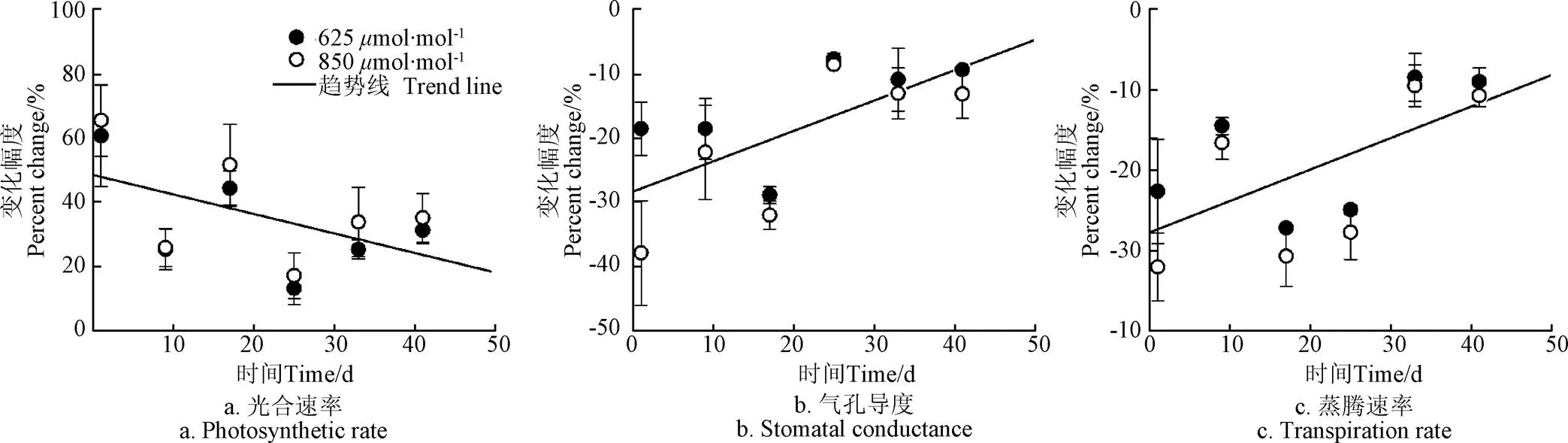
图3 高CO2浓度(625、850 µmol·mol-1)条件下小麦最新完全展开叶的单位叶面积光合速率、气孔导度和蒸腾速率的变化幅度(相对于400 µmol·mol-1)随时间的变化情况
已有大量研究表明,当CO2浓度升高时,叶片净光合速率升高(图2a),从而促进作物生长,但由于根系吸氮量小于干物质积累对氮素的需求量致使地上部氮浓度(单位干物重中所含有的氮的质量)逐渐下降(图4),其直接或间接作用于Rubisco光合酶(核酮糖-1,5-二磷酸羧化酶/加氧酶),导致光合酶含量或者活性降低[7-9],从而发生CO2驯化现象(图3a)。本研究中供试小麦生长在半浓度Hoagland营养液之中,为保证氮素供应充足,营养液每2 d补充1次、每4 d更换1次。因此,不同CO2浓度处理之间地上部氮浓度差异并不显著(相对于CO2浓度为400mol/mol,625和850mol/mol条件下小麦地上部氮浓度降低幅度小于8%),但仍导致了CO2驯化现象的发生。
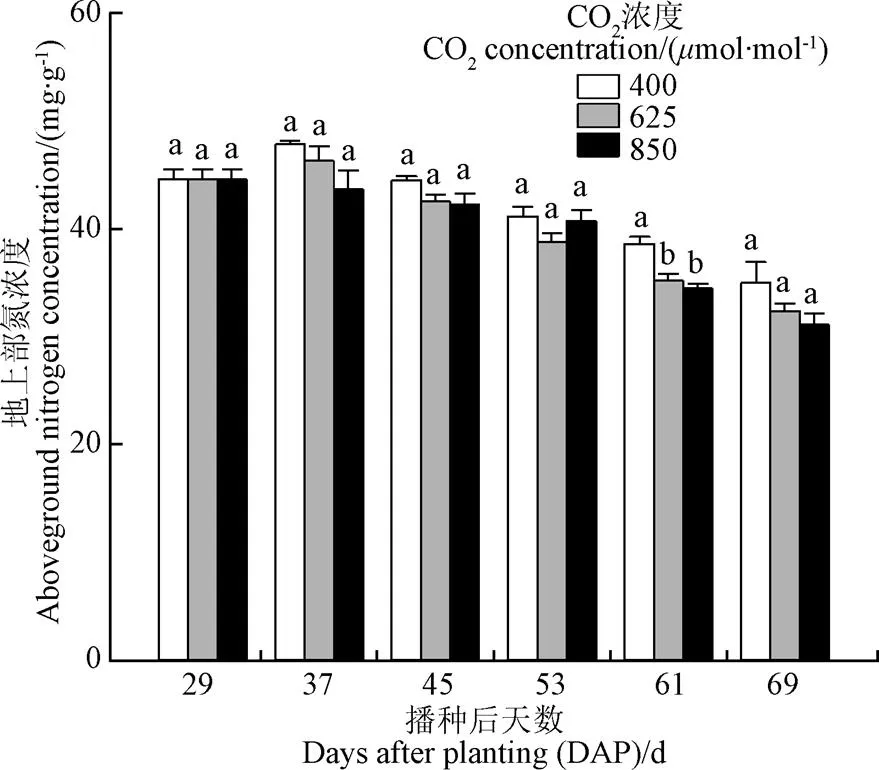
图4 3种CO2浓度条件下单株小麦地上部氮浓度的动态变化
2.2 CO2浓度升高对小麦蒸腾耗水与水分利用效率的影响
各CO2浓度处理期间(29~69 DAP),单株小麦日蒸腾耗水量的变化趋势如图5所示。如前所述,CO2浓度升高迅速导致单位叶面积净光合速率增大、气孔导度降低、蒸腾速率下降(图2),但由于短期(比如29~31 DAP)内小麦叶面积尚来不及发生适应性改变[12,15],因此其日蒸腾量显著下降(图5)。相对于CO2浓度为400mol/mol,当CO2浓度升高为625850mol/mol时,29~31 DAP期间平均日蒸腾量分别下降14%和24%。随着小麦被置于高CO2浓度条件下时间的延长,即使单位叶面积净光合速率增大幅度有所下降(发生CO2驯化现象),但小麦生长仍然很旺盛,表现为叶片扩张、叶面积增大(图6a):将CO2浓度从400mol/mol提高至625和850mol/mol 8 d(37 DAP)后,小麦叶面积分别增大33%和47%,随后叶片生长所受到的刺激效应逐渐减弱,40 d 后(69 DAP)叶面积增大比例分别降至15%和28%,期间平均增幅分别为22%和36%。各处理条件下平均单位叶面积蒸腾速率的变化趋势如图6b所示:随着小麦生长,叶面积不断增大,平均单位叶面积蒸腾速率在各处理条件下都逐渐降低;与最新完全展开叶的单位叶面积蒸腾速率一样,CO2浓度升高导致小麦平均单位叶面积蒸腾速率降低,且降低幅度也会随着时间的延长而逐渐减弱甚至消失。相对于400mol/mol,在CO2浓度升高为625850mol/mol的第1天(29 DAP),叶片气孔在一定程度上关闭,导致平均单位叶面积蒸腾速率下降约20%,随后,由于高CO2浓度条件下气孔导度降低幅度逐渐减小,平均单位叶面积蒸腾速率的降低幅度也逐渐缩小,在40 d(69 DAP)时仅下降约8%。因此,在本试验研究条件下,CO2浓度升高所导致的一定程度上的气孔关闭对小麦日蒸腾量的抑制效应几乎与叶面积增大所带来的逆向影响相互抵消,导致日蒸腾量并没有发生显著变化(>0.05):相对于CO2浓度为400mol/mol,625和850mol/mol条件下单株小麦的平均日蒸腾量仅降低了3%和4%(图5)。由于试验是在人工气候室内开展的,除了CO2浓度外其他条件均保持一致,所以本文仅考虑了作物本身对蒸腾耗水的影响。对于其他相关研究,高CO2浓度条件下蒸腾速率无论增大[19]、降低[5]、还是不变[6, 20],都是特定作物、气候、环境条件下气孔开闭程度与叶片扩张逆向影响之间相互平衡与抵消后的结果,需根据实际情况进行具体分析。高CO2浓度条件下,当叶片气孔导度降低对蒸腾耗水的抑制作用占优时,蒸腾速率下降;当叶片扩张对蒸腾耗水的促进作用占优时,蒸腾速率增大;当两者处于相对平衡状态时,蒸腾速率几乎不受影响。

图5 3种CO2浓度条件下单株小麦日蒸腾量(VTP)的动态变化

图6 3种CO2浓度条件下单株小麦叶面积、平均单位叶面积的蒸腾速率的动态变化
从叶片尺度来看,CO2浓度升高可提高光合速率并降低蒸腾速率,从而显著提高水分利用效率(WUE)(图7a):在CO2浓度为625850mol/mol处理条件下,小麦最新完全展开叶的平均水分利用效率相对于400mol/mol处理分别提高了64%与99%,与已获得的有关冬小麦和大豆的研究结果(提高50%~100%)一致[22-23]。对于单株整体而言,结果如图7b:CO2浓度升高,短期内小麦日蒸腾量明显减少,尽管干物质尚来不及迅速增加,仍导致水分利用效率显著升高;随后,即使日蒸腾量不再显著降低,但干物质的快速积累仍可提高小麦的水分利用效率。当CO2浓度从400mol/mol升高至625和850mol/mol时,期内单株小麦平均水分利用效率(WUE)分别提高了59%与89%。对比图7a与7b发现,单株小麦的水分利用效率明显低于同期最新完全展开叶的水分利用效率,这是由于最新完全展开叶具有较强光合作用且位于冠层顶部所致[19]。

图7 3种CO2浓度条件下小麦叶片水分利用效率和单株水分利用效率的动态变化
2.3 CO2浓度升高对小麦根系吸水性能的影响
随着外界CO2浓度的升高,净光合速率的提高使得作物体内的碳水化合物增多。作为重要的光合产物库,根系内碳水化合物的增加必定会调节细胞分裂和伸长,导致根系增长[21-22]。CO2浓度处理期间(29~69 DAP),单株小麦根长的变化趋势如图8a所示:在CO2浓度从400mol/mol升高至625850mol/mol的第1天(29 DAP),根长没有发生显著变化;但在第8天(37 DAP),在CO2浓度为625850mol/mol条件下,根系分别增长了66%和202%,之后增长幅度呈下降趋势,40 d之后(69 DAP)增长幅度分别降为25%与33%。CO2浓度升高对根系形态的影响必将进一步影响根系的吸水性能。在CO2浓度升高的第1天(29 DAP),小麦根系生长尚来不及发生适应性改变(图8a),高CO2浓度条件下蒸腾耗水(即根系吸水)所受到的抑制作用(图5)使得CO2浓度为625和850mol/mol条件下的单位根长潜在吸水系数分别下降13%和31%(图8b)。随后,CO2浓度升高显著促进根系生长(图8a),此时蒸腾耗水所受影响较小(图5),单位根长潜在吸水系数下降,但下降幅度从37 DAP的48%和73%分别降至69 DAP的21%和24%(图8b)。
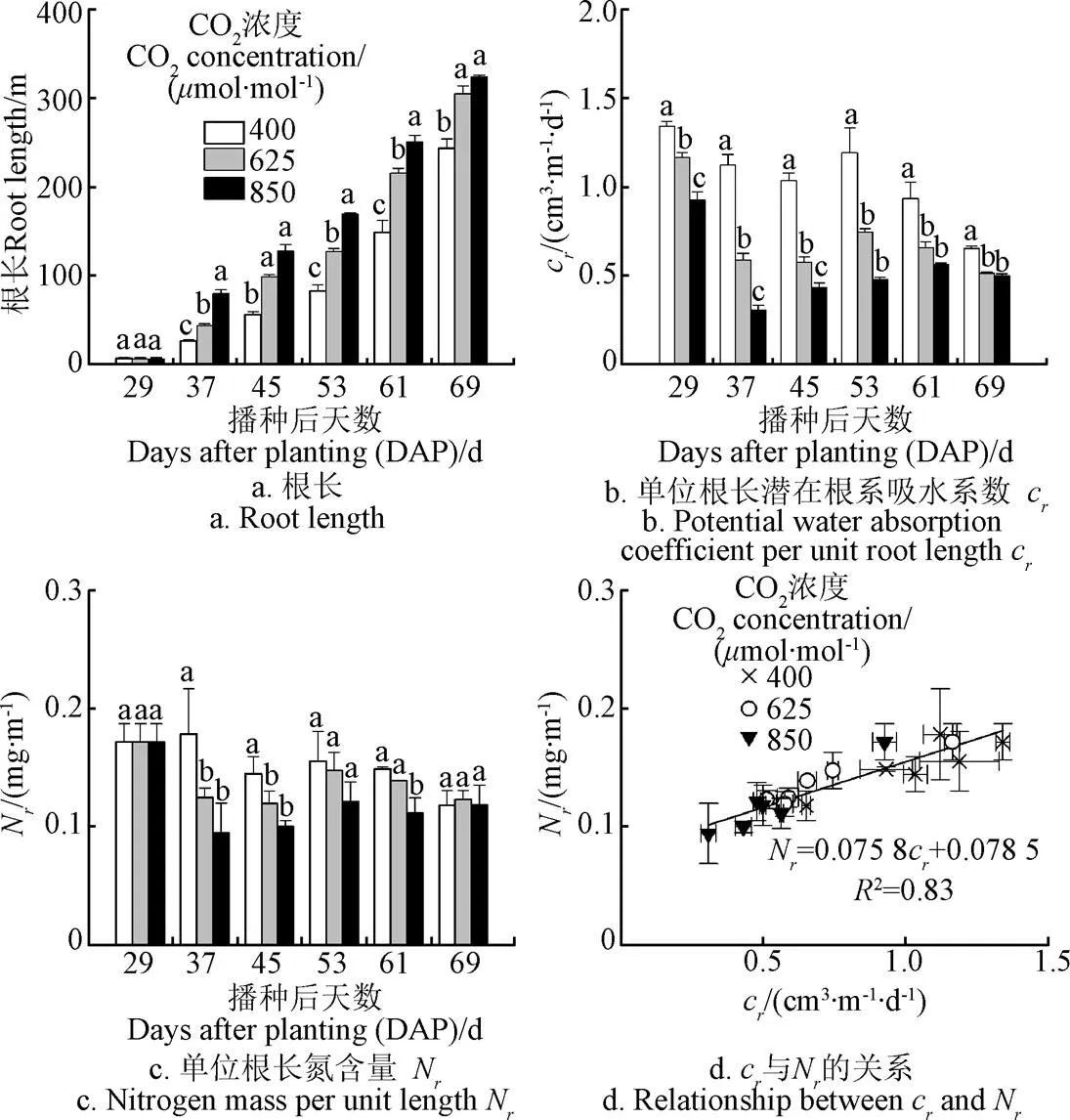
图8 3种CO2浓度条件下单株小麦根长、单位根长潜在吸水系数和单位根长氮含量的动态变化及cr与Nr的关系
从图8b可以看出,无论是在400mol/mol还是在更高的CO2浓度条件下,单位根长潜在吸水系数都随着作物的生长(即根龄增大)而逐渐降低,这是因为根区内并不是所有的根或根的所有部位都具有吸水功能,根与根之间以及根的各个部位之间在吸水性能方面存在显著差异。随着植物生长,根系逐渐老化,根系内蛋白质、激素以及酶等对根系吸水功能具有重要影响的氮化物的含量呈降低趋势(图8c),因而根系吸水能力不断减弱甚至完全丧失[30-32]。相关研究结果表明,在大气CO2浓度约为400mol/mol的条件下,小麦根系吸水能力与根系中的氮含量密切相关[28-29, 33]。对比图8b与图8c发现,各处理条件下单位根长氮含量与单位根长潜在吸水系数的变化规律非常相似,且两者之间的线性正相关关系不受根龄的影响,也不受大气CO2浓度的影响,呈一致规律(图8d,2=0.83)。
3 结 论
1)在本文所设置的试验条件下,大气CO2浓度的升高导致小麦发生了CO2驯化现象,光合速率、气孔导度以及蒸腾速率的变化幅度都随着时间的延长而逐渐降低甚至消失。
2)无论叶片尺度还是单株尺度,大气CO2浓度的升高都会影响蒸腾耗水与水分利用。短期内气孔导度降低,降低蒸腾耗水并提高水分利用效率。从长期效应来看,蒸腾耗水所受到的影响是特定情形下气孔导度降低所带来的限制作用与作物生长所受到的促进作用(叶面积增大)相互抵消与平衡的结果。无论蒸腾耗水增大、降低或不变,大气CO2浓度的升高都会提高水分利用效率。
3)大气CO2浓度升高因限制蒸腾耗水并促进根系生长,导致单位根长潜在吸水系数显著降低,但各种CO2浓度条件下单位根长潜在吸水系数都与单位根长氮含量的变化趋势一致且两者呈显著线性正相关关系。
4)大气CO2浓度升高对作物蒸腾耗水、根系吸水性能以及水分利用效率的影响程度与气孔导度、叶面积、根长以及被置于高CO2浓度条件下的时长有关,需根据特定条件进行具体分析。
上述相关研究结果是在室内试验条件下获得的,仍有待在田间试验条件下进一步验证。
[1]孙景生,康绍忠. 我国水资源利用现状与节水灌溉发展对策[J]. 农业工程学报,2000,16(2):1-5.
Sun Jingsheng, Kang Shaozhong. Present situation of water resources usage and developing countermeasures of water-saving irrigation in China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2000, 16(2): 1-5. (in Chinese with English abstract)
[2]李英能. 水土资源评价与节水灌溉规划[M]. 北京:中国水利水电出版社,1998.
[3]James H B, Stephen A M. The noaa annual greenhouse gas index (AGGI) [EB/OL]. [2019-07-01]. https://www.esrl.noaa.gov/ gmd/aggi/aggi.html.
[4]Solomon S E. The physical science basis: contribution of working group I to the fourth assessment report of the intergovernmental panel on climate change[J]. Intergovernmental Panel on Climate Change Climate Change. 2007, 996(2): 95-123.
[5]Hunsaker D J, Kimball B A, Pinter P J, et al. CO2enrichment and soil nitrogen effects on wheat evapotranspiration and water use efficiency[J]. Agricultural & Forest Meteorology, 2000, 104(2): 85-105.
[6]Shimono H, Nakamura H, Hasegawa T, et al. Lower responsiveness of canopy evapotranspiration rate than of leaf stomatal conductance to open-air CO2elevation in rice[J]. Global Change Biology, 2013, 19(8): 2444-2453.
[7]Long S P, Ainsworth E A, Rogers A, et al. Rising atmospheric carbon dioxide: plants face the future[J]. Annual Review of Plant Biology, 2004, 55(1): 591-628.
[8]Stitt M, Krapp A. The interaction between elevated carbon dioxide and nitrogen nutrition: the physiological and molecular background[J]. Plant Cell & Environment, 2010, 22(6): 583-621.
[9]Ainsworth E A, Rogers A. The response of photosynthesis and stomatal conductance to rising [CO2]: mechanisms and environmental interactions[J]. Plant Cell & Environment, 2007, 30(3): 258-270.
[10]Baker J, Allen L H, Boote K, et al. Rice responses to drought under carbon dioxide enrichment 2. Photosynthesis and evapotranspiration[J]. Global Change Biology, 2010, 3(2): 129-138.
[11]Shimono H, Bunce J A. Acclimation of nitrogen uptake capacity of rice to elevated atmospheric CO2concentration[J]. Annals of Botany, 2008, 103(1): 87-94.
[12]Pozo A D, Pérez P, Morcuende R, et al. Acclimatory responses of stomatal conductance and photosynthesis to elevated CO2and temperature in wheat crops grown at varying levels of N supply in a Mediterranean environment[J]. Plant Science, 2005, 169(5): 908-916.
[13]Bunce J A. Direct and acclimatory responses of stomatal conductance to elevated carbon dioxide in four herbaceous crop species in the field[J]. Global Change Biology, 2010, 7(3): 323-331.
[14]Pozo A D, Pérez P, Morcuende R, et al. Acclimation of photosynthesis and stomatal conductance to elevated CO2in canopy leaves of wheat at two nitrogen supplies[J]. Developments in Plant Breeding, 2007, 12: 611-616.
[15]李伏生,康绍忠,张富仓. CO2浓度升高、氮与土壤水分对春小麦生长及干物质积累的效应[J]. 中国生态农业学报,2003,11(2):37-40.
Li Fusheng, Kang Shaozhong, Zhang Fucang. Effects of CO2enrichment, nitrogen and soil moisture on growth and dry matter accumulation of spring wheat[J]. Chinese Journal of Eco-Agriculture, 2003, 11(2): 37-40. (in Chinese with English abstract)
[16]Asseng S, Jamieson P D, Kimball B, et al. Simulated wheat growth affected by rising temperature, increased water deficit and elevated atmospheric CO2[J]. Field Crops Research, 2004, 85(2): 85-102.
[17]Weigel H J, Manderscheid R. Crop growth responses to free air CO2enrichment and nitrogen fertilization: rotating barley, ryegrass, sugar beet and wheat[J]. European Journal of Agronomy, 2012, 43: 97-107.
[18]Kim H Y, Lieffering M, Kobayashi K, et al. Seasonal changes in the effects of elevated CO2on rice at three levels of nitrogen supply: A free air CO2enrichment (FACE) experiment[J]. Global Change Biology, 2010, 9(6): 826-837.
[19]李伏生,康绍忠,张富仓. CO2浓度、氮和水分对春小麦光合、蒸散及水分利用效率的影响[J]. 应用生态学报,2003,14(3):387-393.
Li Fusheng, Kang Shaozhong, Zhang Fucang. Effects of CO2enrichment, nitrogen and water on photosynthesis, evapotranspiration and water use efficiency of spring wheat[J]. Chinese Journal of Applied Ecology, 2003, 14(3): 387-393. (in Chinese with English abstract)
[20]Qiao Y, Zhang H, Dong B, et al. Effects of elevated CO2concentration on growth and water use efficiency of winter wheat under two soil water regimes[J]. Agricultural Water Management, 2010, 97(11): 1742-1748.
[21]Chaudhuri U N, Kirkham M B, Kanemasu E T. Root growth of winter wheat under elevated carbon dioxide and drought[J]. Crop Science, 1990, 30(4): 853-857.
[22]Rogers H H, Peterson C M, Mccrimmon J N, et al. Response of plant roots to elevated atmospheric carbon dioxide[J]. Plant Cell & Environment, 1992, 15(6): 749-752.
[23]Slafer GA, Satorre EH. An introduction to the physiological- ecological analysis of wheat yield. In: Satorre EH, Slafer GA (eds.), Wheat Ecology and Physiology of Yield Determination[M]. New York: Food Products Press, 2000,.
[24]Shangguan Z P, Shao M A, Dyckmans J. Nitrogen nutrition and water stress effects on leaf photosynthetic gas exchange and water use efficiency in winter wheat[J]. Environmental and Experimental Botany, 2000, 44(2): 141-149.
[25]Watkin E L J, Thomson C J, Greenway H. Root development and aerenchyma formation in two wheat cultivars and one triticale cultivar grown in stagnant agar and aerated nutrient solution[J]. Annals of Botany, 1998, 81(2): 349-354.
[26]Feddes R A. Simulation of field water use and crop yield[J]. Soil Science, 1978, 129(3): 193-209.
[27]Prasad R. A linear root water uptake model[J]. Journal of Hydrology,1988, 99(3): 297-306.
[28]Shi J, Zuo Q. Root-water-uptake and root nitrogen mass of winter wheat and their simulations[J]. Soil Science Society of America Journal,2009, 73(6): 1764-1774.
[29]石建初,左强. 不同灌溉处理条件下苗期冬小麦土柱中的硝态氮运移模拟[J]. 灌溉排水学报,2009,28(5):1-6.
Shi Jianchu, Zuo Qiang. Simulation soil nitrate transport in soil columns with winter wheat seedlings growth under different irrigation treatments[J]. Journal of Irrigation and Drainage, 2009, 28(5): 1-6. (in Chinese with English abstract)
[30]Meise P, Seddig S, Uptmoor R, et al. Impact of nitrogen supply on leaf water relations and physiological traits in a set of potato (L.) cultivars under drought stress[J]. Journal of Agronomy and Crop Science, 2018, 204(4): 359-374.
[31]Cohen I, Rapaport T, Berger R T, et al. The effects of elevated CO2and nitrogen nutrition on root dynamics[J]. Plant Science, 2018, 272: 294-300.
[32]Gebauer T, Bassirirad H. Effects of high atmospheric CO2concentration on root hydraulic conductivity of conifers depend on species identity and inorganic nitrogen source[J]. Environmental Pollution, 2011, 159(12): 3455-3461.
[33]Wang L, Shi J, Zuo Q, et al. Optimizing parameters of salinity stress reduction function using the relationship between root-water-uptake and root nitrogen mass of winter wheat[J]. Agricultural Water Management, 2012, 104(1): 142-152.
Effects of elevated CO2concentration on transpiration and root-water-uptake of wheat
Fan Jinjie, Yu Yangliu, Zuo Qiang, Fan Yuchuan, Wu Xun, Shi Jianchu※
(,100193,)
Since global atmospheric CO2concentration is increasing and the gap between water supply and demand is becoming more and more prominent, it is very important to explore the effects of elevated CO2concentration on water absorption and utilization of crops for meeting climate change. In this study, the effects of elevated CO2concentration on transpiration and root-water-uptake of wheat were investigated by setting an indoor hydroponic experiment, where wheat seedlings were cultured in half-strength Hoagland nutrient solution and under three CO2concentrations ((400±50), (625±50), (850±50)mol/mol). During the experimental period, the dynamics of leaf stomata conductance, transpiration rate, photosynthesis rate, leaf area, biomass, root length was monitored every 8 days, and plant transpiration was measured daily by weighing the culture pots. Based on the measured data, plant growth, water uptake and consumption, water use efficiency and the capacity of root water uptake were evaluated under each CO2concentration condition. The experiment results indicate that, with increasing CO2concentration (from 400 to 625, 850mol/mol), leaf stomata are partially closed, transpiration rates at both leaf and canopy scales are significantly limited during a short period (about 3 days), and photosynthesis rate is significantly enhanced, resulting in a significant increase in water use efficiency (<0.05). Compared to the CO2concentration of 400mol/mol, the plant transpiration averaged during this short period reduced by 14% and 24% under the CO2concentration treatment of 625 and 850mol/mol, respectively. With the prolonging of time under elevated CO2condition, the effects on leaf stomata conductance, transpiration and photosynthesis are weakened, namely CO2acclimation, but wheat growth is still significantly promoted. During this period, the positive effect of increased leaf area is almost offset by the reverse effect of stomatal closure, and thus plant transpiration was not impacted significantly, resulting in higher water use efficiency. Compared to the CO2concentration of 400mol/mol, plant transpiration averaged during this long period decreased by only 3% and 4%, while plant water use efficiency increased by 59% and 89% under 625 and 850mol/mol, respectively. Under the situation of elevated CO2concentration, the limitation of transpiration and the promotion of root growth lead to a significant decrease in root-water-uptake function evaluated on root length (the potential water uptake coefficient per unit root length). Compared to the CO2concentration of 400mol/mol, the potential water uptake coefficient per unit root length decreased by average 13% and 31% under 625 and 850mol/mol, respectively. Under all the CO2conditions, the change trends of the potential water absorption coefficient per unit root length and the nitrogen content per unit root length are very similar, and a linear function between them is found. The results supply evidences to improve root-water-uptake and crop growth models and further understand soil-plant-atmosphere continuum (SPAC), then, to help us to deal with climate change and improve water use efficiency.
crop; photosynthetic rate; transpiration;elevated CO2concentration; root-water-uptake
范金杰,俞杨浏,左 强,范豫川,吴 训,石建初. 大气CO2浓度升高对小麦蒸腾耗水与根系吸水的影响[J]. 农业工程学报,2020,36(3):92-98.doi:10.11975/j.issn.1002-6819.2020.03.012 http://www.tcsae.org
Fan Jinjie, Yu Yangliu, Zuo Qiang, Fan Yuchuan, Wu Xun, Shi Jianchu. Effects of elevated CO2concentration on transpiration and root-water-uptake of wheat[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(3): 92-98. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.03.012 http://www.tcsae.org
2019-08-22
2020-01-12
国家自然科学基金(51579241)
范金杰,博士生,主要从事CO2浓度升高对小麦生长影响研究。Email:jinjiefan@cau.edu.cn
石建初,副教授,主要从事土壤物理与节水农业机理研究。Email:shijianchu@cau.edu.cn
10.11975/j.issn.1002-6819.2020.03.012
S275; S28
A
1002-6819(2020)-03-0092-07
