间歇性低氧大鼠模型心肌氧化应激损伤变化及依达拉奉的干预作用
2020-04-07段艳妮凌继祖原新慧李丽芳余勤
段艳妮 凌继祖 原新慧 李丽芳 余勤
兰州大学第一医院呼吸内科730000
OSAHS是一种常见的睡眠呼吸紊乱性疾病。一项大规模的荟萃分析[1]显示大约1/5的成年人患有中度OSAHS,而大约1/15的成人患有重度OSAHS。大量研究[2-6]显示OSAHS是心血管疾病的独立危险因素,可增加心血管疾病的患病率和病死率。OSAHS相关的心血管疾病病理过程比较复杂,发病机制与多种因素有关,其中氧化应激在其中扮演着重要的角色[7]。间歇性低氧(intermittent hypoxia,IH)是OSAHS的主要病理生理改变,类似于缺血-再灌注损伤,会引发系统性氧化应激反应[8]。依达拉奉 (edaravone,Eda)作为自由基清除剂,目前广泛用于脑血管疾病,对心血管疾病研究较少。因此,为明确OSAHS对心肌氧化应激损伤的影响,本实验采用IH大鼠模型模拟OSAHS,研究大鼠心肌氧化应激损伤变化及外源性抗氧化剂依达拉奉是否对IH所致心肌损伤具有干预作用,为临床预防和治疗OSAHS相关的心血管疾病提供新思路。
1 材料和方法
1.1 材料
1.1.1 动物分组、模型制备及处理 健康雄性Wistar大鼠80只,体质量 (110±10)g,由兰州大学动物实验中心提供。根据随机数字表法分为正常对照 (normal control,NC)组、IH组、IH+Eda组、IH+生理盐水 (normal saline,NS)组,每组20只。每天9am-5pm为实验时间,实验开始时,将IH组、IH+Eda组、IH+NS组大鼠分别置于IH模拟舱,模拟舱内最低氧浓度范围为6%~7%,最高氧浓度范围为20%~21%,每120秒循环一次。实验过程中,大鼠可自由活动。非实验时间,大鼠于饲养笼中自由进食水。在大鼠放入IH模拟舱之前,先用测氧仪监测各模拟舱的氧浓度,通过气体控制装置及设置的氧气、氮气及压缩空气的吹入时间及流量 (氧气2 L/min,氮气10 L/min,压缩空气10 L/min)来调节模拟舱中的氧气浓度。IH具体为每个循环120 s,包括低氧期(纯氮气3 0 s+静息10 s)和复氧期(纯氧气20 s+压缩空气60 s)。每天8 h,9am-5pm,每周7 d,连续4周,总共28 d。每天实验前30 min给予IH+Eda组大鼠腹腔注射依达拉奉 (3 mg/kg),给予IH+NS组大鼠腹腔注射同体积的生理盐水。NC组大鼠每天于相同时间置于相同规格的饲养舱,给予相同时间及流量的压缩空气。实验过程中无大鼠死亡。实验第29天 (即造模结束后第1天)将所有大鼠依次利用10%水合氯醛3 ml/kg腹腔注射麻醉后固定于木板上,暴露腹部,经腹主动脉釆血4~5 ml后处死大鼠,迅速打开胸腔,取心室心肌并分为3份,近心尖部液氮冷冻后储存于-80℃冰箱用于制备组织匀浆,其中1份进行HE染色,剩余部分用于透射电镜观察。本实验符合动物实验伦理学标准。
1.1.2 实验试剂及仪器 全自动生化检测仪 (美国BeckmanCoulter LX-20型);BCA蛋白定量试剂盒 (大连美仑生物技术有限公司);腺嘌呤核苷三磷酸 (adenosine triphosphate,ATP)含量测试盒;超氧化物歧化酶 (superoxide dismutase,SOD)测定试剂盒;丙二醛 (malondialdehyde,MDA)测试盒 (南京建成生物工程研究所);定量PCR检测试剂盒 (宝生物工程有限公司);光学显微镜 (日本Olympus公司);JEM-1230透射电镜(日本JEOL电子科技公司)。
1.2 方法
1.2.1 大鼠血清心肌酶测定 采取4组大鼠腹主动脉血4~5 ml送兰州大学第一医院检验科,使用全自动生化检测仪检测大鼠血清乳酸脱氢酶(lactate dehydrogenase,LDH)、 肌 酸 激 酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)水平。
1.2.2 心肌组织氧化应激测定 取部分心肌组织,采用硫代巴比妥酸法检测心肌组织过氧化物指标MDA的含量;利用Fenton反应检测心肌组织羟自由基含量;应用WST-1法检测心肌组织抗氧化物指标SOD活力,所有操作均按试剂盒说明书严格进行。
1.2.3 心肌组织ATP含量测定 取部分心肌组织,应用Bicinchoninic acid法检测蛋白浓度;按照ATP含量测定试剂盒说明书测定并计算ATP浓度。
1.2.4 心肌细胞凋亡基因检测 利用反转录-PCR技术检测凋亡相关指标,测定Bcl-2、Bax、半胱氨酸蛋白酶3(Caspase-3)m RNA的表达水平。序列如下:Bcl-2上游引物:5'-GACTGAGTACCTGAACCGGCATC-3',下游引物:5'-CTGAGCAGCGTCTTCAGAGACA-3'。Bax上游引物:5'-AGGACGCATCCACCAAGAAGC-3',下游引物:5'-GGTTCTGATCAGCTCGGGGCA-3'。Caspases-3上游引物:5'-GAGACAGACAGTGGAACTGACGATG-3', 下 游 引 物:5'-GGCGCAAAGTGACTGGATGA-3'。β-actin 上 游 引 物: 5'-CCCATCTATGAGGGTTACGC-3',下游引物:5'-TTTAATGTCACGCACGATTTC-3'。
1.2.5 心肌组织形态学观察 心肌组织经4%多聚甲醛固定,脱水,透明,浸蜡,石蜡包埋,连续切片,厚度4μm,HE染色,置于光学显微镜下观察心肌组织病理学改变。
1.2.6 心肌组织超微结构观察 心肌组织经2.5%戊二醛固定 (4℃),1%锇酸固定液固定,逐级乙醇脱水、环氧树脂包埋、超薄切片,进行醋酸铀、枸橼酸铅染色后,JEM-1230透射电镜下观察心肌细胞超微结构改变。
1.3 统计学分析 采用SPSS 21.0统计软件进行统计学分析。计量资料以x-±s表示,单因素使用方差分析检验数据是否存在统计学差异,不同组之间两两比较采用LSD检验,变量间相互关系应用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清心肌酶学指标比较 如表1所示,与NC组相比,IH组及IH+NS组大鼠血清LDH、CK、CK-MB水平均明显升高 (P值均<0.05);给予Eda干预后LDH、CK、CK-MB水平较IH组显著下降 (P值均<0.05)。
2.2 各组心肌氧化应激损伤指标比较 如表2所示,与NC组相比,IH组及IH+NS组心肌MDA、羟自由基水平明显升高,SOD活力明显降低 (P值均<0.05);给予Eda干预后MDA、羟自由基水平较IH组明显下降,而SOD活力显著升高 (P值均<0.05)。
2.3 各组心肌组织ATP检测结果 如表3所示,与NC组相比,IH组及IH+NS组大鼠心肌组织ATP水平明显下降 (P值均<0.05);给予Eda干预后ATP水平较IH组明显升高 (P<0.05)。
2.4 各组心肌细胞凋亡因子检测结果 如表4所示,与NC组相比,IH组及IH+NS组大鼠心肌组织Bcl-2 mRNA表达降低,Bax、Caspase-3 m RNA表达明显升高 (P值均<0.05);经Eda干预后Bcl-2 mRNA表达升高,Bax、Caspase-3 m RNA表达水平明显降低 (P值均<0.05)。
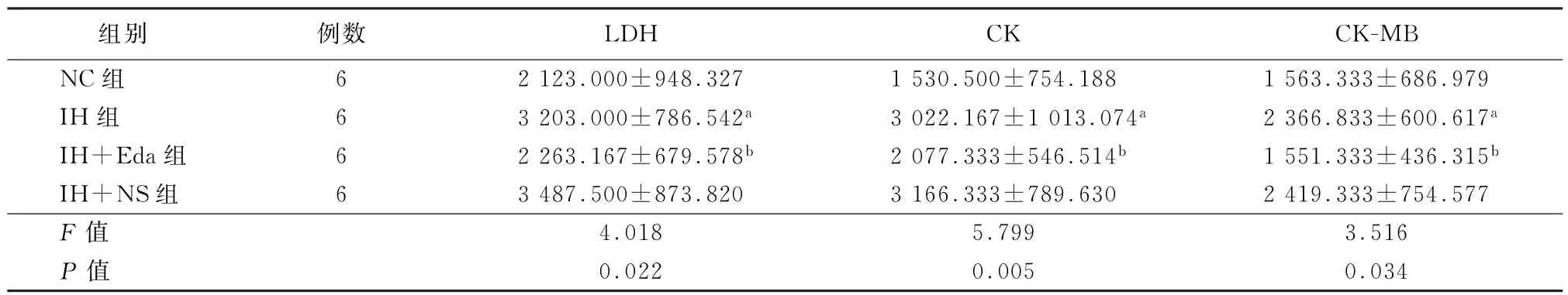
表1 各组大鼠血清心肌酶学水平 (U/L,x-±s)
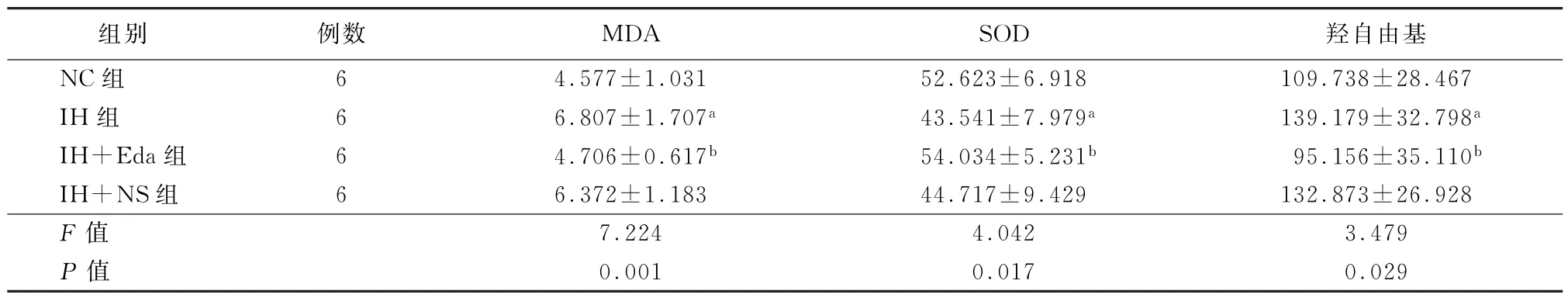
表2 各组大鼠心肌组织氧化应激损伤水平 (U/mgprot,x-±s)
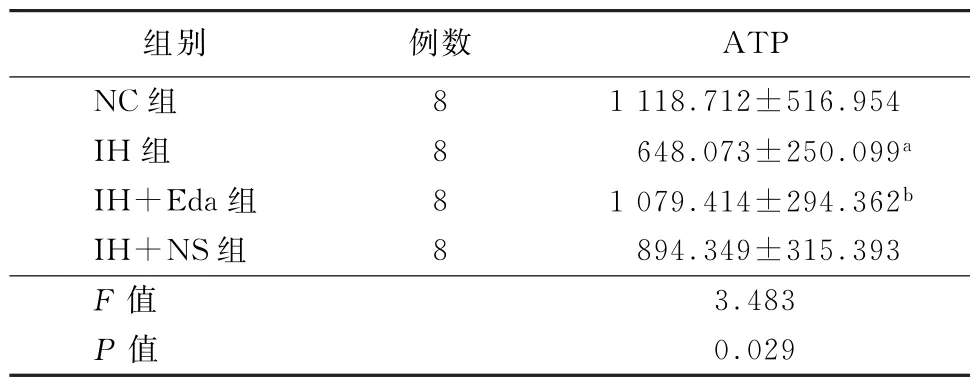
表3 各组大鼠心肌组织ATP水平比较(μmol/gprot,x-±s)
2.5 心肌Caspase-3 m RNA表达水平与各指标之间相关性 如表5所示,Pearson相关分析显示,Caspase-3 mRNA的表达水平与CK(r=0.575)、CK-MB(r=0.460)、MDA(r=0.643)、羟自由基 (r=0.454)、Bax m RNA(r=0.741)呈正相关,与 ATP(r=-0.525)、Bcl-2 m RNA(r=-0.578)呈负相关。
2.6 各组心肌组织病理学改变 光镜下观察各组大鼠心肌组织形态学改变。NC组大鼠心肌细胞排列整齐,细胞大小一致,形态规则,横纹清晰,细胞质均染,细胞核呈类圆形,致密可见。IH组与IH+NS组大鼠心肌结构受损,心肌细胞大小不一,可见细胞水肿,部分细胞坏死,细胞核较稀疏,形态各异。IH+Eda组大鼠心肌细胞结构损伤有所缓解,心肌细胞排列尚可,组织结构较清晰,细胞质均淡染,细胞核较多,呈梭形。见图1。
2.7 各组心肌组织超微结构改变 透射电镜下观察各组大鼠心肌组织超微结构改变。NC组电镜下心肌超微结构正常,细胞核呈梭形,核仁明显,常染色质丰富,异染色质少见;肌纤维排列有序,肌丝排列规则,线粒体嵴部正常;心肌细胞闰盘结构清晰,连接紧密。IH组及IH+NS组大鼠心肌细胞超微结构受损,肌纤维排列紊乱,肌节结构模糊,部分肌丝断裂,甚至溶解;线粒体肿胀,部分包膜破裂致线粒体形态不规则,嵴部结构异常,呈空泡样改变;心肌细胞间闰盘连接中断。IH+Eda组大鼠心肌超微结构损伤有所缓解,细胞核呈梭形,核仁明显,常染色质分布均匀,异染色质少;大部分肌丝排列整齐,未见明显异常收缩带;线粒体结构基本完整,部分肿胀,嵴部较清晰,空泡样改变较少;心肌细胞间闰盘结构较清晰,连接紧密。见图2。
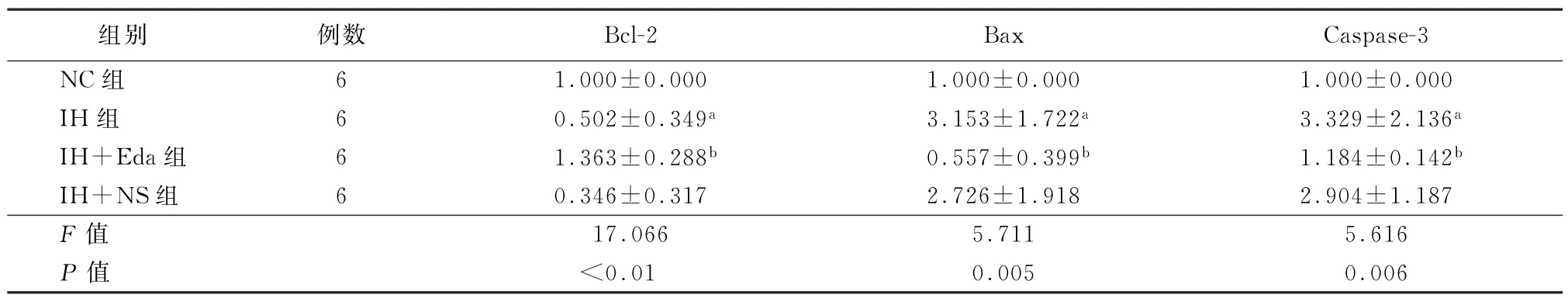
表4 各组大鼠心肌细胞基因水平 (x-±s)
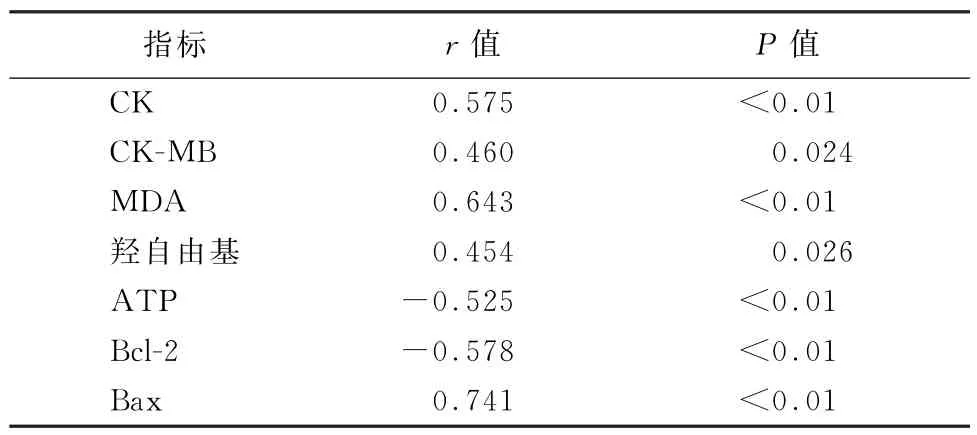
表5 大鼠心肌组织Caspase-3与各指标相关性分析
3 讨论
众所周知,OSAHS是心血管疾病的独立危险因素[2-6],可增加心血管疾病的患病率和病死率[9]。OSAHS不仅可以诱发心血管疾病,还可以加重原有心血管疾病患者的病情。但是,目前OSAHS合并心血管疾病的潜在机制仍不明确。本研究应用IH暴露的大鼠模型,观察大鼠心脏对IH的反应,明确是否对大鼠心肌造成氧化应激损伤及其可能损伤机制,并探讨Eda是否对IH所致的大鼠心肌氧化应激损害具有干预作用。
近期,一些OSAHS的动物及临床研究均证实,OSAHS与氧化应激相关[10-11]。OSAHS患者睡眠过程中反复出现呼吸暂停及呼吸恢复,可导致机体产生大量活性氧 (reactive oxygen species,ROS),抗氧化剂相对减少,最终引起氧化与抗氧化防御系统失衡,氧化物水平升高,抗氧化物水平降低[12-13],体内ROS蓄积而造成心肌损伤。本实验通过4周的IH处理发现,各组大鼠心肌组织形态学有明显改变,NC组大鼠心肌结构未见明显损害,而IH组及IH+NS组可见心肌细胞大小不一,部分细胞水肿甚至坏死,细胞核较稀疏。再进一步利用透射电镜观察大鼠心肌超微结构发现,IH组及IH+NS组可见肌纤维排列紊乱,肌节结构模糊;线粒体肿胀,部分包膜破裂致线粒体形态不规则;心肌细胞间闰盘连接中断。综上,光镜及电镜均证实IH对大鼠心肌组织造成了损伤。
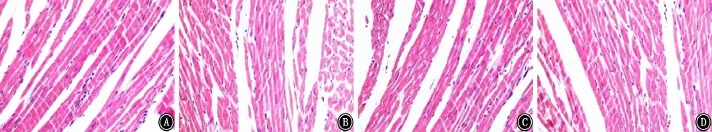
图1 各组大鼠心肌组织病理学改变 HE ×400 A:正常对照组;B:间歇性低氧组;C:间歇性低氧+依达拉奉组;D:间歇性低氧+生理盐水组
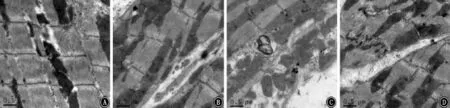
图2 各组大鼠心肌组织超微结构改变 ×20 000 A:正常对照组;B:间歇性低氧组;C:间歇性低氧+依达拉奉组;D:间歇性低氧+生理盐水组
IH是否对大鼠心肌具有氧化应激损伤,大鼠心肌氧化应激程度可用多个氧化应激标记物含量来反映。其中,ROS是氧化应激最直接的标记物,羟自由基是ROS的主要成分之一。本实验4组大鼠羟自由基的含量检测结果显示,IH组及IH+NS组心肌羟自由基含量明显高于NC组。除此之外,通常还将ROS与其他物质的反应产物作为机体氧化应激的间接标记物。其中,MDA是一个重要的脂质过氧化产物,可间接反映机体氧自由基水平。实验结果显示,与NC组相比,IH组及IH+NS组心肌MDA水平明显增高。不论是氧化应激的直接标记物还是间接标记物,本实验研究结果均显示IH使大鼠心肌氧化物水平升高。SOD是一种内源性抗氧化剂,可清除体内自由基,保护细胞免受氧化应激损害,间接反映机体抗氧化水平。本实验结果显示,与NC组相比,IH组及IH+NS组心肌SOD活力明显下降。可见,实验大鼠心肌氧化物水平升高,抗氧化水平降低,即IH对大鼠心肌具有氧化应激损伤。
IH对大鼠心肌氧化应激损伤可能通过诱导心肌细胞凋亡实现。心肌细胞凋亡途径主要包括线粒体介导的细胞凋亡、内质网介导的细胞凋亡及死亡受体介导的细胞凋亡。3种通路之间相互作用共同介导细胞凋亡,其中线粒体介导的凋亡起主导作用[14]。
IH可使心肌发生氧化应激反应,产生的大量ROS促使心肌细胞线粒体膜发生脂质过氧化,引起线粒体膜通透性转换孔开放,线粒体膜电位下降,致使生理状况下存在于线粒体内的凋亡相关蛋白释放入细胞质,多个凋亡相关蛋白发生一系列级联反应,最终可诱发细胞凋亡[15]。线粒体功能异常,机体有氧氧化减弱,ROS的产生量也会增加,进一步加剧氧化剂诱导的细胞凋亡[16]。线粒体膜电位下降及细胞能量减少是细胞凋亡的必然过程,且发生于细胞形态学改变之前。因此,本实验检测线粒体ATP含量,间接评价线粒体功能是否受损。实验结果显示,与NC组相比,IH组及IH+NS组大鼠心肌ATP含量明显下降,间接说明大鼠心肌线粒体功能可能受损。
线粒体介导的细胞凋亡主要反应是线粒体膜通透性的改变、细胞色素C(cytochrome C,Cyt-C)的释放、Caspase的级联反应、Bcl家族蛋白的调节。其中,Caspase在正常细胞中以无活性的前体形式存在。Caspase的活化是通过蛋白水解实现的,除去氨基末端区域及连接片段,将大亚基、小亚基聚合而成。OSAHS患者心肌产生大量ROS,导致线粒体膜完整性破坏,线粒体通透性转换孔开放,Cyt-C流入胞质[17]。Cyt-C与细胞内的凋亡酶激活因子1结合,诱导其发生构象变化[18],形成凋亡复合体,该凋亡复合体又可激活以酶原形式存在于胞浆中的Caspase-9。活化的Caspase-9又可使其下游的Caspase-3激活,启动细胞凋亡程序。因此,Caspase-3又被称为 “凋亡蛋白酶”。Caspase-3可破坏细胞内多种蛋白酶复合体[19]、激活核内核酸酶裂解DNA[20]、破坏离子通道等。本实验结果显示,与NC组相比,IH组及IH+NS组大鼠心肌组织Caspase-3 mRNA表达水平明显升高。可见,线粒体介导的心肌细胞凋亡参与了IH所致的大鼠心肌氧化应激损伤。
线粒体是细胞Bcl-2蛋白家族的主要活动场所[21]。在线粒体介导的细胞凋亡中,Bcl-2蛋白家族对其起着调节作用。其中Bcl-2和Bax是细胞内一对主要的抗凋亡蛋白和促凋亡蛋白[22]。Bcl-2是抗凋亡蛋白,可维持线粒体膜的完整性,调节线粒体通透性转换孔的启闭,抑制Cyt-C的释放,抑制细胞凋亡途径的启动;Bax是促凋亡蛋白,激活的Bax可移位至线粒体膜上,破坏其结构和功能,加速Cyt-C释放,启动凋亡程序。此外,Bcl-2调控mPTP对Bax的开放,阻断Cyt-C释放,抑Caspase活性,减少细胞凋亡[23]。本实验检测了Bax和Bcl-2 mRNA表达情况,与NC组相比,IH组及IH+NS组心肌Bax m RNA表达水平明显升高,而Bcl-2 m RNA表达水平明显降低。实验结果说明,IH大鼠心肌促凋亡基因表达增加,抗凋亡基因表达降低,心肌细胞可能发生凋亡。而且Caspase-3 m RNA的表达水平与血清心肌酶、心肌组织抗氧化物水平及促凋亡基因呈正相关,与心肌组织ATP及抗凋亡基因呈负相关。由此得知,线粒体介导的细胞参与了IH诱发的大鼠心肌氧化应激损伤。
Eda是第一个被证实有临床疗效的新型自由基清除剂,其不仅可以有效地清除氧自由基,降低炎性介质的释放,而且可以减轻氧化应激反应中脂质过氧化损伤[24]。近年来,国内外研究学者发现Eda同样可能具有清除心肌线粒体ROS的能力,并且在改善大鼠心肌氧化应激损伤方面具有显著疗效[25-26]。本实验结果发现,IH大鼠经Eda干预后,血清LDH、CK、CK-MB及心肌MDA、羟自由基含量明显降低,心肌细胞Bax、Caspase-3 m RNA的表达水平显著下降;而心肌SOD活力及ATP含量明显增加,Bcl-2 m RNA的表达显著升高;光镜及电镜下心肌组织形态学及超微结构破坏也得到一定缓解。可见,Eda在一定程度上可缓解大鼠IH所致的心肌氧化应激损伤,对大鼠心肌产生了保护作用,可能成为临床潜在的治疗方法。综上所述,IH可通过增加氧化物水平,降低抗氧化物水平,激活Bcl-2、Bax、Caspase-3造成大鼠氧化应激心肌损伤。此外,IH对大鼠心肌的氧化应激损伤可能通过线粒体介导的细胞凋亡实现。Eda可通过清除氧自由基、增强抗氧化能力、调控线粒体介导的细胞凋亡,对IH所致的大鼠心肌氧化应激损伤产生保护作用。
利益冲突所有作者均声明不存在利益冲突
