IgG抗体检测诊断慢性肺曲霉菌病的临床价值分析
2020-04-07杨罗曼周庆涛贺蓓
杨罗曼 周庆涛 贺蓓
北京大学第三医院呼吸与危重症医学科100191
慢性肺曲霉菌病(chronic pulmonary aspergillosis,CPA)是由吸入曲霉菌孢子所致,以烟曲霉最为常见,包括亚急性侵袭性肺曲霉菌病、慢性空洞性肺曲霉菌病、慢性纤维化性肺曲霉菌病、单纯肺曲霉球和曲霉结节[1]。CPA患者的病死率约为50%~85%[2],在欧洲约有24万人被诊断为CPA,而在中国这一数据高达26.6万人,并呈逐年增加的趋势[3]。虽然临床经验、影像学和实验室检查能显著提高CPA的检出率,但由于CPA起病比较隐匿,早期诊断CPA仍然具有挑战性[4-5]。2016年,欧洲临床微生物学和感染性疾病联合会、ERS以及美国感染病学会推荐将曲霉特异性免疫球蛋白G(immunoglobulin G,IgG)作为无免疫缺陷CPA患者的重要诊断指标之一[6]。在我国关于曲霉特异性IgG抗体的临床研究还少有报道。本研究期望通过对CPA感染高危患者进行IgG抗体检测,并根据临床特征分析其敏感度和特异度,为在临床诊断CPA中用好此方法提供依据。
1 对象与方法
1.1 研究对象 开展本次研究的时间为2018年4月至2019年4月,实验对象为在此期间就诊于北京大学第三医院呼吸与危重症医学科并疑似诊断为CPA的47例患者,其中男33例,女14例,年龄(69.51±14.65)岁。诊断标准:CPA的诊断参照2016年美国感染病学会发布的 《曲霉菌病诊断和处理实践》[6]及我国2007年 《肺真菌病诊断和治疗专家共识》[7](表1),将47例患者分为曲霉菌病组26例 (包括确诊、临床诊断和拟诊病例)和非曲霉菌病组21例 (非真菌感染)。本研究阳性率以确诊、临床诊断和拟诊病例进行分析并收集相关临床资料,包括临床特征、实验室检查指标、影像学资料、抗真菌药物使用情况、临床转归等。本研究符合 《赫尔辛基宣言》的原则。
1.2 研究方法 对纳入的47例患者清晨行肘静脉采血,量约3 ml。将所采取的血液标本通过离心机离心 (3 000 r/min)5min,离心半径为250 mm,离心处理需在采血24 h以内开展。随后进行1,3-β-D葡聚糖试验 (1,3-β-D-glucan test,G试验)、半乳甘露聚糖试验 (galactomannan test,GM试验)和曲霉特异性IgG检测。G试验主要检测葡聚糖含量,阳性阈值为60 ng/L。GM试验采用酶联免疫吸附法,阳性阈值为系数I≥0.5。本研究使用的曲霉特异性IgG抗体检测试剂盒来自天津丹娜生物科技有限公司,以检测值<80 AU/ml为阴性,以80~120 AU/ml为中介,≥120 AU/ml为阳性。收集所有患者的临床数据,包括实验室检查、影像学检查、微生物学检查以及治疗情况。

表1 慢性肺曲霉菌病分级诊断标准
1.3 统计学分析 采用SPSS 21.0统计学软件进行数据分析。计数资料以百分比 (%)表示,采用χ2检验。计量资料为正态分布时,以x-±s表示,采用t检验;非正态分布的数据以M(P25,P75)表示,组间差异使用秩和检验进行比较。利用ROC曲线来评价曲霉特异性IgG对CPA的诊断效能,并计算ROC曲线下面积,计算曲霉特异性Ig G检测的敏感度、特异度、阳性预测值、阴性预测值等。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基本临床资料比较 根据临床分级诊断标准,在47例CPA感染高危患者中曲霉菌病组有26例 (55.3%),其中确诊患者有5例,临床诊断患者为17例,拟诊患者4例。曲霉菌病组中24例患者有宿主感染高危因素,5例患者进行气管镜活检证实肺曲霉菌感染,6例患者影像学诊断符合肺曲霉菌感染特征;24例患者有相关临床症状;5例患者痰曲霉菌培养阳性,12例患者抗原检测阳性;26例患者中有23例进行了抗曲霉菌治疗,其中3例患者死亡,其他患者临床症状好转出院。非曲霉菌病组有21例 (44.7%),均排除真菌感染,其中1例患者进行了抗真菌药物治疗。2组患者抗真菌药物使用率比较,差异有统计学意义 (P<0.05)。47例患者中支气管扩张有7例,COPD有11例,肺结核有3例,间质性肺病有6例,肺癌有6例,肺大疱有4例,支气管哮喘有2例,支气管炎有2例。2组患者在年龄、宿主感染高危因素、临床症状等方面比较差异均无统计学意义(P值均>0.05),但曲霉菌病组男性患者远多于非曲霉菌病组 (P<0.05),而且曲霉菌病组患者C反应蛋白水平也明显高于非曲霉菌病组 (P<0.05)。见表2。
2.2 不同检测方法检测CPA的实验室数值 2组患者血清G试验、GM试验检测数值差异均无统计学意义 (P值均>0.05),但曲霉菌病组IgG水平明显高于非曲霉菌病组 (P<0.05),见表3。其中曲霉菌病组有5例患者经病理诊断为阳性,其曲霉特异性IgG数值分别为215.15、150.06、320.78、95.53、84.11 AU/ml,判定为阳性或者中介。
2.3 曲霉特异性IgG检测CPA的ROC曲线分析 以CPA分级诊断标准 (包括确诊、临床诊断和拟诊患者)为基础,以1-特异度为横轴,敏感度为纵轴做曲线,得到ROC曲线如图1。曲霉特异性IgG检测所对应的曲线下面积为0.785 3(95%CI:0.647 2~0.923 4),其诊断CPA的敏感度为65.4%,特异度为71.4%,阳性预测值为66.7%,阴性预测值为76.5%,其中特异度和阴性预测值均高于70%。
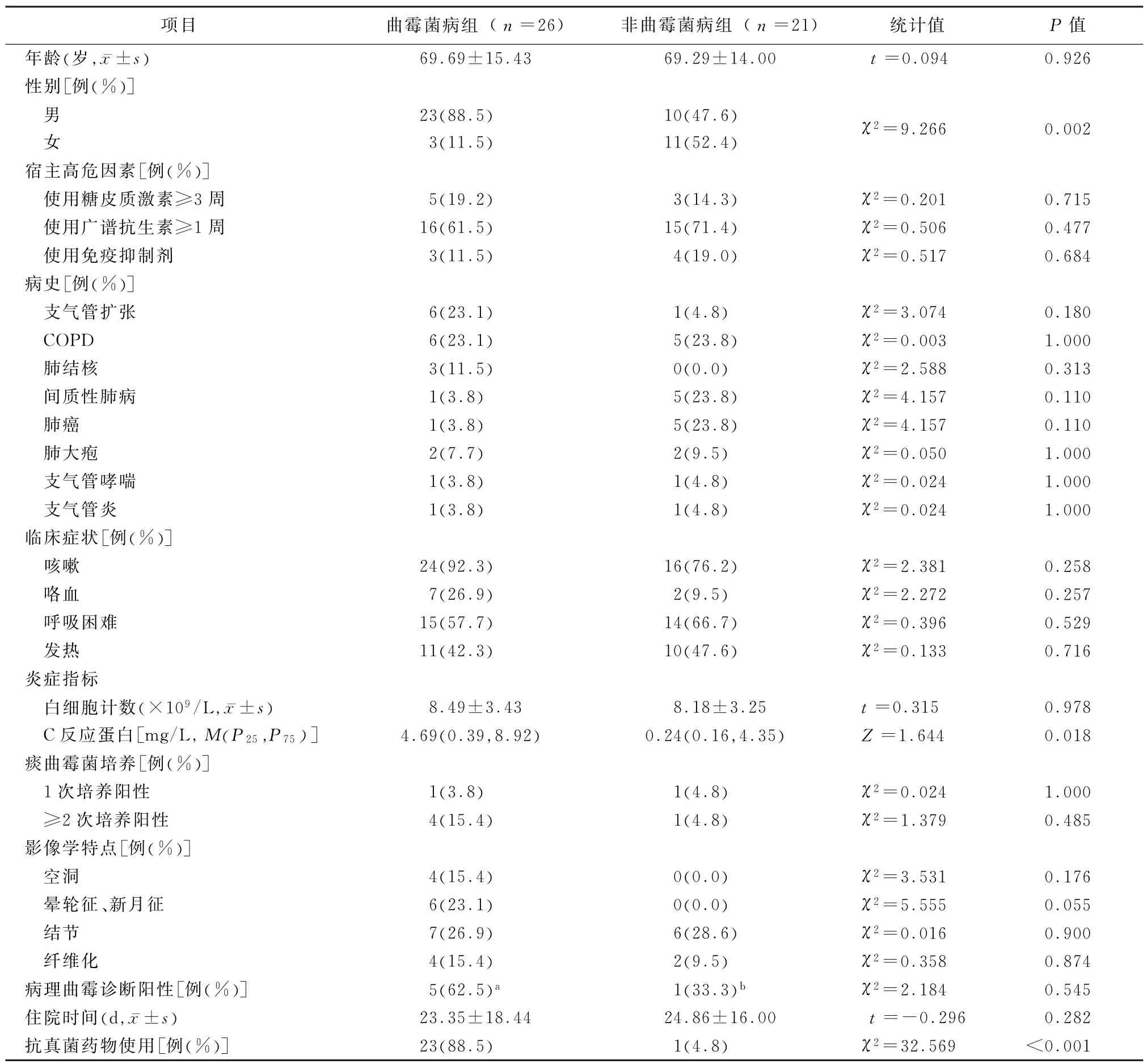
表2 2组患者的临床特征的比较
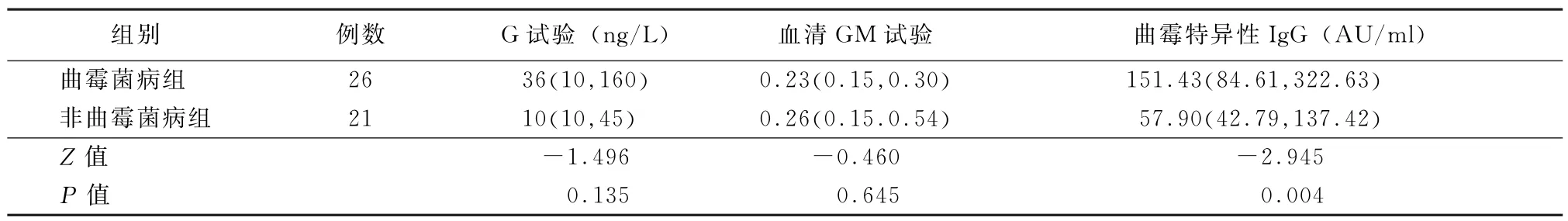
表3 2组患者不同检测方法检测CPA的实验室数值 [M(P 25,P 75)]
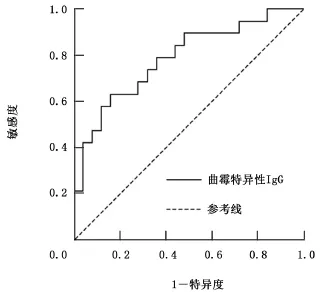
图1 曲霉特异性IgG检测CPA的ROC曲线
3 讨论
CPA好发于有肺部基础疾病或免疫缺陷的患者,也可发生于免疫功能正常患者,发病率、病死率和复发率均较高[1]。据报道,CPA的发病率逐年升高,目前全球大约有300万人罹患此病,而且其5年生存率仅50%左右[8]。诊断CPA需要结合临床慢性病程、影像学结果、炎症标记物以及微生物学的证据。但CPA起病比较隐匿,临床表现多变复杂,影像学检查难以确诊,痰涂片阳性率低,使早期诊断非常困难。在近年发表的国际性指南中推荐曲霉特异性IgG抗体检测可用于早期诊断CPA,但其检测效果还需要大量的临床研究加以证实[1,9]。
本研究将纳入的47例患者分为曲霉菌病组和非曲霉菌病组,其中曲霉菌病组中男性患者远多于非曲霉菌病组,这与现有报道[10-12]结果一致。有研究[13]表明真菌感染患者C反应蛋白明显升高,其敏感度和特异度均较高,可提高对真菌感染的预测值。本研究中曲霉菌病组患者C反应蛋白水平明显高于非曲霉菌病组。痰培养耗时长且阳性率较低,有研究[14]表明≥2次痰培养阳性的病例诊断符合率明显高于单次痰培养阳性的病例。在本研究中虽然多次痰培养阳性率有所升高,但是与对照组相比差异并无统计学意义,可能与本研究样本数量少、痰培养阳性率低有关。CPA的临床症状缺乏特异性,可表现为咳嗽、咳痰、胸痛、发热、咯血、呼吸困难、乏力。CPA患者在影像学上的表现主要以空洞和结节为主,空气新月征、晕轮征也是其特征性表现[15-16],这与本研究中曲霉菌病组结果相一致,但是和非曲霉菌病组相比差异无统计学意义,表明通过影像学资料诊断CPA十分困难。组织病理检查结果阳性是曲霉菌感染的直接证据[1]。在临床工作实践中患者接受气管镜活检或经皮肺穿刺活检较多,但取材困难且标本难以判定曲霉菌菌丝的侵犯范围,为CPA的进一步分型带来一定程度的困难[11]。在本研究2组患者中仅有11例患者进行了肺或支气管组织病理检查,曲霉菌病组有5例患者经病理诊断为阳性,而且曲霉特异性Ig G检测呈阳性或者中介,其中2例检查呈中介的患者均在采血前接受了抗真菌药物治疗,因此曲霉特异性IgG可能受到抗真菌药物治疗的影响,但是否可以反映临床治疗效果,仍需临床研究加以证实。在本研究中,曲霉菌病组和非曲霉菌病组G试验结果差异并无统计学意义。以往血清学方法检测多推荐采用G试验、GM试验,但G试验对CPA感染诊断无特异性,而对念珠菌感染诊断价值更高[17]。对中性粒细胞减少患者来说,GM试验为早期发现并及时诊断真菌感染的重要方法[18]。GM试验在欧美国家已经被获准用于粒细胞减少发热患者的早期诊断,但对非粒细胞减少的肺曲霉患者具有较高的假阴性率,除外恶性血液病患者,血清GM检测的敏感度为22%,特异度为84%[19]。另外,影响血清GM试验结果的因素较多,对于CPA的早期诊断具有一定的局限性。但研究也表明肺泡灌洗液GM检测曲霉菌感染的ROC曲线下面积为0.871,其检测效能明显高于血清GM,因此推荐使用肺泡灌洗液GM而不是血清GM检测CPA。本研究由于条件限制,仅有3例患者进行了肺泡灌洗液GM检测,其阳性率为100%。但是对于危重症患者、高龄患者以及有气管镜检查禁忌证的患者获取肺泡灌洗液可能较为困难。血清学抗体检测是通过检测机体是否存在特异性抗体而间接判断有无相关真菌感染,而且目前抗体检测的操作方法简便、耗时短,仅需数分钟。因此,血清曲霉特异性IgG、Ig M抗体检测成为另一个早期诊断CPA的有价值的实验室检查方法。当曲霉菌特异性抗体与血清GM试验联合检测CPA时,其敏感度和特异度可分别达76.1%和96%[20],可以弥补GM试验的一些缺陷。
CPA患者中曲霉特异性IgG增高较为常见[21-22]。在本研究中将确诊患者 (5例)、临床诊断患者 (17例)和拟诊患者 (4例)归为曲霉菌病组。其血清曲霉特异性IgG水平明显高于非曲霉菌病组,分别为151.43(84.61,322.63)AU/ml和57.90(42.79,137.42)AU/ml,ROC曲线下面积为0.785 3,特异度为75.4%,明显高于血清G试验和GM试验。先前的一些研究也表明曲霉特异性IgG有助于早期准确诊断曲霉感染。Dumollard等[23]通过对436份血清标本进行检测,发现曲霉特异性Ig G检测具有更高的敏感度和特异度,其ROC曲线下面积为0.9,明显高于本研究,分析其原因可能与研究对象有关。Dumollard等[23]所纳入的患者中患有结核的人数较多,此为曲霉菌感染的高危因素,超过20%的肺结核患者曲霉特异性抗体检测阳性,这可能是Dumollard等[23]的研究敏感度、特异度较高的原因。在我国进行的另一项研究[24]中发现使用曲霉特异性IgG检测的ROC曲线下面积为0.762,敏感度和特异度分别为70%和82.80%,这与本研究结果一致,进一步证明了曲霉特异性IgG检测作为一种新型的血清学检测手段可用于我国高危曲霉菌感染的患者,以便早期诊断并指导临床用药。
本研究存在局限性。首先,本研究没有进行曲霉特异性Ig M检测。据报道,在CPA患者中大约有50%的患者会出现Ig M的升高,但对于慢性疾病Ig M的产生似乎缺乏合理性。分析其原因可能是曲霉菌在生长的不同阶段产生大量不同类型的抗原,这些新生成的抗原不断刺激机体产生Ig M,因此仅在曲霉菌感染的某些阶段可以检测到Ig M。有研究[24]虽然证明曲霉特异性Ig M检测能够区别CPA、定植和其他肺部疾病,但其敏感度和特异度均低于IgG,而且曲霉特异性IgG和Ig M联合检测效果并不优于单独IgG检测,另外Ig M检测的特异性较低,这也限制了其临床应用[25-26]。其次,本研究并没有检测抗体水平在曲霉菌定植和感染中的差异。有研究[24]表明曲霉特异性IgG在CPA患者中明显高于烟曲霉定植患者。但是并没有具体的数值来区分CPA和烟曲霉定植。因此,未来的研究需要验证定植患者的曲霉特异性抗体的范围。而且,本研究由于条件限制,大部分患者并未进行病理检查,无法完全确诊或者排除曲霉菌定植可能,可能导致结果存在偏倚。另外,本研究纳入研究对象中存在使用糖皮质激素和免疫抑制剂的患者。对于免疫功能正常的CPA患者,曲霉特异性抗体检测的敏感度较高,而对于免疫缺陷的患者,抗体反应往往延迟或者缺失,抗体产生平均需要10.8 d[27]。研究[3,28]显示对于非中性粒细胞减少的患者抗体检测的敏感度 (48%)高于中性粒细胞减少的患者 (6%)。但是对有血液系统疾病的患者研究[26]发现,在进行造血干细胞移植或者化疗前检测曲霉特异性IgG抗体水平,能够发现治疗后更容易发生侵袭性曲霉菌病的患者,指导临床用药。因此,虽然曲霉特异性IgG检测对免疫缺陷患者有局限性,但仍对临床治疗有指导价值。
总之,CPA患者临床症状、体征缺乏特异性,延误治疗可能会导致病情加重,增加患者病死率。在临床工作中,对高危患者进行曲霉IgG检测联合GM检测可以提高诊断的敏感度,早期诊断CPA,为精准用药提供临床依据。
利益冲突所有作者均声明不存在利益冲突
