纳米TiO2暴露对萼花臂尾轮虫种群动态的影响
2020-04-07李猛黄荣席贻龙项贤领
李猛,黄荣,席贻龙,2,项贤领,2,*
1. 安徽师范大学生态与环境学院,芜湖 241000 2. 皖江流域退化生态系统的恢复与重建省部共建协同创新中心,芜湖 241000
纳米材料是一种由一个或多个三维尺寸在1~100 nm之间的粉状或团块状天然或人工材料,并且这一基本颗粒的总数量在整个材料的所有颗粒总数中占50%以上[1-5]。研究表明,当粒子处于纳米级时,材料的理化性质会发生变化。纳米粒子具有更高的生物活性,与生物体的相互作用更加有效[6]。纳米TiO2因其特殊的结构和性能而愈加引起人们的广泛关注。纳米TiO2具有独特的光学性质,以及极高的化学稳定性、热稳定性、超亲水性和非迁移性等,因此,被广泛应用于化妆品、抗紫外材料、光催化剂功能纤维、塑料、涂料和油漆等行业[7-16]。
在工业生产、使用和运输过程中纳米材料不可避免地进入生态环境,可对水生态系统的结构和功能产生不同程度的影响,对生物安全和人体健康存在潜在危害。大量研究表明,纳米TiO2对水生态系统中的藻类、浮游动物和鱼类等均具有毒害作用。纳米TiO2暴露可显著降低种群的增长率和藻细胞的代谢活性,进而影响淡水环境重要群落和生态系统特性[17-18]。而对于鱼类,纳米TiO2则可与细胞外带有电荷的羟基自由基作用,直接引起鱼类鳃组织细胞膜的氧化损伤[19]。对于浮游动物的研究主要以大型溞(Daphniamagna)为受试对象。研究表明,即使在低浓度(0.5 μg·L-1)下,大型溞接触纳米TiO2溶液24 h,其心率也会受到明显抑制[20]。Zhu等[21]对大型溞进行急性和慢性毒性学实验,得出48 h无可见效应浓度(NOEC)为50 mg·L-1,半数效应浓度(EC50)和半数致死浓度(LC50)均>100 mg·L-1;当时间延长至72 h时,NOEC<0.1 mg·L-1,EC50为1.62 mg·L-1,LC50为2.02 mg·L-1;21 d暴露实验结果表明,即使在低浓度(0.1 mg·L-1)时,纳米TiO2也显著降低了大型溞后代的数量。Farner等[22]探究了纳米TiO2稳定性和光反应性对大型溞的影响,研究结果表明,可见光下暴露于纳米TiO2悬浮液的大型溞死亡率无显著差异,这可能是由于纳米TiO2的沉降。UV光暴露显著增强了纳米TiO2毒性,LC50明显降低,天然有机物的存在可通过抑制羟基自由基(·OH)活性进而降低纳米TiO2的毒性。
有关纳米TiO2对浮游动物家族的重要成员——轮虫的研究尚鲜有报道。Nogueira等[23]研究发现,将褶皱臂尾轮虫(Brachionusplicatilis)暴露于8.2~20 mg·L-1的纳米TiO2悬浮液时,对其存活率无明显影响。Clément等[24]评估了不同直径纳米TiO2对褶皱臂尾轮虫48 h急性毒性,结果表明,直径15、25和32 nm的纳米TiO2对轮虫48 h-LC50分别为5.37、10.43和267.30 mg·L-1。以上研究中,受试生物为咸水物种,且实验内容仅限于急性毒性学实验,而由于纳米TiO2所引起的轮虫种群数量动态的变化尚未可知。
Gottschalk等[25]的研究表明,地表水中纳米TiO2浓度约为21 ng·L-1,而工业废水中纳米TiO2浓度约为4 μg·L-1。但部分改性的纳米材料也作为特殊材料被有意释放至环境以吸附去除水中部分污染物,因而实际浓度要比地表水中含量高[26]。基于上述分析,本实验拟以萼花臂尾轮虫(B.calyciflorus)作为受试对象,采用不同浓度的纳米TiO2对其进行急性和慢性毒性实验。本研究对于进一步深入理解纳米TiO2对浮游动物的毒性效应很有意义,并为探究轮虫在水环境风险评价中的应用可行性积累基础数据。
1 材料与方法(Materials and methods)
1.1 萼花臂尾轮虫的采集与培养
实验所用萼花臂尾轮虫采自安徽省芜湖市镜湖(31°19'53"N,118°22'14"E)。将采集的样本在实验室内于(23±1) ℃、自然光照条件下单克隆培养,轮虫培养液采用EPA培养基[27],所用饵料为OECD TG 201[28]培养基培养的处于指数增长期的斜生栅藻(Scenedesmusobliquus),投喂密度为2.0×106cells·mL-1。实验前,对萼花臂尾轮虫进行2周以上的预培养,期间每天更换轮虫培养液,并投喂食物,保持轮虫种群处于指数增长状态。
1.2 纳米TiO2悬浮液的制备
实验用纳米TiO2(99.8% metals basis,5~10 nm,锐钛,亲水型)购于上海麦克林生化科技有限公司。称取100 mg纳米TiO2置于100 mL EPA培养基中,超声处理30 min(400 W,50 kHz,23 ℃,超声时间9 s,超声间隙9 s),以制备纳米TiO2悬浮液母液[29-32],置于4 ℃冰箱中备用。实验时用EPA将其配制成所需浓度的测试液。将上述纳米TiO2寄至科谱研发技术中心(青岛)有限公司完成纳米TiO2基本理化性质测定。测定流程如下:取点样用溶剂超声分散,铜网粘取点样,干燥后使用透射电子显微镜(JEM—1200EX,日本JEOL公司)对纳米材料进行表征,然后使用Nano Measure软件测量纳米粒径,由X射线衍射仪(ultima IV,日本理学株式会社)测定纳米TiO2表面的Zeta电位。
1.3 急性毒性实验
体式显微镜下挑取携带非混交卵的萼花臂尾轮虫母体置于烧杯中孵化,4 h后挑取幼体进行实验。分别设置纳米TiO2浓度为5、10、20、40、80和160 mg·L-1,每组设置3个重复,并设置对照组(0 mg·L-1)。实验在12 mL培养管中进行,每支培养管中放入上述轮虫幼体10只,并加入10 mL含有2.0×106cells·mL-1的斜生栅藻和含有相应浓度纳米TiO2的EPA培养基。将培养管置于旋转混匀仪(YC-80,杭州米欧仪器有限公司),转速10 r·min-1。然后将旋转混匀仪置于(23±1) ℃恒温培养箱中培养,每24 h记录各处理组萼花臂尾轮虫死亡数并更换培养基和投喂上述藻密度的食物,48 h后结束实验,采用概率单位法计算纳米TiO2对萼花臂尾轮虫的48 h-LC50值。
1.4 慢性毒性实验
依据48 h-LC50结果设置慢性毒性实验中纳米TiO2浓度,分别为0.5、1.0、1.5、2.0、2.5和3.0 mg·L-1,另设对照组(0 mg·L-1),每组3个重复。实验时,体式显微镜下挑取携带非混交卵的萼花臂尾轮虫母体置于烧杯中孵化,4 h后挑取幼体进行实验。取10只轮虫幼体置于12 mL玻璃杯中,加入10 mL含有相应浓度纳米TiO2的EPA培养基,并投喂食物斜生栅藻,食物密度为2.0×106cells·mL-1。实验开始后,每24 h观察记录各玻璃杯中萼花臂尾轮虫各类雌体和休眠卵数量,计数后的轮虫重新放回玻璃杯,更换测试液并投喂食物。待所有实验组轮虫种群增长至最大种群密度并开始下降时,结束实验。根据Dumont和Sarma[33]的方法,在轮虫种群处于指数增长期时,选取4~6个数据计算种群增长率(r),r=(lnNt-lnN0)/t,N0和Nt分别为实验开始时和进行第t天时轮虫的种群密度,t为实验进行的时间(d)[34]。其余相关参数定义如下。
最大种群密度(maximum population density)为实验过程中轮虫种群密度的最大值。平均混交率(mictic rate)为种群中混交雌体数与总雌体数的比值。其中,混交雌体指种群中通过减数分裂的方式产生混交卵的轮虫,由于非混交卵未与雄体产生的精子发生受精作用,因而卵体积较小,数量多为4个以上;非混交雌体指种群中以有丝分裂方式产生非混交卵的轮虫,其卵大且卵壳较薄,数量多为4个以下。
休眠卵产量(production of resting egg)为种群中休眠卵的总数量。
总雌体生产量(production of total female)为单位时间和单位体积内,萼花臂尾轮虫种群产生总雌体的总量,参照Snell和Hoff[35]的方法,通过计算各自的总雌体增长曲线与X轴间的面积求得。混交雌体生产量(production of mictic)为单位时间和单位体积内,萼花臂尾轮虫种群产生混交雌体的总量,参照Snell和Hoff[35]的方法,通过计算各自的混交雌体增长曲线与X轴间的面积求得。
1.5 数据分析
数据采用SPSS 25.0进行统计分析,Origin 2018作图。急性毒性实验中,采用概率单位法求得纳米TiO2对萼花臂尾轮虫的48 h-LC50。针对慢性毒性实验,对数据进行正态分布检验后,对符合正态分布的数据采用单因素方差分析(One-Way ANONA),从而检验纳米TiO2浓度对种群增长各参数影响的显著性,并对各参数在不同处理组间进行多重比较(SNK-q检验),确定其中具有显著性差异的实验组;对纳米TiO2浓度与种群增长各参数间的关系进行回归分析。
2 结果与分析(Results and analysis)
2.1 纳米TiO2基本理化性质
纳米TiO2表征结果如图1所示,在透射电子显微镜(TEM)图像中,纳米TiO2呈现椭圆形,经Nano Measure软件测量,其直径范围为13~36 nm,平均直径为21.58 nm;而聚集后的纳米TiO2直径约在100~500 nm之间。该结果明显大于试剂生产厂家提供的产品参数。

图1 纳米TiO2的透射电子显微镜(TEM)图像及直径测量结果注:(a)、(b)和(c)分别为纳米TiO2在不同倍镜下形态图;(d)为经Nano Measure软件测量的纳米TiO2粒径分布。Fig. 1 Transmission Electron Microscope (TEM) image of nano-TiO2 and diameter measurementNote: (a), (b) and (c) are the morphology of nano-TiO2 under different magnifications; (d) is the particle size distribution of nano-TiO2 by Nano Measure software.
Zeta电位的数值与胶态分散的稳定性相关。Zeta绝对值越高,其体系越稳定,反之则容易发生聚集或沉淀。由Zeta电位分析结果可知,Zeta电位绝对值为28.2 mV,因此,纳米TiO2悬浮液稳定性一般,可能发生聚集或沉淀(表1)。

表1 纳米TiO2的Zeta电位分析结果Table 1 The results of Zeta potential measurement of nano-TiO2
2.2 纳米TiO2对萼花臂尾轮虫的急性毒性
采用概率单位法求得纳米TiO2对萼花臂尾轮虫48 h-LC50值为30.20 mg·L-1,其95%的置信限为19.23~46.13 mg·L-1。进而得到剂量-效应关系回归方程为y=0.6554x-0.4668,R2=0.9515。式中:y表示死亡率,x表示纳米TiO2浓度以10为底的对数。
2.3 慢性毒性实验
不同浓度纳米TiO2下,萼花臂尾轮虫的种群密度变化如图2所示。各浓度下,萼花臂尾轮虫种群密度随着时间的推移逐渐增加,1.0~3.0 mg·L-1实验组在第15天达到最大密度,而对照组和0.5 mg·L-1实验组分别在第16天和第17天达到种群最大密度。单因素方差分析和独立样本SNK-q检验结果表明,当纳米TiO2浓度为0.5 mg·L-1时,萼花臂尾轮虫种群最大密度与对照组无显著差异(P>0.05);当浓度≥1 mg·L-1时,各浓度下最大种群密度均比对照组和0.5 mg·L-1处理组显著减小(P<0.01),但这些处理组(≥1 mg·L-1)之间无显著差异(图3(a));但受纳米TiO2的影响,0.5~3.0 mg·L-1处理组的种群密度在实验后期下降速度比对照组更快,因此,纳米TiO2处理组平均种群密度相比于对照组显著减小(P<0.05)(图3(b))。此外,浓度≥1 mg·L-1的纳米TiO2显著抑制了萼花臂尾轮虫的平均种群增长率,随着纳米TiO2浓度的增加,平均种群增长率逐渐减小,但是1.0、1.5和2.0 mg·L-1三者间无显著差异,而1.5、2.0、2.5和3.0 mg·L-14个浓度组间也未见显著差异(图3(c))。
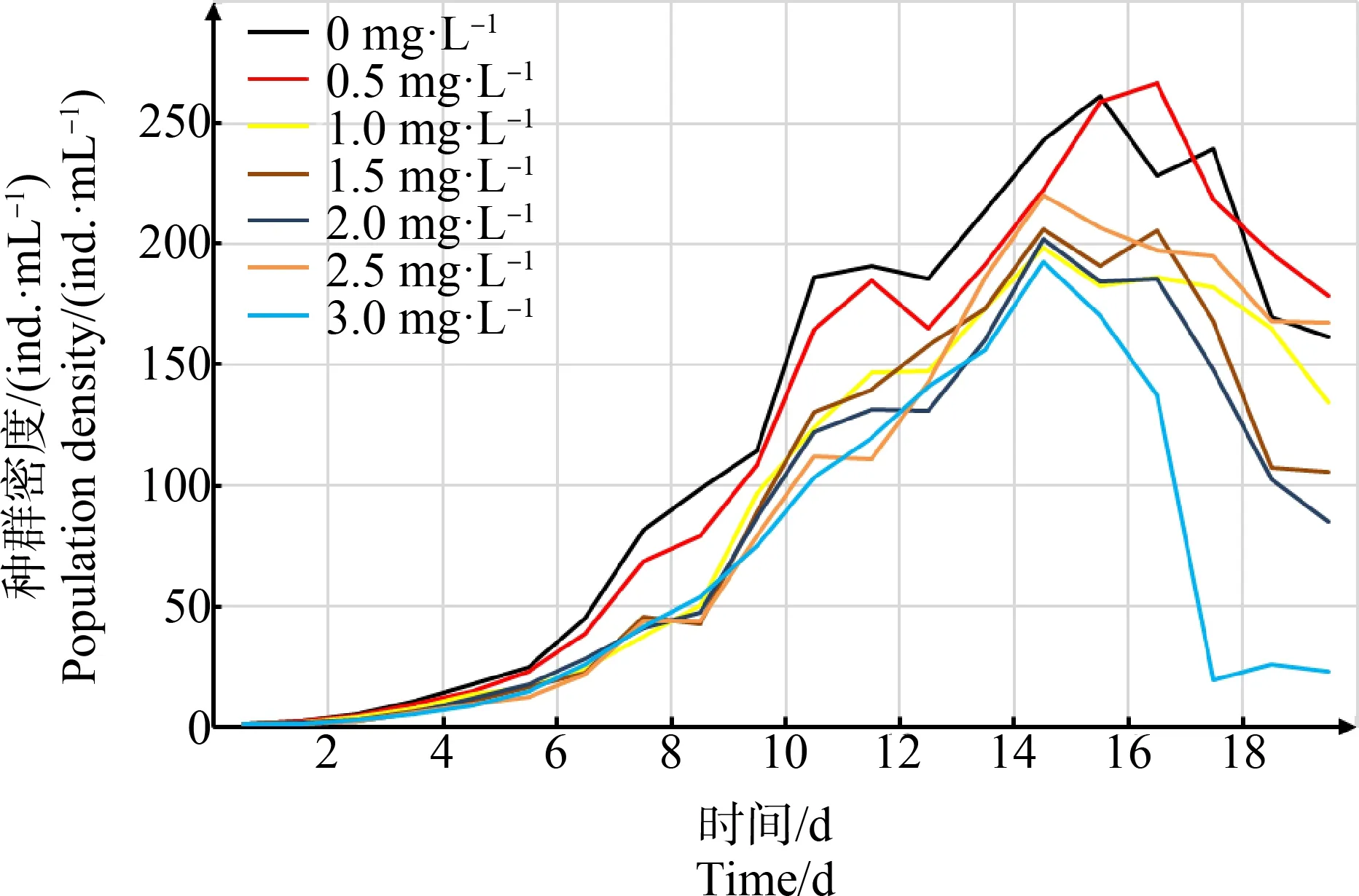
图2 不同纳米TiO2浓度下萼花臂尾轮虫的种群密度Fig. 2 Population densities of B. calyciflorus under different nano-TiO2 concentrations
萼花臂尾轮虫种群携卵情况则表现出以下规律:当浓度≥1 mg·L-1时,种群中萼花臂尾轮虫携带非混交卵数量被显著抑制,而1.5、2.0、2.5和3.0 mg·L-1实验组之间无差异(图3(d)),可见纳米TiO2可能通过影响萼花臂尾轮虫携带非混交卵数量进而影响种群增长。当纳米TiO2浓度为0.5、1.0、1.5和3.0 mg·L-1时,种群休眠卵产量与对照组无显著差异,而当浓度为2.0 mg·L-1和2.5 mg·L-1时,种群休眠卵产量显著提高(P<0.05)(图3(e)),产生这一现象的原因可能是在3.0 mg·L-1浓度下,萼花臂尾轮虫种群数量受到显著抑制而引起的。对种群混交率结果分析可知,当浓度≥1.5 mg·L-1时,混交率显著提高(P<0.05),2.0 mg·L-1时,种群具有最大混交率0.199±0.026(图3(f))。由休眠卵产量和混交率结果可知,纳米TiO2对萼花臂尾轮虫的有性生殖产生了影响。
对生产量单因素方差分析结果表明,当浓度≥1.0 mg·L-1时,总雌体生产量被显著抑制(P<0.05),而1.0、1.5、2.0和2.5 mg·L-1实验组之间无明显差异,3.0 mg·L-1实验组与其他实验组之间均具有显著差异(P<0.01)(图3(g))。而浓度为2.0 mgL-1和2.5 mg·L-1时,混交雌体生产量被显著提高,而0.5、1.0、1.5和3.0 mg·L-1与对照组之间无明显差异(图3(h))。
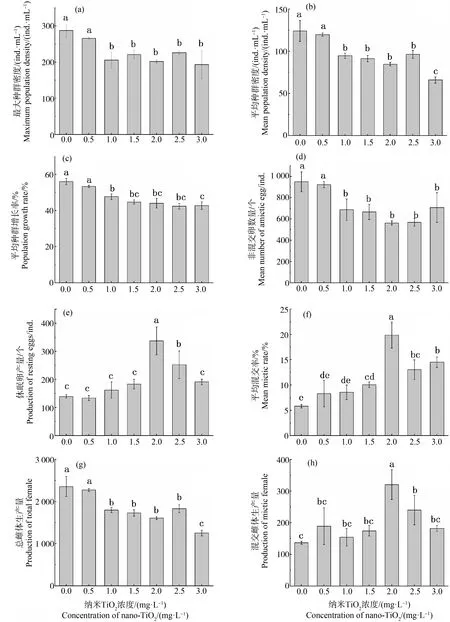
图3 不同纳米TiO2浓度下萼花臂尾轮虫的种群增长参数注:数据表示为平均值±标准偏差;经多重比较(SNK-q检验),不同小写字母表示种群参数差异显著(P<0.05)。Fig. 3 Population growth parameters of B. calyciflorus under different nano-TiO2 concentrationsNote: Data are expressed as Mean±SD; different lowercase letters indicate significant differences in population parameters, by multiple comparison analysis (SNK-q test).
3 讨论(Discussion)
起初,人们对于纳米材料的研究集中于功能应用,而随着研究的逐步深入,人们发现由纳米材料理化性质特殊性所引起的生物毒性效应不容忽视。近年来,世界卫生组织国际癌症研究机构公布的致癌物清单中,TiO2也被列入2B类致癌物参考列表。由于尺寸小,比表面积大,使其更易与环境中污染物结合,从而对生物产生潜在威胁[36-37]。
当纳米TiO2进入水生态系统,水体理化因子(如pH、离子强度、浊度、溶解性有机碳和总有机物等)和水生生物(如细菌和浮游植物)数量,均对纳米TiO2的水环境行为产生影响[38-40]。由于上述原因,导致纳米TiO2实际尺寸参数与商家提供信息不一致。本实验所用纳米TiO2经超声悬浮分散至EPA培养基,由TEM图像和Zeta电位检测结果可知,纳米TiO2在悬浮液中不稳定,可发生聚集或沉淀,其实际直径大于商家所提供的产品参数。
轮虫普遍存在于各类水体中,以藻类、原生动物和细菌等为食,同时又是其他水生动物(如鱼类)的食物[41]。因而,轮虫在食物链中起着承上启下的作用。此外,由于世代周期短、易于单克隆培养且对毒物敏感性强,已成为生态毒理学实验的良好受试生物[42-44],常用的轮虫种类有萼花臂尾轮虫和褶皱臂尾轮虫[45]。急性毒性研究表明,纳米金属材料暴露对浮游动物尤其是轮虫的存活率具有影响,如Rotini等[46]的研究表明,纳米CuO可抑制褶皱臂尾轮虫游泳能力并致其死亡,其48 h-LC50值为(16.94±2.68) mg·L-1。
本研究中,采用旋转混匀仪使纳米TiO2在培养基中均匀分布,在(23±1) ℃、食物密度为2.0×106cells·L-1时,纳米TiO2对萼花臂尾轮虫的48 h-LC50值为30.20 mg·L-1。Khoshnood等[47]和Zhu等[48]的研究结果表明,直径为20 nm的纳米TiO2对大型溞的48 h-LC50值分别为171.88 mg·L-1和143.39 mg·L-1。Clément等[24]的研究结果表明,直径25 nm纳米TiO2对褶皱臂尾轮虫48 h-LC50值为10.43 mg·L-1。可见,萼花臂尾轮虫对纳米TiO2的敏感性较褶皱臂尾轮虫轮虫弱,但比浮游动物大型溞强。因而,在淡水水环境生物监测尤其是对纳米TiO2的生物监测中,萼花臂尾轮虫是较为理想的受试生物。
纳米材料对浮游动物的慢性毒性效应主要表现在对浮游动物生殖力、种群增长率、形态和行为等方面的影响[49-50]。本实验结果表明,当浓度≥1 mg·L-1时,纳米TiO2对萼花臂尾轮虫最大种群密度、平均种群增长率以及平均种群密度均具有显著影响(P<0.05),且轮虫达到最大种群密度的时间更短;在纳米TiO2最高浓度下(3.0 mg·L-1),实验后期的轮虫种群密度下降更快速。同时,当浓度≥1.0 mg·L-1时,萼花臂尾轮虫种群平均携带非混交卵数目显著降低(P<0.05)。可见,纳米TiO2对萼花臂尾轮虫种群密度及种群增长率具有抑制作用,而引起此现象的原因可能为纳米TiO2显著降低了萼花臂尾轮虫携带非混交卵个体的数目,进而抑制了种群繁殖力。有关纳米材料对浮游动物种群动态的研究较少,Noss等[51]研究发现,与对照组和1 mg·L-1实验组相比,暴露于5 mg·L-1和20 mg·L-1的纳米TiO2(直径61 nm)悬浮液中96 h的大型溞,生长速率显著下降(P<0.05)。Mackevica等[52]的研究表明,较高浓度的纳米Ag暴露会以剂量依赖性的方式降低大型溞的生长和繁殖,而引起繁殖力下降的原因可能是大型溞所携带的卵数减少。Zhao和Wang[53]也指出,当Ag纳米粒浓度由5 μg·L-1提高至50 μg·L-1时,母体平均产子代数由(65.9±8.6)代减少到(57.8±5.9)代,该结果具有显著性差异。Wang等[54]也得出类似结果,即随着纳米Cu2O浓度升高,子代数量由169代降低到62代。由上述实验结果可知,纳米材料对大型溞生长和繁殖均具有抑制作用,此结果与本实验结果具有一致性。
由休眠卵产量和混交率结果可知,纳米TiO2对萼花臂尾轮虫有性生殖具有显著影响。Pourriot和Snell[55]指出休眠卵的形成与众多的内源性和外源性因素有关,如种群混交雌体百分率、受精卵以及产休眠卵的混交雌体生产量等。就本实验结果而言,当浓度为2.0 mg·L-1和2.5 mg·L-1时,萼花臂尾轮虫休眠卵产量显著提高,而当浓度升高到3.0 mg·L-1时,其种群密度受到抑制程度增大,且到达峰值后下降迅速,可见该浓度下轮虫具有较高的死亡率。因而,产休眠卵的轮虫死亡率增加,进而导致该浓度下所产休眠卵数量与对照组无显著差异。简言之,随着纳米TiO2浓度的增加,轮虫总雌体生产量被逐渐抑制,而其混交率却显著提高,由此提高了单位体积内形成产休眠卵的混交雌体生产量。
将萼花臂尾轮虫长期暴露于不同浓度的纳米TiO2,研究其急性毒性及种群动态变化,揭示出:(1)纳米TiO2暴露对萼花臂尾轮虫48 h-LC50值为30.20 mg·L-1,相较于大型溞,萼花臂尾轮虫对纳米TiO2毒性更敏感;(2)萼花臂尾轮虫种群参数受到纳米TiO2的影响,当纳米TiO2泄露至自然水体后,可能改变轮虫以及其他浮游生物在淡水生态系统中的分布;(3)纳米TiO2暴露对萼花臂尾轮虫的有性生殖产生影响,进而改变种群性比关系及繁殖潜力。本研究结合种群生态学原理阐明了纳米TiO2对萼花臂尾轮虫种群动态的影响,但局限于本研究仅采用单种纳米材料,而复合纳米材料以及纳米TiO2与其他环境污染物的联合毒性仍有待进一步研究。
