纳米银在诺氟沙星胁迫下对黄孢原毛平革菌的毒物兴奋效应
2020-04-07丁文东崔康平郭志高斯研
丁文东,崔康平,郭志,*,高斯研
1. 合肥工业大学资源与环境工程学院,合肥 230009 2. 合肥工业大学纳米矿物与污染控制安徽普通高校重点实验室,合肥 230009
长期以来,纳米银(AgNPs)被广泛应用和研究。由于纳米材料具有小尺寸、宏观量子隧道和量子尺寸等效应,使得它们在生物学、医学和生物化学工程中的应用正在迅速扩展,并展现出其独特的环境效应和生物毒性[1-2]。然而,最近的研究结果表明,AgNPs并不总是起杀菌作用,低浓度的AgNPs会产生毒物兴奋效应,刺激微生物的生长。AgNPs浓度在最低致死浓度的12%~31%时能够对大肠杆菌产生毒物兴奋效应[3]。人纤维肉瘤细胞系HT-1080的活性在AgNPs浓度为0.78~6.25 mg·L-1时被刺激,在浓度≤0.39 mg·L-1和≥12.5 mg·L-1时被抑制[4]。同样,外周血淋巴细胞(PBMCs)和精原干细胞系C18-4的活性也会随AgNPs浓度的变化产生低浓度刺激、高浓度抑制的现象[5-6]。毒物兴奋效应(Hormesis)最初起源于毒理学,超过一定范围的高剂量有毒因子可能对生物体有害,而一定范围内的低剂量有毒因子可能对生物体有益,刺激微生物生长。目前,AgNPs的“毒物兴奋效应”机理尚不清楚,有待进一步研究。
诺氟沙星(NOR)是废水中常见的氟喹诺酮类药物[7]。抗生素对微生物降解有很强的抵抗力,由于其强吸附特性,可能会在水中持续存在[8]。环境中存在的抗菌化合物令人担忧,主要是因为长期暴露在亚治疗剂量下可能会为微生物提供选择性压力[9]。在环境中检测到的氟喹诺酮类药物(环丙沙星、诺氟沙星和氧氟沙星)最大浓度可达到7 560 ng·L-1[10]。这些化合物会破坏水中重要的生物过程,并对水生和陆生生物构成潜在威胁,是环境中的重要毒性胁迫来源[11]。
黄孢原毛平革菌(Phanerochaetechrysosporium)是一种典型的白腐真菌菌株,具有降解有机污染物的功能,是水处理过程中常用的微生物,所以本研究选择其作为受试微生物。通过不同浓度AgNPs对诺氟沙星胁迫下的黄孢原毛平革菌存活率影响的比较,监测刺激过程中溶液中总银浓度的变化以及细胞外蛋白质含量的变化,并借助扫描电镜、X射线衍射和傅里叶红外光谱分析菌丝球表面的变化,从而探究AgNPs产生毒物兴奋效应的原因。
1 材料与方法(Materials and methods)
1.1 实验材料
黄孢原毛平革菌AF-96007菌株购于中国典型培养物保藏中心(武汉),并保持在4 ℃下储存在马铃薯葡萄糖琼脂培养基中,通过将孢子刮到灭菌的超纯水中,将悬浮液的浓度调节至2.0×106CFU·mL-1。然后将孢子悬浮液接种到液体培养基中,在37 ℃和150 r·min-1的培养箱中培养3 d。其中,马铃薯葡萄糖琼脂培养基:马铃薯提取物200 g·L-1,葡萄糖20 g·L-1,琼脂20 g·L-1,KH2PO43 g·L-1,MgSO4·7H2O 1.5 g·L-1,维生素B18 g·L-1。液体培养基:酒石酸铵0.211 g·L-1,葡萄糖11.098 g·L-1,KH2PO40.2 g·L-1,MgSO4·7H2O 0.05 g·L-1,CaCl20.01 g·L-1,NaAc 1.641 g·L-1,维生素溶液0.5 mL,无机盐溶液1 mL。所有培养基使用前均在121 ℃湿热灭菌30 min。诺氟沙星和AgNO3纯度均>98%,购自Sigma-Aldrich(上海)有限公司,所用其他化学品均为分析纯,由国药化学试剂有限公司提供。
1.2 AgNPs的制备与表征
参照本课题组之前使用的制备方法[12]。在冰浴下,将4 mL质量分数为0.3%的聚乙烯吡咯烷酮(PVP)溶液、12 mL 15 mmol·L-1的硼氢化钠溶液与233 mL水混合,然后加入5 mL的40 mmol·L-1的AgNO3溶液,室温搅拌反应2 h;用1 kDa透析袋,将所得颗粒悬浮液用超纯水透析,去除多余的PVP和Ag离子,即获得PVP-AgNPs的分散液,于4 ℃冰箱中储存备用。
本研究采用火焰石墨炉原子吸收分光光度计(AAnalyst 800,PE公司,美国)测定了所制备的AgNPs的浓度,并利用紫外可见分光光度计(UV-2550,岛津公司,日本)、Zeta电位仪(Nano-ZS90,Malvern公司,英国)来表征所合成的银纳米材料的紫外可见吸收峰、流体动力学直径和表面电荷。
1.3 AgNPs对诺氟沙星胁迫下的真菌存活率实验
培养3 d后的黄孢原毛平革菌菌丝球在10 000 r·min-1离心5 min,并用2 mmol·L-1NaHCO3缓冲液清洗2遍,等量的菌丝球(0.5 g)分装到各个试管中。将菌丝球进行以下3组处理。(1)诺氟沙星胁迫组:分别加入诺氟沙星,使实验溶液中的诺氟沙星浓度为0、1、5、10和20 mg·L-1;(2)AgNPs处理组:在5 mg·L-1诺氟沙星的胁迫下,分别加入AgNPs,使试验溶液中的AgNPs浓度为0、0.001、0.01、0.13和1.3 mg·L-1;(3)AgNO3处理组:在5 mg·L-1诺氟沙星的胁迫下,分别加入AgNO3,使试验溶液中的AgNO3浓度为0、0.001、0.01、0.13和1.3 mg·L-1。染毒24 h后,采用MTT比色法[13],测定反应后的上清液在534 nm处的吸光度,并以与对照组的相对百分比表示黄孢原毛平革菌的存活率。
1.4 胞外蛋白质浓度测定
实验中,取2 mL样品于离心管中,在5 000 r·min-1的转速下离心15 min,然后取出1 mL上清液用于胞外蛋白的测定。在该1 mL样品中加入5 mL考马斯亮兰染色液试剂,混匀,室温静置3 min后,于波长595 nm处比色,读取吸光度,由样品的吸光度值查标准曲线即可求出蛋白质的含量。
1.5 溶液中总银浓度测定
为了解AgNPs以及Ag离子在体系中的迁移转化,需要在AgNPs与Ag离子对黄孢原毛平革菌的活性影响实验中取出样品来测定总银浓度,在测定之前,将从各个时间点取出的试样利用硝酸和过氧化氢进行消解[14],再采用电感耦合等离子体质谱仪(ICP-MS)(Agilent 7500,安捷伦科技(中国)有限公司,美国)对溶液中的总银进行定量分析。
1.6 菌丝球表面分析
对正常培养组(空白组)、5 mg·L-1诺氟沙星胁迫组(对照组)、5 mg·L-1诺氟沙星以及1.1 mg·L-1AgNO3胁迫组(Ag离子处理组)、5 mg·L-1诺氟沙星以及0.01 mg·L-1AgNPs胁迫组(AgNPs处理组)中的黄孢原毛平革菌菌球,分别进行扫描电镜及能谱分析(FEI Quanta-400,Fei公司,荷兰)、X射线衍射分析(D8 Discover-2500,Bruker公司,德国)以及傅里叶红外光谱分析(WQF-410,北京瑞利分析仪器公司,中国)。
2 结果(Results)
2.1 AgNPs的表征
由图1(a)可知,所制备的PVP-AgNPs在波长为397 nm处有较强的特征吸收峰,这一结果与此前合成的AgNPs的结果一致[12]。且PVP-AgNPs在2 mmol·L-1NaHCO3缓冲液中测定的Zeta电位是(-17.8±0.6) mV,动态光散射仪测出的氢动力学粒径是(76.4±5.6) nm。由图1(b)可知,合成的AgNPs粒径分布范围较广,可能是由于AgNPs之间发生了团聚。此外,经火焰原子吸收光谱法检测,所得分散液中,PVP-AgNPs的浓度为18.38 mg·L-1(0.17 mmol·L-1)。

图1 纳米银(AgNPs)的表征:(a) AgNPs的紫外可见吸收光谱;(b) AgNPs流体动力学平均直径分布直方图Fig. 1 Characterization of synthesized Ag nanoparticles (AgNPs): (a) UV-Vis absorption spectrum of AgNPs; (b) histogram of hydrodynamic diameter distribution of AgNPs
2.2 黄孢原毛平革菌活性分析
由图2(a)所示,在诺氟沙星处理组中,随着诺氟沙星胁迫浓度的增加,细胞活性逐渐降低。由图2(b)所示,在AgNO3处理组中,细胞活性也同样随着Ag离子浓度的升高呈现降低趋势,这与诺氟沙星单独胁迫的情况相似,Ag离子浓度在0.13 mg·L-1和1.3 mg·L-1时,细胞活性稳定于29%,与对照组的55%相比,活性降低47%,可能由于在较高浓度毒物刺激下真菌可以利用诺氟沙星作为碳源和能源抵御环境中的不利因素[15],导致其活性不再降低。
如图2(c)所示,较高浓度的AgNPs(0.13 mg·L-1和1.3 mg·L-1)处理组中,由于AgNPs以及诺氟沙星的毒性胁迫作用,导致黄孢原毛平革菌的细胞活性明显降低,最低仅为20%,与对照组相比,活性降低64%。而在0.001 mg·L-1和0.01 mg·L-1时,AgNPs明显刺激了黄孢原毛平革菌的细胞活性,分别提高到71%和83%,即活性分别提高1.29倍与1.51倍,这表明,AgNPs的这种毒物兴奋效应刺激黄孢原毛平革菌对环境中的不利因素做出抗性反应。

图2 不同暴露组对黄孢原毛平革菌活性的影响注:空白组为正常培养组,对照组为5 mg·L-1诺氟沙星胁迫组。Fig. 2 Effects of different groups of exposure on the cell viability of Phanerochaete chrysosporiumNote: Blank is normal cultured group; control is 5 mg·L-1 norfloxacin stress group.
2.3 胞外蛋白浓度的变化
AgNO3处理后的胞外蛋白质浓度的变化情况如表1所示,与空白组对比分析,Ag离子的刺激致使胞外蛋白浓度出现不同程度的降低,且当AgNO3浓度从0.01 mg·L-1增加到6.5 mg·L-1,胞外蛋白质浓度逐渐降低,说明Ag离子的增加导致胞外蛋白的消耗,同时表明Ag离子浓度的增加对黄孢原毛平革菌的毒性增加。而对于AgNPs处理组,如表2所示,胞外蛋白质的浓度在较低浓度AgNPs的刺激下(0.001~0.01 mg·L-1)大部分高于对照组,这表明,低浓度AgNPs在外界胁迫下可以刺激细胞产生较多的胞外蛋白质。在较高AgNPs浓度的刺激下,相比于同浓度的Ag离子处理组,胞外蛋白质随时间的增加消耗更多。
2.4 溶液中总银浓度的变化
如图3(a)所示,对于所有的实验组,溶液中总银浓度在前12 h大体呈现出降低的趋势,这表明,AgNPs和其他形式的银从溶液相迁移至生物相,且它们迁移得非常迅速,这可能是AgNPs会与黄孢原毛平革菌表面产生的生物大分子发生络合作用或者与官能团结合,从而使溶液中总银浓度下降[16]。而在12 h后,溶液中总银浓度的变化差异性较大,在1.3 mg·L-1AgNPs的刺激下,其所有形式的银继续从溶液相迁移至生物相,导致溶液中总银浓度缓慢下降,在108 h后的总银浓度降至初始浓度的3%。在0.001、0.01和0.13 mg·L-1AgNPs的刺激下,其所有形式的银反而从生物相迁移至溶液相,引起溶液中总银浓度较快上升,并且初始浓度越低这种变化的趋势越明显,在108 h后总银浓度为初始浓度的84%、68%和43%。
如图3(b)所示,AgNO3初始浓度从0.001 mg·L-1增加至1.3 mg·L-1,黄孢原毛平革菌对溶液中总银的去除均达到95%以上。可以发现,在开始的12 h内,溶液中的总银浓度基本上达到最低,而随着AgNO3浓度的增大,吸附的速度越快,这种增加的趋势可能是由于AgNO3浓度的增加使之有更大的驱动力克服黄孢原毛平革菌与液相之间的传质阻力,使得黄孢原毛平革菌与Ag离子之间的碰撞几率更高,Ag离子更容易渗透到吸附位点,从而促进了总银的吸附[15]。

图3 不同暴露组溶液中总银浓度的变化Fig. 3 The total Ag concentration in solution in different exposure groups
2.5 扫描电镜的表征
由图4(a)可知,空白组中黄孢原毛平革菌的菌丝相互交织成网状结构,且菌球表面的菌丝光滑、干净,没有任何颗粒状的物质附着在菌丝上,菌丝间有间隙,这样的结构有利于其对AgNPs的束缚。如图4(b)所示,对照组明显可见黄孢原毛平革菌的菌丝断裂和菌球破裂,表面粘附有少量分泌物质,表明黄孢原毛平革菌的细胞受到诺氟沙星的严重损伤。如图4(c)所示,用低剂量AgNPs处理后的菌丝体的菌丝体表面散落着少量的颗粒状物质,部分AgNPs可通过细胞膜进入细胞。根据能谱分析(图4(e)),确定菌丝表面的这些纳米级别的颗粒物是与含硫蛋白质结合的AgNPs。如图4(d)所示,在AgNO3处理组中,黄孢原毛平革菌菌丝体表面附着着大量的晶体颗粒,根据能谱分析(图4(f)),这些颗粒为纳米级的氯化银和硫化银。

图4 黄孢原毛平革菌表面的扫描电镜(SEM)图和能量色散X射线光谱(EDX)分析注:(a)空白组;(b)对照组;(c)AgNPs处理组;(d)AgNO3处理组;(e)为(c)图中标记区域的EDX;(f)为(d)图中标记区域的EDX。Fig. 4 The scanning electron microscope (SEM) micrographs and energy dispersive X-ray spectroscopy (EDX) analysis of Phanerochaete chrysosporium surfacesNote: (a) blank group; (b) control group; (c) AgNPs treatment group; (d) AgNO3 treatment group; (e) EDX of denoted area in (c); (f) EDX of denoted area in (d).
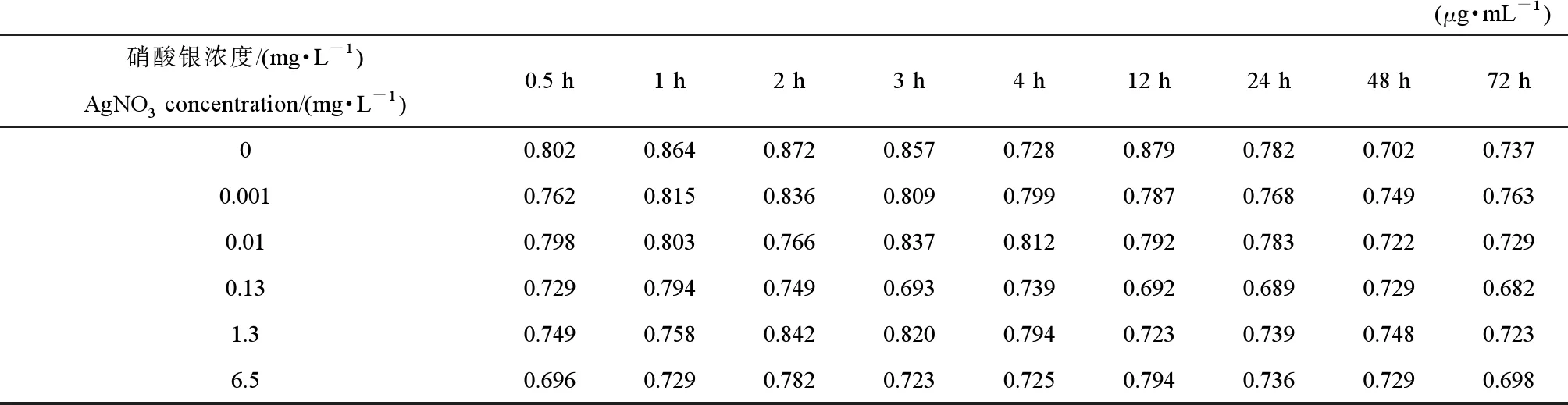
表1 不同浓度硝酸银(AgNO3)对细胞外蛋白浓度的影响Table 1 Changes in extracellular protein concentrations at different concentrations of silver nitrate (AgNO3)
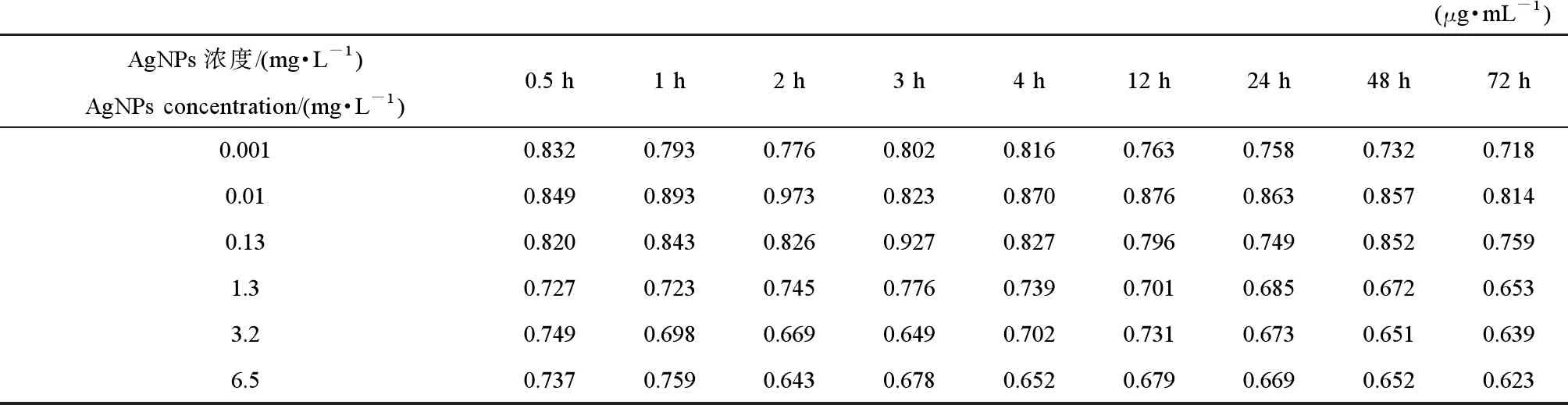
表2 不同浓度AgNPs对细胞外蛋白浓度的影响Table 2 Changes in extracellular protein concentrations at different concentrations of AgNPs
2.6 X射线衍射分析
由图5(b)可知,AgNO3处理组展示出强烈的X射线衍射(XRD)峰,这些2倍衍射角值分别隶属于合成纳米氯化银晶体(111), (200), (220), (311), (222)和(400)晶面的特征衍射信号。反观AgNPs处理组(图5(a)),并没有发现明显的硫化银晶体晶面的特征衍射信号,但是扫描电镜的能量色散X射线光谱(EDX)分析中可明显看出有S元素存在,由此推测,菌丝表面的含硫基团并不能有效的束缚住AgNPs,AgNPs可从生物相转移至液相。此外,经AgNPs处理后黄孢原毛平革菌表面的XRD图像显示,在20°左右有明显的衍射峰,这可能是由于合成的AgNPs微晶结构的无序排列[17],这表明,低浓度的AgNPs在黄孢原毛平革菌和诺氟沙星共存体系中形成为一种典型的非晶态材料,这种无定形状态可能也是AgNPs进出细胞的原因。
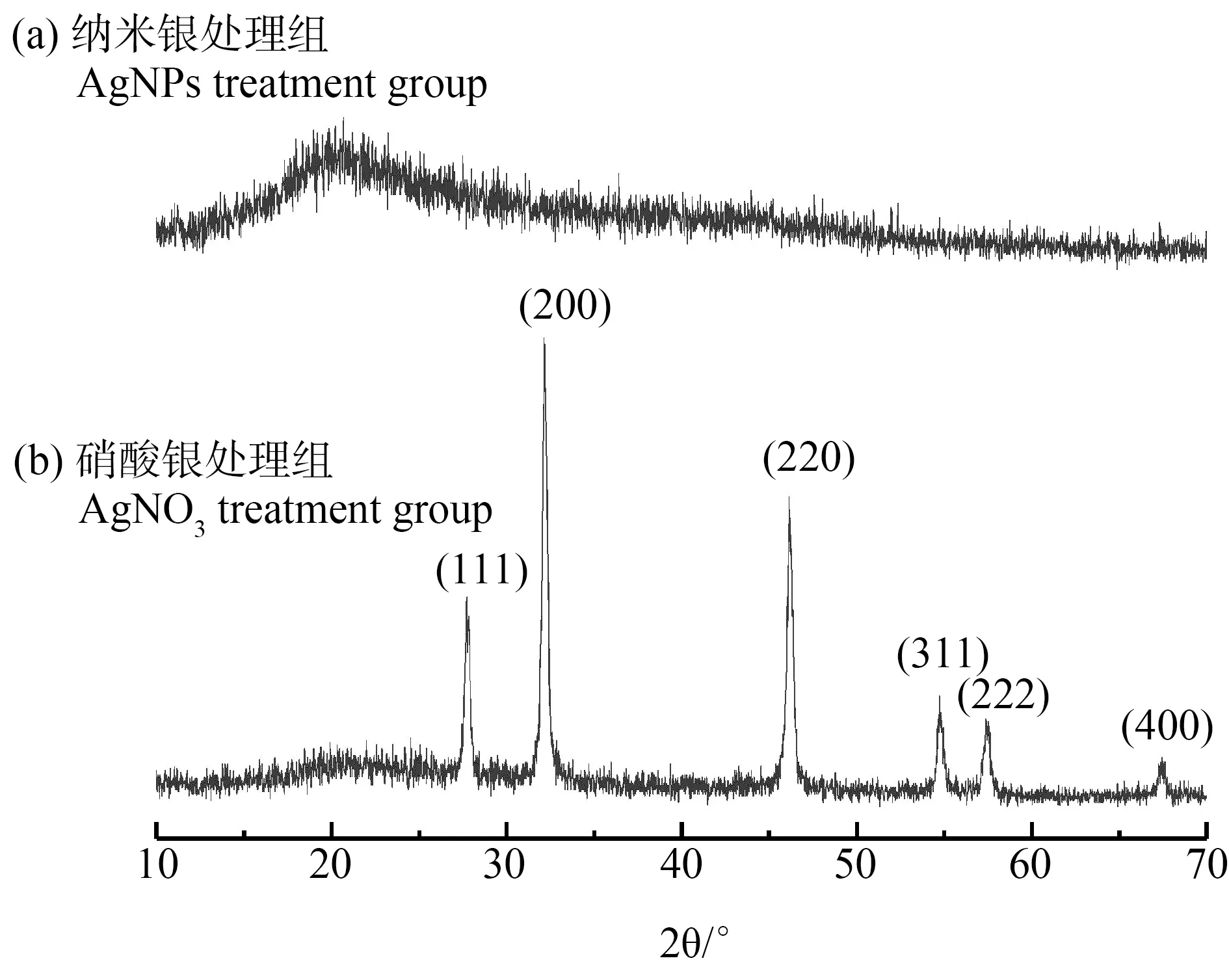
图5 AgNO3和AgNPs处理后黄孢原毛平革菌样品的X射线衍射(XRD)图谱Fig. 5 X-ray diffraction (XRD) pattern of Phanerochaete chrysosporium sample impregnated with AgNPs and AgNO3
2.7 傅里叶红外变换光谱分析
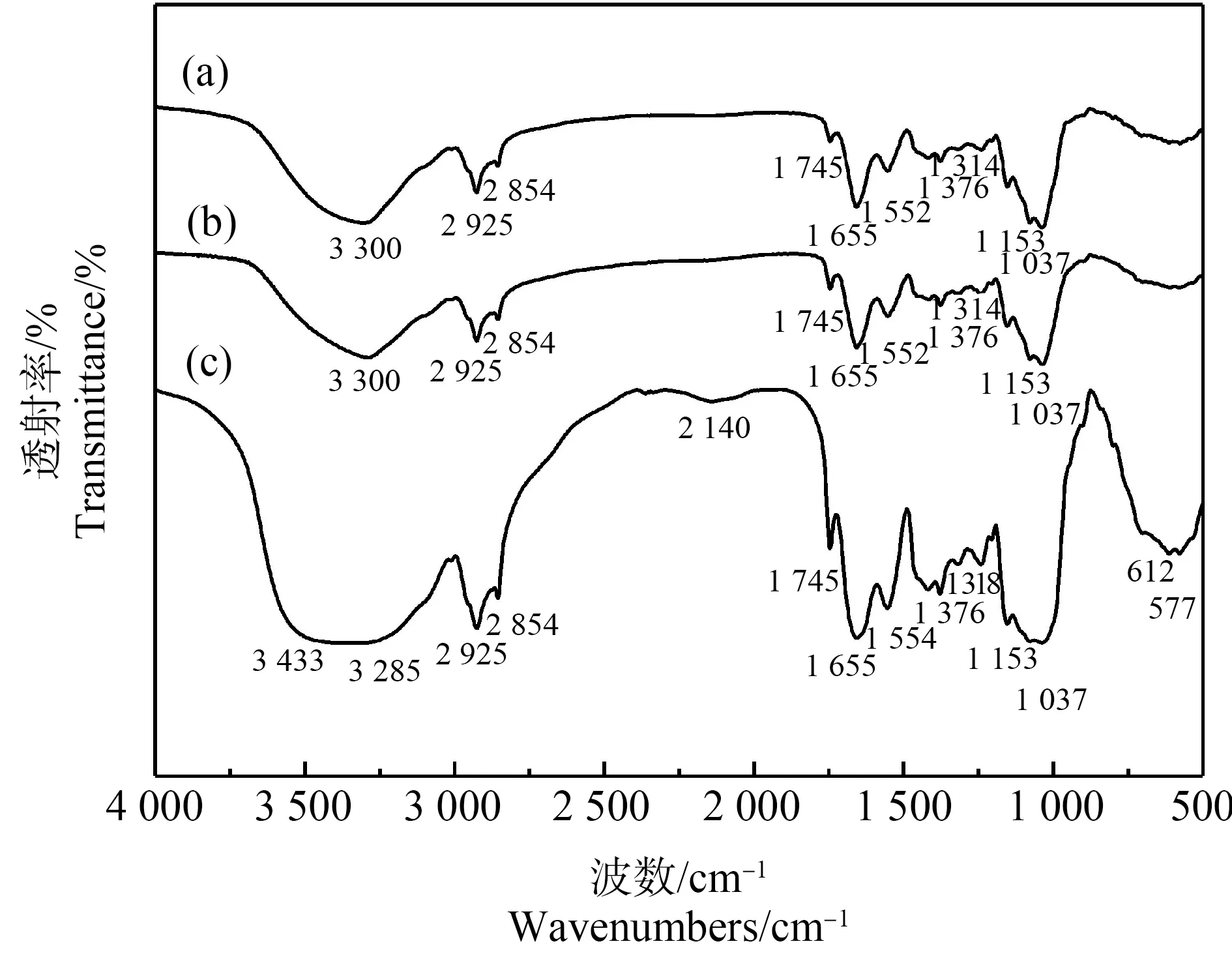
图6 (a)对照组、(b)AgNO3处理组和(c)AgNPs处理组中黄孢原毛平革菌的傅里叶红外变换光谱(FTIR)图Fig. 6 The Fourier transform infrared spectroscopy (FTIR) spectra of (a) control, (b) AgNO3-treated and (c) AgNPs-treated Phanerochaete chrysosporium
3 讨论(Discussion)
在一定范围内(0.001~0.01 mg·L-1)的低剂量AgNPs不会对细胞产生不利影响,反而会增强细胞活性,抵抗环境中不利因素诺氟沙星的胁迫。AgNPs的这种毒物兴奋效应可能是由于低浓度激活了毒性损伤的修复机制,这种修复过程可能对毒物的暴露进行过度补偿,从而导致细胞活性显著增加[23]。AgNO3处理组中,Ag离子浓度的增加使得黄孢原毛平革菌在诺氟沙星的胁迫下活性降低,高浓度的AgNPs可能也是通过氧化溶解释放出大量Ag离子从而对细胞产生抑制作用。
由于Ag离子以及诺氟沙星的毒性随着暴露时间的增加而增强,使细胞产生较多的胞外蛋白质保护细胞免受损伤,但在随后的时间里,胞外蛋白质可被黄孢原毛平革菌用作氮源而被消耗[15],使得其浓度随着暴露时间的增加而降低。AgNPs可以触发细胞生物学特性的变化,从而影响细胞的吸收和生物活性。此外,它们会引起结合蛋白的结构、功能和亲和力的变化[24],从而促使黄孢原毛平革菌更好地应对环境中毒性物质的胁迫。研究表明,AgNPs可以通过与蛋白质相互作用来减轻抑制作用,胞外蛋白质中含有羟基、氨基和羧基等多个官能团,这些官能团可以通过静电斥力、空间位点以及溶剂化力与AgNPs相互作用[25]。AgNPs通过释放Ag离子产生毒性[26],从而刺激真菌细胞产生更多的含硫蛋白质和相关基团对环境中的Ag离子进行吸附结合,进而消耗胞外蛋白。
在水生系统中,真菌表面的有机物质能通过影响AgNPs的理化性质,改变其聚集沉降状态,从而影响AgNPs在环境中的迁移转化、生物利用度及生物毒性等[27]。AgNPs可以通过胞吞作用积极地进入细胞[28],使其从溶液相进入生物相,又由于低剂量AgNPs浓度远低于致死量反而刺激黄孢原毛平革菌将毒性物质排出胞外,使得AgNPs又从生物相进入溶液相,最终维持一个较为稳定的水平,较好地抵御外部不利因素。
黄孢原毛平革菌表面所分泌的羟基、醛、酮和巯基等官能团能为Ag离子提供还原位点[29],使Ag离子转化为纳米硫化银和纳米氯化银,由于膜屏障的作用,这些AgNPs颗粒在菌丝体上积累,并包覆住整个菌丝体,同时也验证了溶液中所有形式的银确实从溶液相迁移到黄孢原毛平革菌的菌丝表面。
综上所述,本研究表明:
(1)AgNPs对诺氟沙星胁迫下的黄孢原毛平革菌活性具有低浓度刺激、高浓度抑制作用。AgNPs在0.001 mg·L-1和0.01 mg·L-1浓度下可以将黄孢原毛平革菌的细胞活性分别提高1.29倍与1.51倍,而在1.3 mg·L-1AgNPs的刺激下,细胞活性降低64%。相同浓度的Ag离子仅对细胞产生毒性抑制作用。
(2)黄孢原毛平革菌利用并消耗其表面的蛋白质来应对Ag离子产生的毒性。低浓度AgNPs可以触发细胞生物学特性的变化,刺激细胞在面临诺氟沙星胁迫时产生较多的胞外蛋白质,从而促使黄孢原毛平革菌更好地应对环境中毒性物质的胁迫。
(3)通过扫描电镜以及能谱分析,并结合XRD和傅里叶红外变换光谱分析,低剂量AgNPs可在溶液相与生物相之间进行迁移,其晶体在细胞表面呈无定形状态。黄孢原毛平革菌的菌丝表面存在的羟基、醛、酮和巯基等官能团能为环境中Ag离子提供还原位点,还原成纳米硫化银和纳米氯化银颗粒,其被阻挡在细胞外,包覆住菌丝体。
AgNPs的迁移转化以及刺激胞外蛋白质的产生让我们对毒物兴奋效应有了更深刻的认识,并且让我们在应用AgNPs时,需要对低浓度AgNPs抗菌性重新审视,当AgNPs作为污染物进入环境时,AgNPs对抗生素诺氟沙星的抗菌性的影响也需要重新考量。此外,在此基础上有必要进一步探究低浓度AgNPs对水环境中残余抗生素的处理效果,为开发一种抗生素污染物的生物处理方法提供新思路。
