2-(溴甲基)-3-取代丙烯酸酯的合成及生物活性研究
2020-04-06杨桂秋
廖 桥,杨桂秋
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
Baylis-Hillman反应以其温和的反应条件和100 %的原子利用率多年来受到广大化学研究者的青睐,在如今提倡绿色化学的大环境下,对该反应及其产物和衍生物的研究有重要意义.近年来,Baylis-Hillman反应在催化剂方面逐渐寻得更高效的有机胺、有机膦催化剂或混合催化体系[1],而且手性胺[2]、手性膦[3]和金属有机[4]催化剂在该反应中的应用也已见诸文献报道;在溶剂方面,水-离子液体的复合体系作为新型的复合溶剂可以加快反应的进程[5-6].Baylis-Hillman加成产物具有多个活性官能团,其衍生物(溴化、乙酰化)具有很好的应用前景,已成功应用于氢化[7]、环化[8-9]、烯丙基烷基化[10]等反应.本文将Baylis-Hillman加成物溴化得到溴代产物,又对其进行了杀虫、杀菌活性测试,期望发现结果新颖且具有生物活性的新型先导化合物.
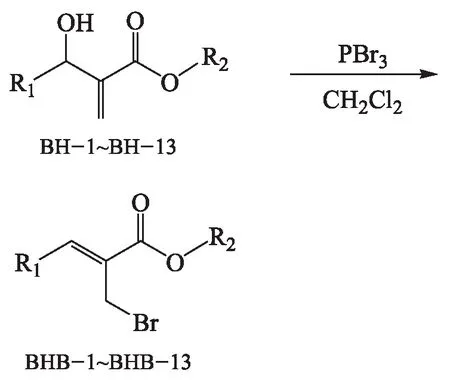
化合物BHB具体合成路线如下:
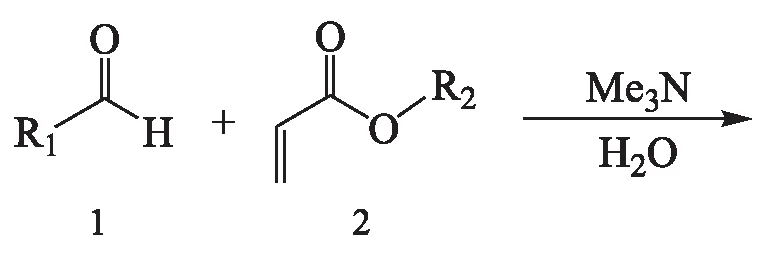
1 实验部分
1.1 仪器与试剂
ZF-Ⅰ型三用紫外分析仪,上海顾村电光仪器厂;Mercury 300(Varian)型和Bruker 600 AVⅢ HD核磁共振波谱分析仪,溶剂CDCl3,内标TMS; Buchi B-545熔点测定仪,瑞士Buchi公司;H(60型)柱层析硅胶,青岛海洋化工厂.所有试剂均为市售分析纯.
1.2 实验过程
1.2.1 2-(羟基)甲基丙烯酸酯(化合物BH)的合成
参考文献[11]方法,将 30 mmol醛(化合物1)、40 mmol质量分数为33 %的三甲胺水溶液(或6 mmol 1,4-二氮杂二环[2.2.2]辛烷)和 90 mmol 丙烯酸酯(化合物2)加入到10 mL醇(甲醇或乙醇)溶剂中.室温搅拌,薄层色谱法确定反应终点.反应结束后,用二氯甲烷萃取,有机层水洗,无水硫酸镁干燥,减压脱溶.残余物经硅胶柱色谱分离,得到2-(羟基)甲基丙烯酸酯(化合物BH).
1.2.2 2-(溴甲基)-3-取代丙烯酸酯(化合物BHB)的合成
以化合物BHB-1的合成为例.在0 ℃将对应的化合物BH-1(1.9 g,8 mmol)溶于10.0 mL二氯甲烷,滴加含三溴化磷(2.2 g,8 mmol,质量分数98 %)的10 mL二氯甲烷溶液,50 min滴完,搅拌30 min,反应混合物慢慢倒入100.0 mL冰水中,25.0 mL二氯甲烷萃取3次,合并油层,用40.0 mL水洗1次,无水硫酸镁干燥,过滤,用旋转蒸发仪减压蒸馏脱除溶剂,得粗产品,然后用V(乙酸乙酯)/V(石油醚)=1/7的洗脱剂进行柱色谱分离,减压蒸馏脱除溶剂,得到2.3 g白色固体,即化合物BHB-1,收率为96 %.
1.3 目标化合物BHB的活性测试
药液配制:取25 mL丙酮/甲醇(体积比1∶1)的混合溶剂加入到盛有30 mg待测化合物的容量瓶中,搅拌使其充分溶解,加入25 mL含有2‰(质量分数,下同)吐温80的静置自来水,搅拌均匀后得到600 mg/L的新化合物溶液50 mL.经再稀释可以得到不同质量浓度的化合物溶液.
空白对照:以丙酮/甲醇/水(体积比1∶1∶2,含1 ‰吐温80)处理.
实验材料、喷药处理、调查方法等参考文献[12-14]方法.按0~100分级,0表示无活性,100表示全部杀死或防制效果为100 %.
2 结果与讨论
2.1 目标化合物BHB
选择3-位芳环、杂环、烃基取代的Baylis-Hillman加成物为原料,所合成目标化合物的具体结构与性状见表1.从表1可以看出:以3-位芳环、烃基取代的Baylis-Hillman加成物为原料进行溴化,收率较高;3-位杂环取代获得的收率相对较低.所合成的目标化合物BHB均经1H NMR 确认结构.
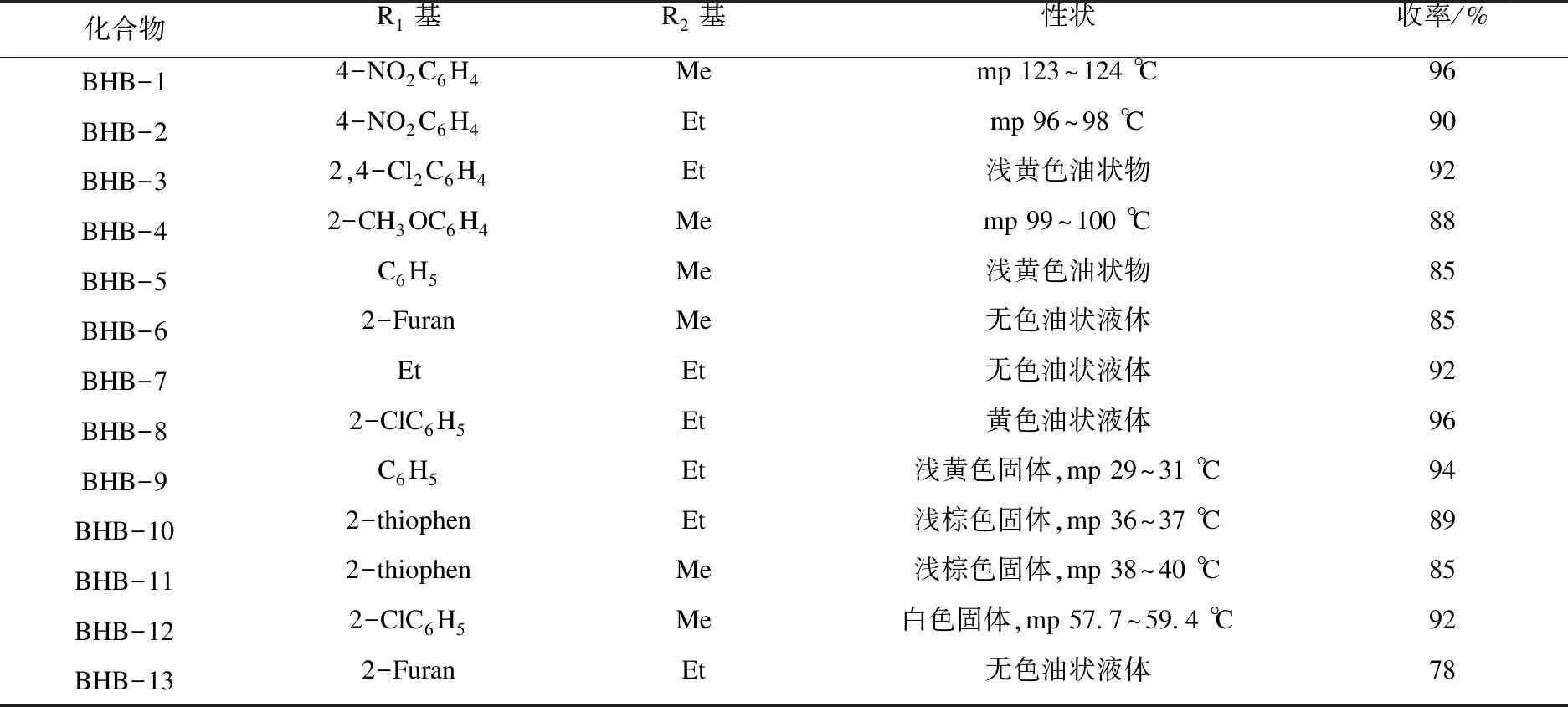
表1 2-(溴甲基)-3-取代丙烯酸酯(化合物BHB)的合成Table 1 Synthesis of 2-(bromomethyl)-3-substituted acrylate(compound BHB)
2-(溴甲基)-3-(4-硝基苯基)丙烯酸甲酯(化合物BHB-1),1H NMR(300 MHz,CDCl3),δ:3.92(s,2H,CH2Br),4.31(s,3H,CO2CH3),7.73(d,2H,J=9.0 Hz,Ar—H),7.83(s,1H,Ar—CH===C),8.33(d,2H,J=9.0 Hz,Ar—H).
2-(溴甲基)-3-(4-硝基苯基)丙烯酸乙酯(化合物BHB-2),1H NMR(300 MHz,CDCl3),δ:1.40(t,3H,J=7.5 Hz,OCH2CH3),4.31(s,2H,CH2Br),4.39(q,2H,J=7.5 Hz,OCH2CH3),7.73(d,2H,J=8.4 Hz,Ar—H),7.82(s,1H,Ar—CH===C),8.33(d,2H,J=8.4 Hz,Ar—H).
2-(溴甲基)-3-(2,4-二氯苯基)丙烯酸乙酯(化合物BHB-3),1H NMR (300 MHz,CDCl3),δ:1.39(t,3H,J=7.2 Hz,CH2CH3),4.24(s,2H,CH2Br),4.36(q,2H,J=7.2 Hz,CH2CH3),7.38(dd,1H,J=1.8 Hz、8.4 Hz,Ar—H),7.48(d,1H,J=1.8 Hz,Ar—H),7.67(d,1H,J=8.2 Hz,Ar—H),7.83(s,1H,Ar—CH===C).
2-(溴甲基)-3-(2-甲氧基苯基)丙烯酸甲酯(化合物BHB-4),1H NMR(300 MHz,CDCl3),δ:8.03(s,1H,CH===C),7.69(d,1H,J=8.4 Hz,Ar—H),7.40(t,1H,J=8.4 Hz,Ar—H),7.07(t,1H,J=8.4 Hz,Ar—H),6.93(d,1H,J=8.4 Hz,Ar—H),4.37(s,2H,CH2Br),3.87~3.88(m,6H,CO2CH3,ArOCH3).
2-(溴甲基)-3-(苯基)丙烯酸甲酯(化合物BHB-5),1H NMR(300 MHz,CDCl3),δ:7.84(s,1H,Ar—CH===C),7.56~7.60(m,2H,Ar—H),7.42~7.49(m,3H,Ar—H),4.40(s,2H,CH2Br),3.89 (s,3H,OCH3).
2-(溴甲基)-3-(呋喃-2-基)丙烯酸甲酯(化合物BHB-6),1H NMR(300 MHz,CDCl3),δ:7.67(d,1H,J=1.5 Hz,Ar—H),7.51(s,1H,Ar—CH===C),6.85(d,1H,J=3.3 Hz,Ar—H),6.57(dd,1H,J=1.5 Hz、3.3 Hz,Ar—H),4.72(s,2H,CH2Br),3.86(s,3H,CO2CH3).
2-溴甲基戊-2-烯酸乙酯(化合物BHB-7),1H NMR(300 MHz,CDCl3),δ:6.97(s,1H,CH===C),4.20~4.30(m,4H,CH2Br,OCH2),2.27~2.37(m,2H,CH2—CH===C),1.33(t,3H,J=7.2 Hz,OCH2CH3),1.13(t,3H,J=7.5 Hz,CHCH2CH3).
2-(溴甲基)-3-(2-氯苯基)丙烯酸乙酯(化合物BHB-8),1H NMR (600 MHz,CDCl3),δ:7.91 (s,1H,Ar—CH===C),7.70 (dd,J=7.6 Hz、1.5 Hz,1H,Ar—H),7.44 (dd,J=7.6 Hz、1.5 Hz、1H,Ar—H),7.39~7.32 (m,2H,Ar—H),4.36 (q,J=7.1 Hz,2H,CH2CH3),4.27 (s,2H,CH2Br),1.39 (t,J=7.1 Hz,3H,CH2CH3).
2-(溴甲基)-3-(苯基)丙烯酸乙酯(化合物BHB-9),1H NMR (600 MHz,CDCl3),δ:7.82 (s,1H,Ar—CH===C),7.59~7.38 (m,5H,Ar—H),4.40 (s,2H,CH2Br),4.34 (q,J=7.1 Hz,2H,CH2CH3),1.38 (t,J=7.1 Hz,3H,CH2CH3).
2-(溴甲基)-3-(噻吩-2-基)丙烯酸乙酯(化合物BHB-10),1H NMR (600 MHz,CDCl3),δ:7.93 (s,1H,S—C—CH===C),7.63 (d,J=5.0 Hz,1H,S—C===CH),7.46 (d,J=3.7 Hz,1H,S—CH===CH),7.17 (dd,J=5.0 Hz、3.7 Hz,1H,S—CH===CH),4.59 (s,2H,CH2Br),4.33 (q,J=7.1 Hz,2H,CH2CH3),1.37 (t,J=7.1 Hz,3H,CH2CH3).
2-(溴甲基)-3-(噻吩-2-基)丙烯酸甲酯 (化合物BHB-11),1H NMR (600 MHz,CDCl3),δ:7.94 (s,1H,S—C—CH===C),7.64 (d,J=5.1 Hz,1H,S—C===CH),7.46 (d,J=3.7 Hz,1H,S—CH===CH),7.17 (dd,J=5.1 Hz、3.7 Hz,1H,S—CH===CH),4.58 (s,2H,CH2Br),3.87 (s,3H,CO2CH3).
2-(溴甲基)-3-(2-氯苯基)丙烯酸甲酯(化合物BHB-12),1H NMR (600 MHz,CDCl3),δ:7.92 (s,1H,Ar—CH===C),7.71 (dd,J=7.6 Hz、1.5 Hz,1H,Ar—H),7.45 (dd,J=7.6 Hz、1.5 Hz,1H,Ar—H),7.40~7.33 (m,2H,Ar—H),4.27 (s,2H,CH2Br),3.90 (s,3H,CO2CH3).
2-(溴甲基)-3-(呋喃-2-基)丙烯酸乙酯(化合物BHB-13),1H NMR (600 MHz,CDCl3),δ:7.66 (d,J=1.5 Hz,1H,O—CH===CH),7.49 (d,J=5.0 Hz,1H,O—C—CH===C),6.84 (d,J=3.5 Hz,1H,O—C===CH),6.57 (dd,J=3.5 Hz、1.5 Hz,1H,O—CH===CH),4.72 (s,2H,CH2Br),4.31 (q,J=7.1 Hz,2H,CH2CH3),1.36 (t,J=7.1 Hz,3H,CH2CH3).
2.2 生物活性测试结果
2.2.1 杀虫活性
在600 mg/L的剂量下测试所有目标化合物BHB对小菜蛾、桃蚜、朱砂叶螨及淡色库蚊的杀虫活性,测试结果如表2所示.
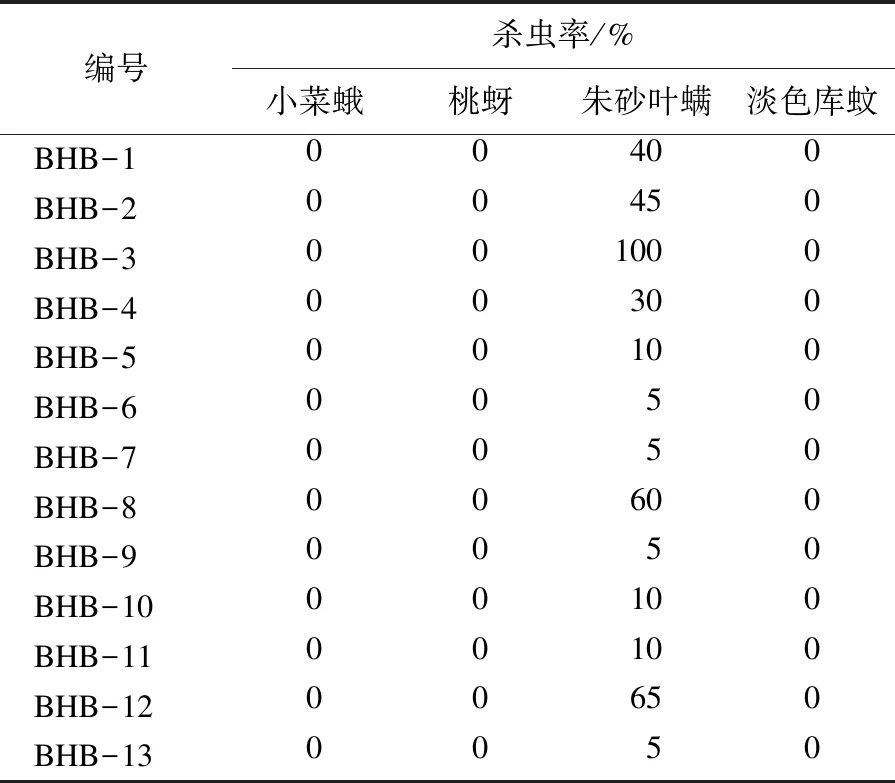
表2 化合物BHB的杀虫活性测试结果Table 2 Insecticidal activities of compounds BHB
杀虫活性结果发现:在600 mg/L测试浓度下,2-(溴甲基)-3-(2,4-二氯苯基)丙烯酸乙酯(化合物BHB-3)对供试靶标朱砂叶螨防效达100 %,其他化合物BHB对朱砂叶螨也有一定的防效,对其他供试靶标无防效.
2.2.2 杀菌活性
对部分目标化合物BHB进行杀菌活性测试,测试结果发现:在25 mg/L的剂量下所测试的化合物对番茄晚疫病(TLB)、稻瘟病(RB)、蔬菜灰霉病(CGM)、黄瓜霜霉病(CDM)均无杀菌活性,或活性较低.
3 结 论
以Baylis-Hillman加成物为原料,溴化合成了13个2-(溴甲基)-3-取代丙烯酸酯,经生物活性测试表明:该类化合物具有一定的杀虫活性,对供试靶标无杀菌活性.由于所合成的目标化合物具有多个可供修饰的官能团,可以更方便地作为设计及合成新化合物的中间体.
