激光光凝联合抗VEGF药物不同时机治疗糖尿病视网膜病变的疗效比较
2020-04-04毕双双马雪峰
毕双双,姜 涛 ,陈 颖,马雪峰
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)系糖尿病常见微血管并发症,视网膜新生血管形成为其主要病理机制,严重影响患者视功能[1]。视网膜激光光凝是临床公认治疗DR的有效手段,适宜于伴黄斑水肿的严重DR患者,包括严重非增殖性DR与增殖前期DR(preproliferative diabetic retinopathy,PPDR)[2]。但报道发现,激光光凝后仍有约33.3%的DR患者新生血管生成无法控制,可能继发视网膜牵拉或脱离、玻璃体积血等并发症,影响预后[3]。且激光为有创手段,对视网膜物理刺激大,反复视网膜激光光凝可能造成黄斑裂孔、黄斑水肿、视网膜脱离等严重并发症,或加重黄斑水肿,患者依从性差[4]。近年来有观点提出,抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物玻璃体腔内注射治疗眼底病变疗效肯定[5]。多项研究均证实,VEGF在DR发病中有关键作用,糖尿病患者机体处于高糖状态,炎性刺激可促进VEGF表达,增加视网膜毛细血管通透性,进而诱发黄斑水肿及新生血管形成[6-7]。故认为抗VEGF治疗对DR有重要作用。有证据支撑,视网膜激光光凝联合玻璃体腔内注射抗VEGF药物临床疗效优于单纯激光光凝[8]。也有数据显示,两者联合治疗可减少抗VEGF药物玻璃体腔内注药次数[9]。但对抗VEGF联合治疗的时机尚未达成共识。部分研究认为早期玻璃体腔内注药消退视网膜新生血管及黄斑水肿后行激光光凝可提高DR治疗效果[10]。也有观点表示,激光光凝后延迟注药疗效优于激光前注药[11]。为进一步明确DR患者抗VEGF最佳治疗时机,本研究拟对本院收治的120例191眼DR患者展开前瞻性研究,分别给予单纯抗VEGF、激光光凝及注药联合光凝(光凝前注药、光凝后注药)治疗,旨在为DR联合治疗提供新方向。
1对象和方法
1.1对象前瞻性研究。选取2018-01/2019-01我院收治的DR患者120例191眼作为研究对象。按随机数字表法分为4组:A组患者30例44眼行单纯激光光凝治疗,其中男13例19眼,女17例25眼;年龄40~76(平均55.6±7.9)岁;糖尿病病程5~18 (平均10.4±6.2)a;PPDR 15例23眼,增殖性DR(proliferative diabetic retinopathy,PDR)15例21眼(早期PDR 10例14眼,高危PDR 5例7眼)。B组患者30例46眼行抗VEGF药物玻璃体腔注射治疗,其中男14例21眼,女16例25眼;年龄41~77(平均55.9±7.5)岁;糖尿病病程5~19(平均10.5±6.4)a;PPDR 16例24眼,PDR 14例22眼(早期PDR 10例15眼,高危PDR 4例7眼)。C组患者30例49眼行激光光凝后延迟抗VEGF药物玻璃体腔注射治疗,其中男15例24眼,女15例25眼;年龄39~76(平均55.4±8.2)岁;糖尿病病程5~19(平均10.7±6.5)a;PPDR 15例26眼,PDR 15例23眼(早期PDR 10例17眼,高危PDR 5例6眼)。D组患者30例52眼行抗VEGF药物玻璃体腔注射后延迟激光光凝治疗,其中男14例25眼,女16例27眼;年龄40~77(平均56.1±8.1)岁;糖尿病病程5~18(平均10.5±6.4)a;PPDR 16例28眼,PDR 14例24眼(早期PDR 9例17眼,高危PDR 5例7眼)。四组患者性别构成、年龄、糖尿病病程、DR分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,患者及家属均知情同意并签署知情同意书。
1.1.1纳入标准(1)符合糖尿病诊断标准[12],全身状况良好,血压<130/80mmHg,糖化血红蛋白<7.0%;(2)经眼底检查、眼底荧光血管造影(fundus fluorescein angiography,FFA)、光学相干断层扫描(optical coherence tomography,OCT)确诊为PPDR、PDR;(3)黄斑中心凹厚度(central macular thickness,CMT)>250μm;(4)散瞳检查无其他眼底疾病;(5)入组前未接受玻璃体腔注药或视网膜光凝术等眼底治疗;(6)无青光眼、白内障、角膜病变、葡萄膜炎等眼部疾病;(7)屈光间质透明;(8)均为本市常住居民,有固定联系方式,可完成随诊。
1.1.2排除标准(1)既往有眼部外伤史;(2)合并黄斑变性、黄斑前膜、黄斑裂孔、黄斑部新生血管等眼底疾病;(3)合并视神经病变、葡萄膜炎等影响视力或导致黄斑水肿的其他眼部疾病;(4)单纯糖尿病;(5)观察期间因病情进展需行玻璃体手术者;(6)存在眼内注药禁忌者;(7)不能完成随访者。
1.2方法
1.2.1手术方法术前均完善眼科常规检查,排除手术禁忌证,所有手术均由同一术者完成。(1)激光光凝治疗:术前0.5h复方托吡卡胺滴眼液散瞳,术前15min盐酸丙美卡因结膜麻醉,依据FFA检查结果行激光光凝治疗,FFA提示黄斑区荧光素渗漏行黄斑区格栅样光凝,视网膜周边无灌注区行局灶性视网膜光凝,分2~3次行视网膜激光光凝。采用多波长眼底激光仪,选择567nm黄激光,避开黄斑乳头束,渗漏区黄斑区格栅样光凝,距黄斑中心凹500μm“C”形格栅样多点激光光凝,光斑直径100μm,曝光时间0.05s,能量10mW,强度Ⅰ~Ⅱ级光斑,以局部产生灰白色光凝斑或周围呈现淡白色晕轮为宜;再行局灶性视网膜光凝,光斑直径200~300μm,能量120~300mW,时间0.05~0.2s,光斑间隔1~2个光斑直径,以血管弓外向4象限周边行播散性光凝,小能量开始,循序渐进增大,直至出现Ⅰ级光斑反应。术后2~3mo复查FFA,出现无灌注区或新生血管时及时补充激光光凝。(2)玻璃体腔内药物注射:术前3d左氧氟沙星点眼,4次/d,术前0.5h复方托吡卡胺滴眼液散瞳,术前15min盐酸丙美卡因结膜麻醉,消毒铺巾,开睑器开睑,聚维酮碘、生理盐水冲洗结膜,颞上角膜后方4.0mm处进针,垂直眼球壁,深度1cm,确定针头进入玻璃体腔内后,注射雷珠单抗0.05mL,退针头,棉签按压针眼,术后左氧氟沙星点眼2wk。术后1~2mo复查OCT,若CMT>400μm再次行玻璃体腔内药物注射。C组患者3wk内完成全视网膜激光光凝,激光光凝1wk后玻璃体腔内注射雷珠单抗。D组患者玻璃体腔内注射雷珠单抗3wk后行全视网膜激光光凝。
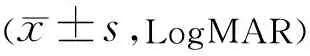
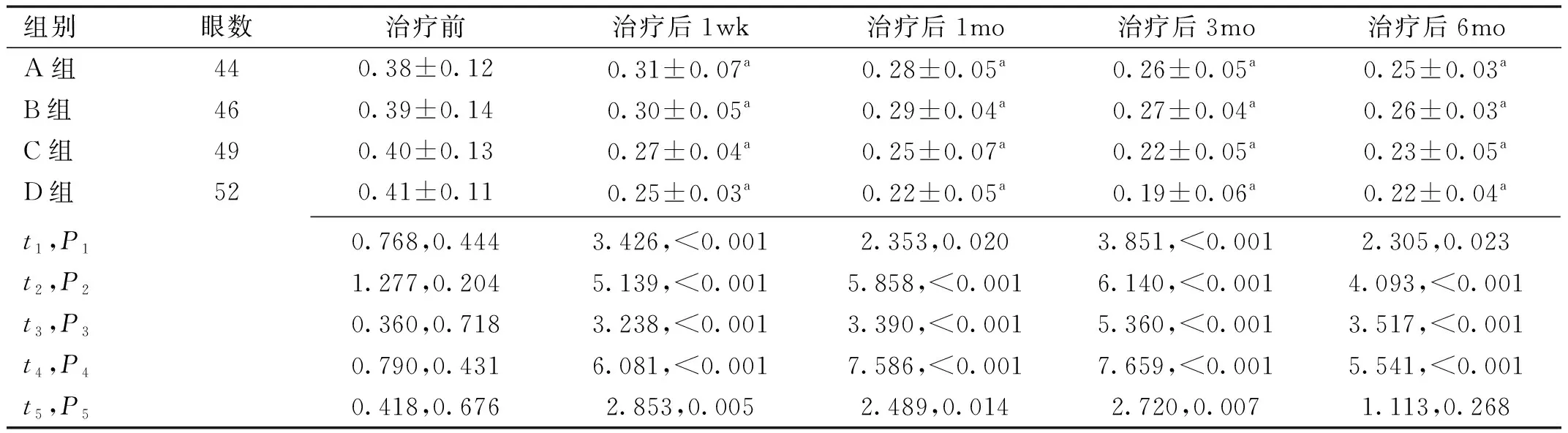
组别眼数治疗前治疗后1wk治疗后1mo治疗后3mo治疗后6moA组440.38±0.120.31±0.07a0.28±0.05a0.26±0.05a0.25±0.03aB组460.39±0.140.30±0.05a0.29±0.04a0.27±0.04a0.26±0.03aC组490.40±0.130.27±0.04a0.25±0.07a0.22±0.05a0.23±0.05aD组520.41±0.110.25±0.03a0.22±0.05a0.19±0.06a0.22±0.04at1,P10.768,0.4443.426,<0.0012.353,0.0203.851,<0.0012.305,0.023t2,P21.277,0.2045.139,<0.0015.858,<0.0016.140,<0.0014.093,<0.001t3,P30.360,0.7183.238,<0.0013.390,<0.0015.360,<0.0013.517,<0.001t4,P40.790,0.4316.081,<0.0017.586,<0.0017.659,<0.0015.541,<0.001t5,P50.418,0.6762.853,0.0052.489,0.0142.720,0.0071.113,0.268
注:A组:行单纯激光光凝治疗;B组:行抗VEGF药物玻璃体腔注射治疗;C组:行激光光凝后延迟抗VEGF药物玻璃体腔注射治疗;D组:行抗VEGF药物玻璃体腔注射后延迟激光光凝治疗。aP<0.05vs同组术前。t1,P1:A组vsC组;t2,P2:A组vsD组;t3,P3:B组vsC组;t4,P4:B组vsD组;t5,P5:C组vsD组。
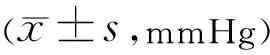
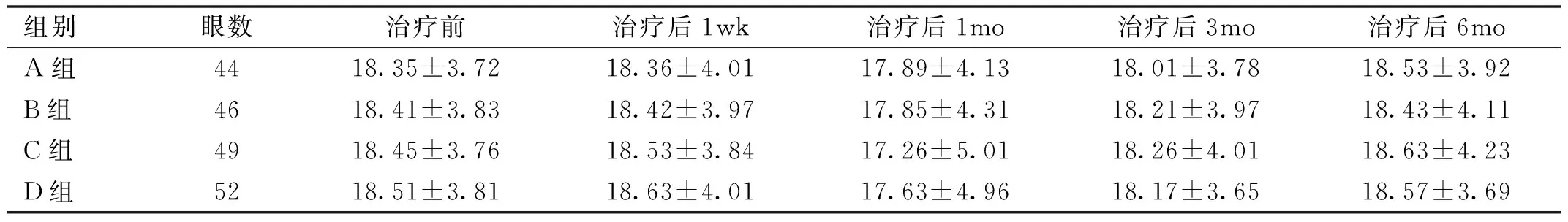
组别眼数治疗前治疗后1wk治疗后1mo治疗后3mo治疗后6moA组4418.35±3.7218.36±4.0117.89±4.1318.01±3.7818.53±3.92B组4618.41±3.8318.42±3.9717.85±4.3118.21±3.9718.43±4.11C组4918.45±3.7618.53±3.8417.26±5.0118.26±4.0118.63±4.23D组5218.51±3.8118.63±4.0117.63±4.9618.17±3.6518.57±3.69
注:A组:行单纯激光光凝治疗;B组:行抗VEGF药物玻璃体腔注射治疗;C组:行激光光凝后延迟抗VEGF药物玻璃体腔注射治疗;D组:行抗VEGF药物玻璃体腔注射后延迟激光光凝治疗。
1.2.2观察指标治疗(激光光凝和/或抗VEGF药物注射完毕)后随访6mo,观察各组患者的最佳矫正视力(best corrected visual acuity,BCVA)、眼压、CMT、激光光凝和抗VEGF治疗情况、并发症发生情况及黄斑水肿复发情况。(1)视力:分别于治疗前、治疗后1wk,1、3、6mo采用国际标准对数视力表测定BCVA,结果转换为最小分变角对数(LogMAR)视力进行分析。(2)眼压:分别于治疗前、治疗后1wk,1、3、6mo采用非接触式眼压计测定眼压的变化,每次均连续测定3次取均值。(3)CMT:采用OCT仪自动测定中心凹视网膜色素上皮内侧至神经纤维层内侧垂直距离,黄斑部视网膜水肿或出血时,以视盘颞侧2PD,下侧1.5PD作为黄斑中心凹测定CMT,均由同一高资历眼科医师完成测定,每次均重复扫描测定3次取均值。(4)激光光凝和抗VEGF治疗情况:记录A、C、D组患者激光光凝次数及治疗参数,包括激光能量、光斑数量、激光能量密度[(激光能量×曝光时间)/光凝面积]、激光次数;记录B、C、D组患者抗VEGF注射次数。(5)并发症:记录各组患者眼压增高、眼内炎、球结膜下出血、医源性白内障、视网膜脱离等与治疗相关的并发症发生情况。(6)黄斑水肿:随访期间行OCT检查,观察糖尿病性黄斑水肿复发率,复发评价标准:OCT测定CMT>170μm,可见黄斑中心凹神经上皮层增厚或结构消失[13]。

2结果
2.1各组患者治疗前后BCVA比较治疗前后,四组患者BCVA比较,差异有统计学意义(F组间=15.752,F时间=19.095,F交互=14.837,均P<0.001)。治疗前,四组患者BCVA两两比较,差异均无统计学意义(P>0.05)。治疗后不同时间四组患者BCVA均较治疗前改善,差异均有统计学意义(P<0.05)。C、D组患者治疗后不同时间BCVA均优于A、B组,D组患者治疗后1wk,1、3mo BCVA优于C组,差异均有统计学意义(P<0.05),见表1。
2.2各组患者治疗前后眼压比较治疗前后,四组患者眼压比较,差异无统计学意义(F组间=0.219,P组间=0.826;F时间=0.514,P时间=0.608;F交互=0.706,P交互=0.481),见表2。
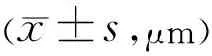
组别眼数治疗前治疗后1wk治疗后1mo治疗后3mo治疗后6moA组44337.52±50.63320.25±8.26a301.45±9.87a286.81±8.41a270.26±5.76aB组46340.61±49.75320.31±7.96a300.02±10.05a287.63±7.65a271.52±6.01aC组49342.79±51.54308.52±4.73a283.47±7.56a261.23±5.76a258.45±8.63aD组52341.63±50.96305.26±3.52a276.36±9.63a250.23±10.14a255.41±7.36at1,P10.496,0.6208.510,<0.0019.918,<0.00117.259,<0.0017.670,<0.001t2,P20.394,0.6938.697,<0.00112.575,<0.00119.021,<0.00110.859,<0.001t3,P30.209,0.9348.839,<0.0019.106,<0.00119.076,<0.0018.513,<0.001t4,P40.099,0.9209.255,<0.00111.892,<0.00120.397,<0.00111.772,<0.001t5,P50.113,0.9093.944,<0.0014.110,<0.0016.648,<0.0011.908,0.059
注:A组:行单纯激光光凝治疗;B组:行抗VEGF药物玻璃体腔注射治疗;C组:行激光光凝后延迟抗VEGF药物玻璃体腔注射治疗;D组:行抗VEGF药物玻璃体腔注射后延迟激光光凝治疗。aP<0.05vs同组术前。t1,P1:A组vsC组;t2,P2:A组vsD组;t3,P3:B组vsC组;t4,P4:B组vsD组;t5,P5:C组vsD组。


组别眼数激光能量(mW)光斑数量(个)激光能量密度[mW/(ms·μm2)]激光次数(次)注药次数(次)A组44436.35±20.652176.86±40.631.79±0.313.51±0.37-B组46----3.46±0.47C组49368.61±16.231932.56±26.250.57±0.232.63±0.172.23±0.33D组52330.75±30.671875.26±30.450.49±0.132.54±0.342.12±0.23F42.24321.59146.96632.88737.987P<0.001<0.001<0.001<0.001<0.001t1,P117.676,<0.00134.784,<0.00121.674,<0.00114.986,<0.00114.835,<0.001t2,P219.410,<0.00141.509,<0.00127.533,<0.00113.375,<0.00118.245,<0.001t3,P37.684,<0.00110.101,<0.0012.167,0.0031.666,0.0981.952,0.053
注:A组:行单纯激光光凝治疗;B组:行抗VEGF药物玻璃体腔注射治疗;C组:行激光光凝后延迟抗VEGF药物玻璃体腔注射治疗;D组:行抗VEGF药物玻璃体腔注射后延迟激光光凝治疗。除注药次数外:t1,P1:A组vsC组;t2,P2:A组vsD组;t3,P3:C组vsD组。注药次数:t1,P1:B组vsC组;t2,P2:B组vsD组;t3,P3:C组vsD组。
表5 各组患者并发症情况比较 眼(%)
组别眼数眼压增高眼内炎球结膜下出血晶状体混浊玻璃体积血合计A组442(4.5)1(2.3)1(2.3)2(4.5)1(2.3)7(15.9)B组463(6.5)1(2.2)2(4.3)1(2.2)07(15.2)C组492(4.1)001(2.0)2(4.1)5(10.2)D组522(3.8)01(1.9)1(1.9)1(1.9)5(9.6) χ2-----1.403P0.2420.5210.7910.8400.5840.705
注:A组:行单纯激光光凝治疗;B组:行抗VEGF药物玻璃体腔注射治疗;C组:行激光光凝后延迟抗VEGF药物玻璃体腔注射治疗;D组:行抗VEGF药物玻璃体腔注射后延迟激光光凝治疗。-:采用Fisher确切概率法。
2.3各组患者治疗前后CMT比较治疗前后,四组患者CMT比较,差异有统计学意义(F组间=18.044,F时间=21.725,F交互=15.765,均P<0.001)。治疗前,四组患者CMT两两比较,差异均无统计学意义(P>0.05)。治疗后不同时间四组患者CMT均较治疗前降低,差异均有统计学意义(P<0.05)。C、D组患者治疗后不同时间CMT均低于A、B组,D组患者治疗后1wk,1、3mo CMT低于C组,差异均有统计学意义(P<0.05),见表3。
2.4各组患者激光光凝和抗VEGF治疗情况比较A、C、D组患者激光能量、光斑数量、激光能量密度及激光次数比较,差异有统计学意义(F=42.243、21.591、46.966、32.887,均P<0.001),C、D组患者激光能量、光斑数量、激光能量密度及激光次数均低于A组,D组患者激光能量、光斑数量、激光能量密度均低于C组,差异均有统计学意义(P<0.05)。B、C、D患者玻璃体腔注药次数比较,差异有统计学意义(F=37.987,P<0.001),C、D组患者注药次数少于B组,差异均有统计学意义(P<0.05)。C、D组患者激光次数和注药次数比较,差异均无统计学意义(P>0.05),见表4。
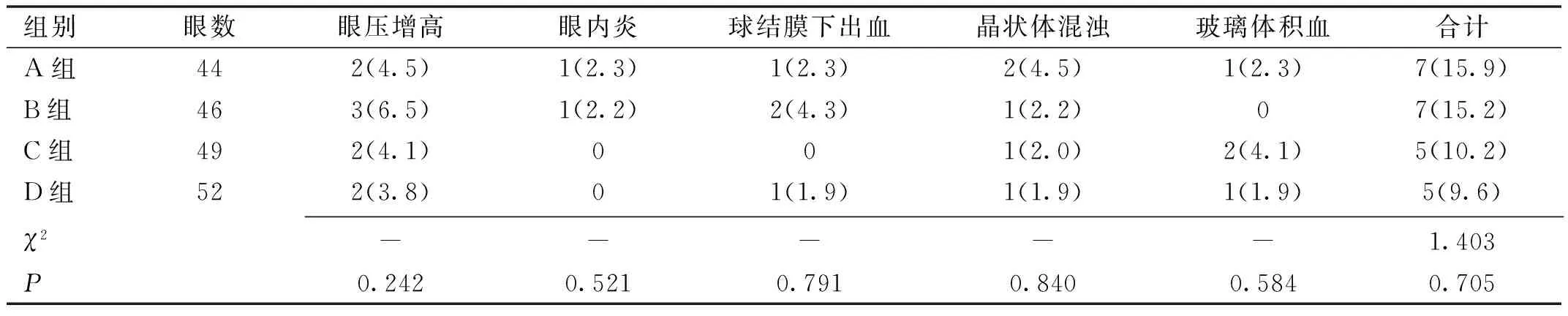
2.5各组患者并发症情况比较随访期间,四组患者均未出现医源性白内障、视网膜脱离等与治疗相关的严重并发症,并发症发生率比较,差异无统计学意义(P>0.05),见表5。
2.6各组患者黄斑水肿复发情况比较随访期间,A、B、C、D组患者黄斑水肿复发分别为3眼(6.8%)、4眼(8.7%)、2眼(4.1%)、1眼(1.9%),差异无统计学意义(P=0.455),且均发生于治疗后3~5mo,予抗VEGF药物治疗后改善。
3讨论
DR发病与缺氧、缺血、高糖环境诱导视网膜血管微循环破坏有关,随病程进展,约有8%DR患者进展为PDR,最终导致视力丧失[14]。VEGF系诱导视网膜新生血管生成的关键因子,是导致视网膜血管渗漏的主要原因,同时也是引起DR进展的危险因子[15]。糖尿病患者机体长期处于高糖状态,糖基化产物及反应活性氧生成增多,加剧眼内氧化应激反应,诱导蛋白激酶C激活,促成VEGF表达[16-17]。其通过与视网膜内皮细胞VEGF受体结合,以酪氨酸蛋白激酶磷酸化途径破坏细胞内皮功能,刺激血管内皮细胞增殖、移行,损害血管内皮细胞功能,导致细胞膜脂质过氧化反应,提升细胞通透性,削弱血管内皮细胞屏障功能,造成血液成分渗出,引起视网膜功能障碍,加重DR病情[18]。目前玻璃体腔内注药及视网膜激光光凝是治疗DR的常用手段。国内外报道已证实,视网膜激光光凝联合玻璃体腔内注药对DR患者视力改善优于单纯视网膜激光光凝[19-20]。李瑾等[21]对120例PDR患者分别应用激光光凝、光凝联合抗VEGF药物玻璃体腔内注射治疗,随访6mo发现联合组BCVA优于单纯光凝组。本研究发现,激光光凝联合抗VEGF药物雷珠单抗玻璃体腔内注药的C、D组患者视力、CMT改善均优于单纯激光光凝与单纯注药组,与上述结论相同,表明光凝联合玻璃体腔内注药治疗DR疗效优于单纯应用光凝或玻璃体腔内注射抗VEGF药物,分析其机制是由于视网膜激光光凝破坏视网膜色素上皮复合体,降低视网膜外层氧耗,减轻内层缺氧,增强视网膜内层氧化,改善视网膜组织缺氧状态,抑制VEGF释放,减少新生血管生成,促使新生血管萎缩;抗VEGF药物玻璃体腔内注射,可与VEGF-A等亚型结合,进一步抑制新生血管生成,防止血管渗漏,降低血管通透性,改善黄斑解剖结构及视网膜内层结构缺氧、缺血,进而改善视网膜功能[22-23]。
但对抗VEGF与激光光凝联合治疗时机尚存在争论。有国外研究者认为,光凝后延迟玻璃体腔内注射抗VEGF药物可在较短时间内快速改善患者视力[24]。而国内专家更倾向于先行玻璃体腔内注药减轻黄斑水肿,消退视网膜新生血管后行激光光凝处理[25]。但目前临床上围绕延迟激光光凝或延迟抗VEGF治疗DR的文献较少。本研究中,C组患者激光光凝后延迟行抗VEGF药物玻璃体腔内注药,D组患者先行玻璃体腔内注射抗VEGF药物,延迟激光光凝,结果发现D组患者治疗后1wk,1、3mo BCVA及CMT均优于C组,表明延迟光凝对视力及黄斑水肿改善优于延迟注药,考虑机制可能为先行玻璃体腔内注射抗VEGF药物可减轻视网膜水肿、抑制新生血管形成,此时视网膜呈现“干燥”状态,更利于激光光凝,降低出血风险,优化光斑反应及光凝疗效[26];尤其抗VEGF治疗后,在较低激光能量下即可获取满意的疗效,提升激光凝固效应,减少视网膜氧耗,进而改善视力,减轻黄斑损害。
本研究发现,C、D组患者激光能量、光斑数量、激光能量密度均低于A组,表明联合抗VEGF治疗可减少激光光凝能量,实现“低强度”光凝,减少激光所致损伤。且D组患者激光能量、光斑数量、激光能量密度低于C组,表明玻璃体腔内注射抗VEGF药物后视网膜黄斑水肿减轻,行光凝治疗时所需能量减少,进而降低激光对视网膜所造成的损伤。此外,雷珠单抗等抗VEGF药物虽可控制DR新生血管生成,但价格高昂,药物半衰期短,需反复注射,大部分患者经济压力较大[27]。如何减少注射次数已成为眼科研究者关注的重点课题。本研究发现,联合应用光凝和玻璃体腔内注药的C、D组患者光凝次数及注药次数均较单纯应用光凝或玻璃体腔内注药的A、B组少,提示联合治疗有利于减少抗VEGF药物注射及激光光凝次数,进而降低患者的经济负担。此外,我们发现,各组治疗不同时间眼压均无明显改变,同时各并发症发生率比较差异无统计学意义,证实激光光凝联合抗VEGF治疗DR有较高的安全性。随访期间,C、D组患者糖尿病性黄斑水肿复发率略低于A、B组,分析激光光凝与玻璃体腔内抗VEGF药物注射联合治疗可通过协同降低VEGF水平,减轻微血管渗漏及激光光凝所致炎症反应,进而避免黄斑水肿发生,保护患者视功能。但本研究以上数据未呈现统计学差异,可能与统计样本数量少及观察时间短有关,需扩充样本量,延长随访时间以进一步论证。值得注意的是,本研究纳入患者眼内炎发生率较相关文献[28]统计报道数据高,可能与本组入选病例年龄偏大,基础免疫抵抗力差,对病原体抵抗力低,眼表细菌多及个体对抗菌药物反应性差有关,后续需进一步展开眼内炎病原菌培养,确定感染原因,以期为感染预防提供依据。
综上所述,DR患者应用激光光凝联合玻璃体腔内注射抗VEGF药物治疗对视力及黄斑水肿改善优于单纯激光光凝或玻璃体腔内注药治疗,可减少光凝能量、光凝次数及抗VEGF注药次数,且先行玻璃体腔内注药后延迟激光光凝对DR患者视力及黄斑水肿改善更明显。但本研究样本量较少,随访观察时间短,尚存在一定的局限性,后续需进一步扩充样本量,延长随访时间,展开大样本、多中心研究,验证玻璃体腔内注药联合激光光凝治疗DR的可行性及最佳治疗时机。
