玻璃体切割术联合或不联合内界膜剥除治疗严重PDR伴黄斑皱褶移位
2020-04-04刘庆淮计江东
谢 瞻,刘庆淮,计江东
0引言
糖尿病为一种临床常见的慢性代谢性疾病,在过去的十年里,我国糖尿病的患病率由2.6%上升至9.7%[1],严重影响人们身心健康。在中国2型糖尿病成人患者中,20%~40%出现视网膜病变,8%视力丧失[2],其中DR进展为增殖性糖尿病视网膜病变 (proliferative diabetic retinopathy,PDR)伴有重度不吸收的玻璃体积血、纤维血管膜、黄斑水肿、牵拉性视网膜脱离及新生血管性青光眼等,是导致糖尿病患者失明的重要原因,玻璃体切割术(pars plana vitrectomy,PPV)是目前治疗严重PDR唯一有效的方法[3]。临床中发现,部分严重PDR病例,术中清除玻璃体腔积血并撕除增殖膜后,可见黄斑区水肿,伴皱褶移位,对于该类型的严重PDR患者是否需要采用PPV联合内界膜剥除术治疗,国内外鲜有文献报道。故本研究比较了PPV联合或不联合内界膜剥除术治疗严重PDR伴黄斑皱褶移位的疗效及安全性的差异,现报告如下。
1对象和方法
1.1对象收集2016-01/2017-12在江苏省人民医院眼科病房接受PPV手术治疗的严重PDR伴黄斑皱褶移位的患者36例36眼的临床资料,其中男19例,女17例,年龄36~61(平均56.33±7.14)岁,均为2型糖尿病患者PDR为临床Ⅵ期患者,符合1997年美国糖尿病协会制定的糖尿病诊断标准,其中2016-01/12入院的患者18例18眼纳入对照组,行25G微创玻璃体切割术,2017-01/12入院的患者18例18眼纳入联合组,行25G微创玻璃体切割联合内界膜剥除术。纳入标准:(1)根据《我国糖尿病视网膜病变临床诊疗指南(2014 年)》[4],明确诊断为糖尿病视网膜病变;(2)糖尿病视网膜病分级标准符合糖尿病视网膜病国际临床分级标准[5]的PDR期,皆伴有不同程度的局部牵引性视网膜脱离;(3)经评估有玻璃体切割手术指征;(4)PPV术中清除玻璃体积血及撕除增殖膜后发现黄斑区水肿伴皱褶移位。排除标准:(1)合并牵拉性视网膜裂孔;(2)PPV术中发生医源性裂孔者;(3)合并角膜、巩膜感染者或者严重青光眼者;(4)心肺肝肾功能不全者;(5)患者拒绝接受玻璃体切割手术者。 本研究通过医院伦理委员会审核,所有患者均知情同意并签署知情同意书。两组患者一般资料比较差异无统计学意义(P>0.05),见表1。
1.2方法联合组中17例17眼,对照组中13例13眼玻璃体切割术前3d行玻璃体腔内注射雷珠单抗(0.5mg/0.05mL)治疗。所有玻璃体切割手术均由同一位医师操作,采用Constellation玻璃体切割超声乳化手术系统及RESIGHT非接触式全视网膜镜观察系统。联合组中12例12眼,对照组中16例16眼因晶状体混浊影响后段观察者先行白内障超声乳化术。做2.8mm透明角膜切口,撕囊镊环形撕囊,水分离,劈核后乳化晶状体,吸尽皮质,植入人工晶状体,完成白内障手术后再进行PPV术。采用“3D”模式行25G经睫状体平坦部三通道玻璃体切割术。切割前部及中央玻璃体后,切断后极部与周边部玻璃体的连接,用玻璃体切割头将增殖膜分割成小块后切割,尽量切割分离,避免使用眼内镊牵拉和负压吸引。在切割大部分可见玻璃体和增殖膜后,用1mL注射器注入醋酸曲安奈德注射液(50mg/5mL)染色玻璃体,必要时重复进行,确保全部玻璃体后皮质清除干净。向玻璃体腔内注射0.125%的吲哚菁绿溶液0.1mL 染色内界膜,染色时间约为30s。在颞侧视网膜血管弓内、远离黄斑中心凹处掀起一小片内界膜瓣,用内界膜镊抓住该内界膜瓣,围绕黄斑中心凹环形剥离内界膜,剥离范围约1~2DD。术中补充或完成全视网膜光凝。填充介质的选择主要依据术中所见的眼底情况,若眼底合并视网膜裂孔及活动性出血则选择硅油,若眼底无裂孔及活动性出血则选择平衡盐溶液或消毒空气。对照组操作同前,术中不联合内界膜撕除术。所有患者手术前后均行BCVA、OCT、眼底照相、眼部B 型超声、非接触眼压计、裂隙灯显微镜、双目间接眼底镜检查。采用标准对数视力表获得患者手术前后的BCVA,并将结果转换为最小分辨角对数(LogMAR)视力形式记录后进行统计分析,指数,手动和光感分别记作2.3,2.6,2.9[6]。观察并记录两组患者术前及术后1wk,1、3、6 mo BCVA(LogMAR),黄斑中心视网膜厚度(central macular thickness,CMT),眼压及并发症。
2结果
2.1两组患者手术前后BCVA比较两组患者手术前后各时间BCVA比较差异有统计学意义,而组间比较及组间×时间比较差异无统计学意义(F组间=1.136,P组间=0.294;F时间=19.369,P时间<0.001;F组间×时间= 6.354,P组间×时间=0.002)。术前两组患者BCVA差异无统计学意义(P=0.440);两组患者术后1wk,1、3、6mo BCVA均较术前提高,差异有统计学意义(联合组:t术前vs术后1wk=2.502,P术前vs术后1wk=0.023,t术前vs术后1mo=5.592,P术前vs术后1mo<0.01,t术前vs术后3mo=5.735,P术前vs术后3mo<0.01,t术前vs术后6mo=7.662,P术前vs术后6mo<0.01;对照组:t术前vs术后1wk=3.233,,P术前vs术后1wk=0.005,t术前vs术后1mo=5.722,P术前vs术后1mo<0.01,t术前vs术后3mo=4.295,P术前vs术后3mo<0.01,t术前vs术后6mo=4.341,P术前vs术后6mo<0.01)。术后1wk,1、3、6mo两组组间BVCA比较,差异无统计学意义(均P>0.05),见表2。
2.2两组患者术后CMT比较两组患者术后CMT比较差异有统计学意义 (F组间=4.242,P组间=0.047;F时间=19.369,P时间<0.001;F组间×时间=6.354,P组间×时间=0.002)。两组患者术后1wk,1、3mo两组间平均CMT 比较,差异均无统计学意义( 均P>0.05),术后6mo两组患者平均CMT 比较,差异有统计学意义(t=-8.775,P<0.001 ),见表3。
2.3两组患者手术前后眼压比较两组患者手术前后眼压比较差异无统计学意义 (F组间=1.472,P组间=0.233;F时间=4.517,P时间= 0.005;F组间×时间=1.641,P组间×时间=0.184),见表4。联合组中2眼(11%)术后1mo眼压>21mmHg,局部予两种降眼压药物点眼,眼压控制在正常水平,对照组中1眼(6%)术后6mo出现眼压>21mmHg,予2种降眼压药物治疗后眼压控制正常。两组患者术后高眼压的发生率差异无统计学意义(P=1.000)。
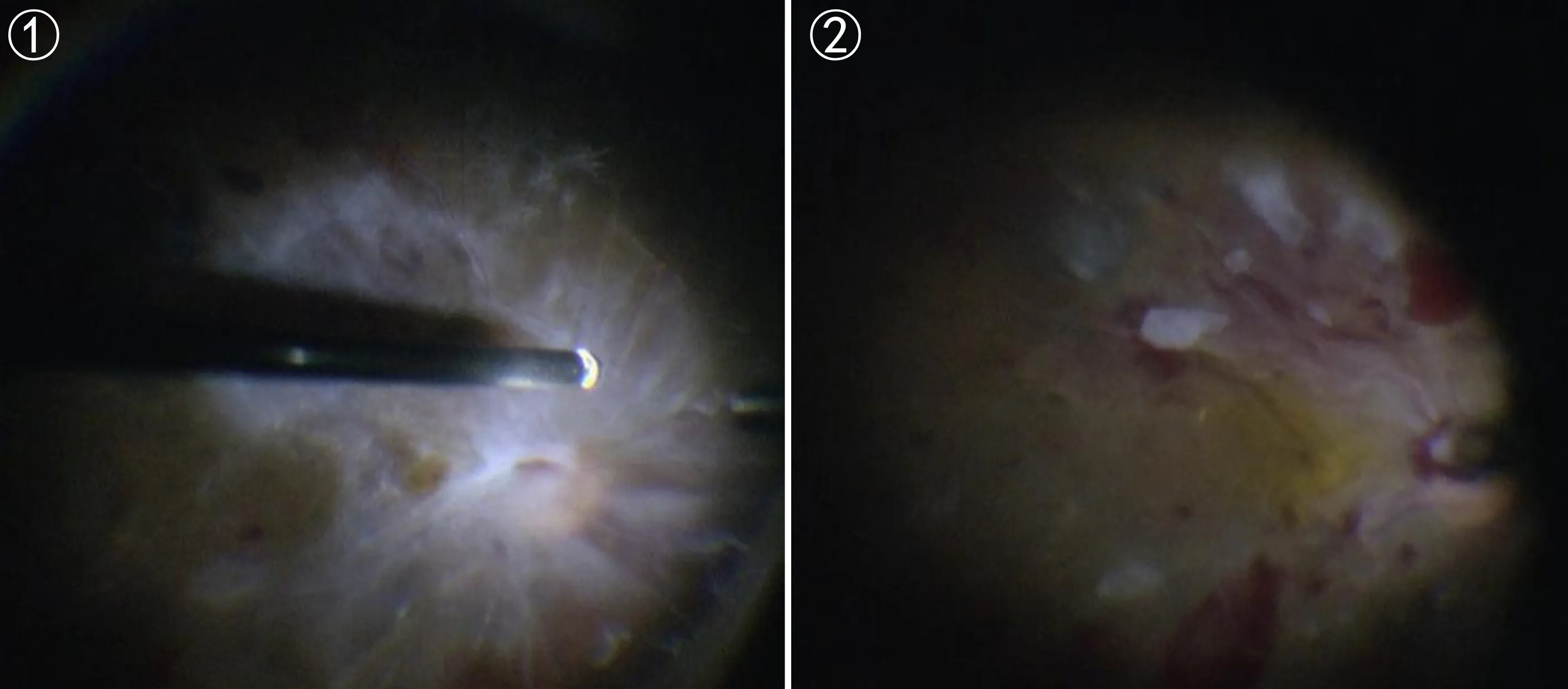
图1 PPV术中见视网膜前稠厚的增殖膜,黄斑及视盘结构窥不清。图2 PPV术中切割增殖膜后见黄斑皱褶移位。
表1 两组患者一般资料比较
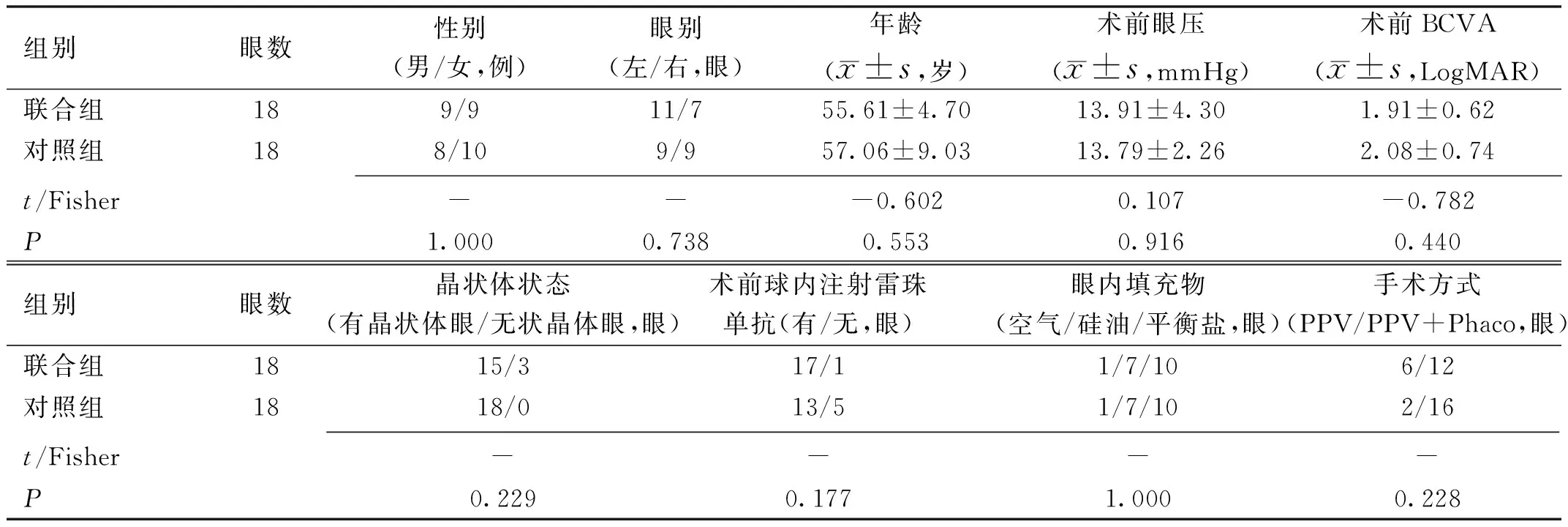
组别眼数性别(男/女,例)眼别(左/右,眼)年龄(x±s,岁)术前眼压(x±s,mmHg)术前BCVA(x±s,LogMAR)联合组189/911/755.61±4.7013.91±4.301.91±0.62对照组188/109/957.06±9.0313.79±2.262.08±0.74 t/Fisher---0.6020.107-0.782P1.0000.7380.5530.9160.440组别眼数晶状体状态(有晶状体眼/无状晶体眼,眼)术前球内注射雷珠单抗(有/无,眼)眼内填充物(空气/硅油/平衡盐,眼)手术方式(PPV/PPV+Phaco,眼)联合组1815/317/11/7/106/12对照组1818/013/51/7/102/16 t/Fisher----P0.2290.1771.0000.228
注:对照组:仅行25G微创玻璃体切割术;联合组:行25G微创玻璃体切割联合内界膜剥除术。
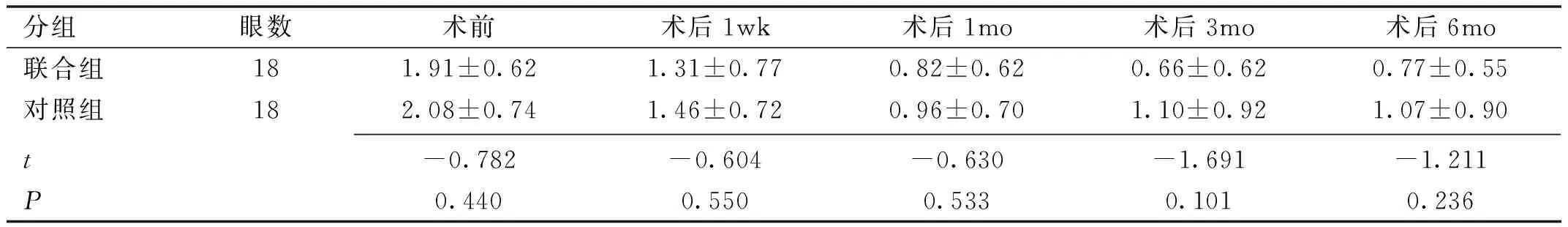
分组眼数术前术后1wk术后1mo术后3mo术后6mo联合组181.91±0.621.31±0.770.82±0.620.66±0.620.77±0.55对照组182.08±0.741.46±0.720.96±0.701.10±0.921.07±0.90t-0.782-0.604-0.630-1.691-1.211P0.4400.5500.5330.1010.236
注:对照组:仅行25 G微创玻璃体切割术;联合组:行25 G微创玻璃体切割联合内界膜剥除术。
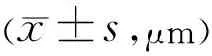
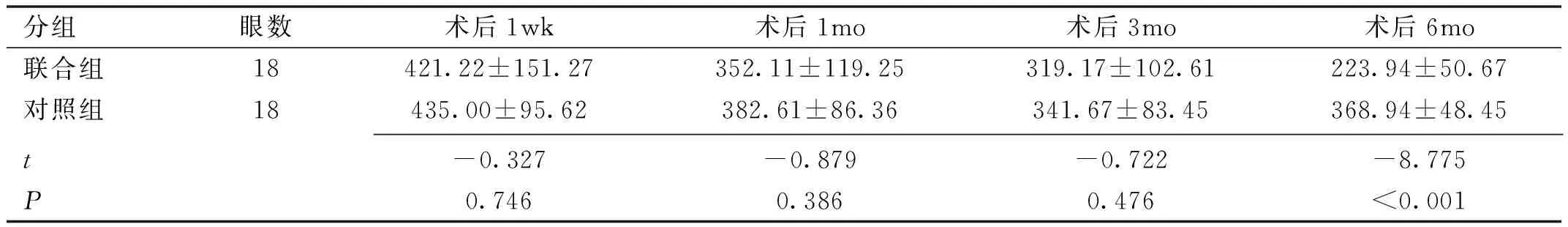
分组眼数术后1wk术后1mo术后3mo术后6mo联合组18421.22±151.27352.11±119.25319.17±102.61223.94±50.67对照组18435.00±95.62382.61±86.36341.67±83.45368.94±48.45 t-0.327-0.879-0.722-8.775P0.7460.3860.476<0.001
注:对照组:仅行25G微创玻璃体切割术;联合组:行25G微创玻璃体切割联合内界膜剥除术。
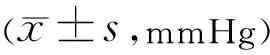
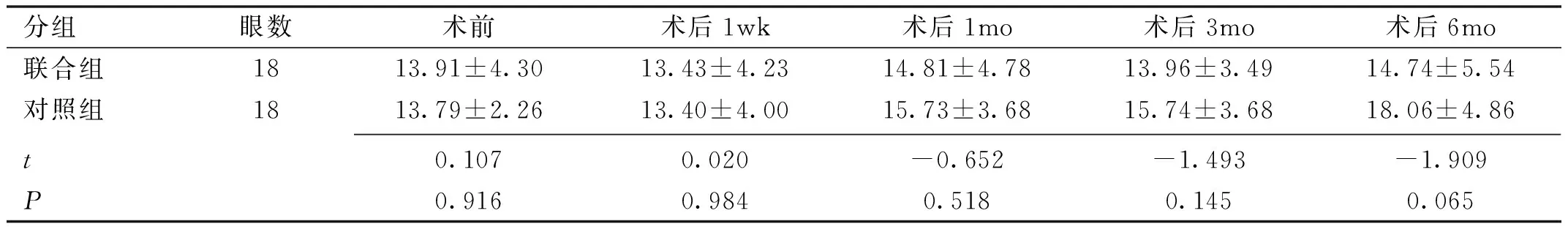
分组眼数术前术后1wk术后1mo术后3mo术后6mo联合组1813.91±4.3013.43±4.2314.81±4.7813.96±3.4914.74±5.54对照组1813.79±2.2613.40±4.0015.73±3.6815.74±3.6818.06±4.86t0.1070.020-0.652-1.493-1.909P0.9160.9840.5180.1450.065
注:对照组:仅行25G微创玻璃体切割术;联合组:行25G微创玻璃体切割联合内界膜剥除术。
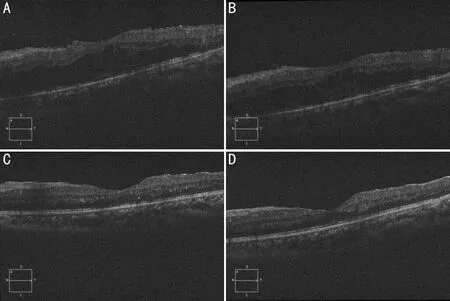
图3 严重PDR伴黄斑皱褶移位患者行PPV联合内界膜剥除术后OCT形态变化 A:术后1wk,B:术后1mo,C:术后3mo,D:术后6mo。
2.4 两组患者术后并发症情况联合组中1眼(6%)术后5mo仍有顽固性黄斑水肿,予球内注入康柏西普后黄斑水肿较前缓解;对照组中,1眼(6%)术后3mo取油时出现再出血,嘱患者静养休息,予口服改善循环、营养神经保守治疗后积血吸收,1眼(6%)术后6mo出现黄斑前膜,患者决定暂不行手术治疗,予保守观察。两组患者手术后均未出现视网膜脱离、视网膜裂孔、眼内炎等严重并发症。两组患者黄斑水肿、黄斑前膜及玻璃体积血发生率组间差异无统计学意义(均P=1.000)。
3讨论
严重PDR是DR的终末阶段,玻璃体切割术是目前唯一有效的治疗方法。玻璃体手术可以清除玻璃体腔积血,切割牵拉视网膜的纤维增殖条索,解除新生血管膜及玻璃体后皮质对视网膜的收缩和牵拉,同时切割作为新生血管继续增殖的支架—玻璃体后皮质,对缺血的视网膜或视网膜裂孔进行有效光凝,联合眼内填充使脱离的视网膜复位,从而改善患者视功能。国内外文献报道大部分糖尿病视网膜病变(diabetic retinopathy,DR)患者玻璃体手术后视力改善[7-8],但仍有部分患者治疗效果不佳,黄斑病变是影响DR患者PPV术后视力恢复的重要因素[9]。我们在临床发现,部分严重PDR术前由于玻璃体出血和增殖膜影响,无法观察黄斑情况,手术中清除玻璃体出血和增殖膜后发现部分患者黄斑区在增殖膜的作用下发生皱褶和移位(图1、2),这种情况不同于一般意义上的牵引视网膜脱离造成的黄斑脱离,也不同于一般意义上的黄斑水肿,经过查找文献对这种黄斑皱褶移位还没有相关文献报道,对于这种情况的治疗也无相关研究。故本研究比较了PPV联合或不联合内界膜剥除术治疗严重PDR伴黄斑皱褶移位的疗效及安全性的差异,以期为临床医师治疗方案的选择提供依据。
内界膜是视网膜和玻璃体之间的结构分界,外表面与Müller细胞纤维脚板相吻合,内表面与玻璃体皮质接触,始于玻璃体管并向周边覆盖整个视网膜内表面,在病理情况下可成为Müller细胞增生的支架,促进胶质细胞的移行,是造成黄斑疾病切线方向牵拉力的主要因素[10]。随着内界膜剥除术于1990年被Morris等[11]第一次将运用于临床,许多学者逐渐将内界膜剥除术应用于多种玻璃体视网膜疾病的治疗中,如特发性黄斑裂孔、黄斑前膜、高度近视黄斑区玻璃体视网膜界面异常等[12]。目前国内外学者探索了内界膜剥除术在糖尿病视网膜病变中的应用,主要集中于黄斑水肿的治疗。部分研究显示PPV联合内界膜剥除能够降低CMT,但缺乏大样本量随机对照研究支持[13]。Dehghan等[14]认为PPV联合或者不联合内界膜剥除术均能使CMT显著降低,从解剖学的指标判断有统计学意义,但是手术前后BCVA并无统计学差异,视力的预后与CMT之间并无明显相关性;此外,由于内界膜是Müller 细胞的基底膜,作为视网膜和玻璃体的支架和屏障,对维持视网膜细胞结构和功能起着重要作用,内界膜撕除可造成Müller细胞的损伤[15],Meena等[16]从细胞学层面及光学相干断层扫描验证了以上结论。Rosenblatt 等[17]研究指出内界膜剥除术的意义或不在于提升视力,而是防止黄斑水肿的进一步恶化,或者预防视网膜前膜的生成。以上均提示临床医师,在PDR治疗中需谨慎选择内界膜撕除术的适应证[18-19]。目前内界膜手术的标准并未达到共识,部分学者认为,对于伴有微小机械牵拉因素的DME患者,或者对于难治性、弥漫性且对其他治疗手段无效,尤其是对激光治疗没有反应的黄斑水肿者,可考虑行PPV联合内界膜剥除术治疗[20]。本研究中两组患者术后BCVA均较术前明显改善,术后CMT随着时间推移逐渐下降,体现了PPV治疗PDR的疗效确切;术后6mo,PPV联合内界膜撕除术组CMT厚度显著低于对照组,两组间BCVA差异无统计学意义,以上提示对于严重PDR伴黄斑皱褶移位的患者,PPV联合内界膜撕除术在改善术后视力及CMT方面,较单纯行PPV治疗的患者具有优势。
分析原因,PPV联合内界膜剥除术可减轻玻璃体后界膜对黄斑区切线方向的机械牵引,去除星型胶质细胞增生的支架从而阻止胶质细胞异常增生及视网膜前膜的形成;剥除内界膜后,抗VEGF药物或更容易进入黄斑区视网膜组织发挥其药物作用,而视网膜基质构架呈疏松样改变,有助促进黄斑水肿的消退(图3);还可减少VEGF及炎症因子等相关血管活性因子附着,从而降低玻璃体黄斑交界面疾病的术后复发率。术中操作时有以下注意点:(1)切割增殖膜时使用切割头在视网膜和增殖膜之间寻找空隙,待玻璃体切割头进入空隙后再行切割分离,分而治之,避免牵拉;(2)妥善处理纤维血管膜残端、有效止血对于预防玻璃体出血有重要作用;(3)后极部增殖膜剥除后往往仍有玻璃体残留,可使用TA染色,确保玻璃体后皮质完全清除;(4)使用ICG染色后,如黄斑区不能染色,则提示还有黄斑前膜或玻璃体后皮质残留;(5)PDR的内界膜质地较脆,易撕破,为了更好地撕膜可以适当重复ICG染色;(6)由于黄斑皱褶移位,与色素上皮部分脱离,撕内界膜的起点最好在黄斑鼻上或鼻下近视盘处开始,此处视网膜相对固定,避免撕内界膜时视网膜移位造成的不便;(7)尽可能保证晶状体后囊膜的完整性,减少新生血管性青光眼的发生。
本研究中,术后6mo两组患者高眼压发生率未见统计学差异,联合组眼压平均值低于对照组,推测术后眼压均值的差异或与样本量较小及两组患者玻璃体切割术前雷珠单抗的使用率有关,联合组中17眼(94%),对照组13眼(72%)术前接受了雷珠单抗玻璃体腔注射,董一等[21]研究显示糖尿患者玻璃体切割术前预防性使用雷珠单抗或在一定程度上抑制术后眼压上升幅度。此外,本研究随访的时间较短,研究对象的选择可能存在一定偏倚,远期疗效及安全性还需要大样本长期随访的对照研究进一步证实。
综上所述,治疗严重PDR伴黄斑皱褶移位时采用25G微创玻璃体切割联合内界膜剥除术,能更有效提高患者BCVA及降低CMT,该术式成功的基本条件包括严格的手术适应证选择以及精细的手术操作。
