初级纤毛参与成纤维细胞生长因子18介导的软骨细胞增殖和表型调控的机制研究
2020-04-04陶凤华蒋婷向威
陶凤华 蒋婷 向威
骨关节炎是一类因软骨损伤退变引起的关节疾病,常伴有软骨基质的分解代谢增强和不恰当的损伤修复,其病理表现主要为进行性的软骨丢失,软骨下骨硬化和骨赘形成,能引起受累关节的疼痛和功能障碍,影响病人生活质量[1]。目前,药物治疗虽然能够缓解骨关节炎引起的疼痛症状,但却不能阻断其疾病进程。而改善疾病的骨关节炎药物(disease⁃modifying osteoarthritis drugs, DMOADs)能够通过抑制软骨的分解代谢,同时促进合成代谢来阻断软骨组织的退变并且促进其再生,不仅能缓解疼痛症状,还能促进软骨结构改善和功能恢复,具有重要的研究意义[2]。
成纤维细胞生长因子18(fibroblast growth factor 18,FGF18)是成纤维细胞生长因子家族中的一类亚型,在调控骨骼系统的发育过程中扮演着非常重要的作用。研究发现,FGF18 能够维持软骨细胞内稳态稳定,减少因软骨损伤导致的软骨厚度和体积的丢失,并且促进软骨损伤的愈合及再生软骨的整合[3,4]。FGF18 主要通过与成纤维细胞生长因子受体3(FGFR3)结合参与FGF 信号通路转导来发挥其生长发育调控作用[5]。与其他DMOADs 相比,FGF18对软骨细胞的促合成代谢作用伴有较少的副反应,如较少引起骨赘形成、软骨钙化和炎症等[6]。目前FGF18 在临床应用的价值不断得到重视,但是其改善骨关节炎的潜在机制仍有待进一步研究。
初级纤毛作为凸出于细胞表面的“天线”样结构,是一类具有特殊功能的细胞器,能够参与感受细胞微环境中的理化刺激并介导多种信号通路的转导,其组装聚合过程还与细胞周期相关,参与细胞的生长发育调控[7]。前期研究发现,初级纤毛能够作为调节生长板功能和骨骼系统发育重要的信号转导枢纽[8]。同时,初级纤毛参与细胞新陈代谢,与代谢相关的细胞自噬具有明显的关联性[9]。并且初级纤毛结构和功能的完整性还能够影响力学刺激对软骨细胞生长发育的调控[10]。
本研究探究了不同浓度的FGF18 对软骨细胞增殖和分化的影响,通过使用水合氯醛调控初级纤毛结构,再结合FGF18 干预,探索FGF18 在不同纤毛表达条件下对软骨细胞生长发育的影响,旨在阐明初级纤毛在FGF 18 调控软骨细胞发育中的作用及机制。
材料与方法
一、实验材料与仪器
SD 大鼠乳鼠购自武汉大学人民医院实验动物中心,水合氯醛购自国药集团化学试剂有限公司,胎牛血清购自美国Gibco Life Technologies 公司,小鼠源acetylated⁃α⁃tubulin 抗体购自美国Sigma 公司,DMEM/F12 细胞培养基、小鼠源GAPDH 抗体、兔源CyclinD1 抗体、CY⁃3 标记的荧光二抗、辣根过氧化物酶标记的二抗、Western blot凝胶配制试剂盒、ECL显色液、甲苯胺蓝染液、CCK8等均购自武汉博士德公司,兔源COL Ⅱ抗体购自英国Abcam 公司,兔源ERK 和P⁃ERK 抗体购自美国CST 公司,Live/dead 试剂盒购自美国Thermo Fisher Scientific 公司,PCR 逆转录试剂盒和SYBR⁃Green DNA 聚合酶均购自日本Toyobo 公司,细胞培养箱购自中国香港Heal Force公司,荧光显微镜为美国赛默飞公司的EVOS FL Auto全自动细胞成像系统。
二、实验方法
(一)细胞培养
取新生3 d 的SD 大鼠乳鼠,处死后分离膝关节软骨,剪碎成1 mm3大小软骨块,加入胰酶,37 ℃消化30 min,离心后弃上清,加入Ⅱ型胶原酶37 ℃消化6 h后将细胞悬液离心弃上清,培养基重悬后转移至细胞培养瓶,置于5%CO2,37 ℃培养箱培养。
(二)CCK8实验
胰酶消化软骨细胞,96孔板中每孔加入约2 000个细胞,设置5 个不同浓度的FGF18 组(0 ng/ml、5 ng/ml、10 ng/ml、20 ng/ml、40 ng/ml),依次加入相应浓度FGF18 重组细胞因子,分别干预细胞48 h 和72 h。检测时每孔更换成100 μl新鲜培养基并加入10 μl CCK8 溶液,37 ℃培养箱中孵育90 min 后于450 nm波长下检测吸光度值(OD值)。
(三)免疫荧光染色
将不同浓度的FGF18 干预软骨细胞48 h 后弃培养基,4%多聚甲醛固定15 min 后加入0.1%浓度TritonX⁃100破膜,10 min后加入5%的牛血清白蛋白室温封闭1 h。加入以1∶300稀释的小鼠源acetylat⁃ed⁃α⁃tubulin抗体,4 ℃孵育过夜,用磷酸盐缓冲液洗涤3 遍后加入荧光二抗,室温孵育1 h,随后加入4,6-二氨基-2-苯基吲哚(4,6⁃diamino⁃2⁃phenylindole,DAPI),室温下避光孵育10 min 后于荧光显微镜下观察。
根据不同浓度的FGF18 干预软骨细胞后CCK8和免疫荧光染色结果,选取最佳浓度设置为FGF18组,另外设置对照组、水合氯醛组(40 μmol/L)、水合氯醛+FGF18组,均在干预软骨细胞48 h和72 h后进行CCK8 实验,干预软骨细胞48 h 后进行免疫荧光染色,实验步骤同上。
(四)甲苯胺蓝染色
将上述不同分组的药物干预软骨细胞72 h后弃培养基,加入4%多聚甲醛固定15 min,再加入甲苯胺蓝染液室温孵育15 min,弃染液后用磷酸盐缓冲液洗涤3遍,用相机拍照观察细胞染色情况。
(五)Live/dead实验
在10 ml磷酸盐缓冲液中加入20 μl 2 mmol/L的EthD⁃1 储备溶液,震荡混匀后再加入5 μl 4 mmol/L的钙黄绿素AM 储备液,震荡混匀后得到浓度为2 μmol/L 钙黄绿素AM 和4 μmol/L EthD⁃1 的工作液。软骨细胞经不同分组药物干预48 h 后弃培养基,用磷酸盐缓冲液洗涤3遍后加入工作液,37 ℃培养箱中避光孵育5 min,荧光显微镜下拍照观察。
(六)Western blot实验
软骨细胞经不同分组的药物干预48 h后提取总蛋白,取20 μg总蛋白进行聚丙烯酰胺凝胶电泳,转膜至聚偏二氟乙烯(PVDF)膜后,用5%牛血清白蛋白室温封闭1 h,分别加入CyclinD1(1∶200)、COL Ⅱ(1∶1 000)、ERK(1∶1 000)、P⁃ERK(1∶1 000)、GAP⁃DH(1∶300)一抗,4 ℃孵育过夜后用三乙醇胺缓冲盐+Tween 20 溶液(tris⁃buffered saline and tween 20,TBST)洗涤3遍,再在室温下孵育辣根过氧化物酶标记的羊抗兔及羊抗鼠二抗(1∶5 000)1 h,TBST 洗涤后用增强化学发光法(enhanced chemiliuminescent,ECL)显色系统检测。
(七)RT⁃PCR实验
软骨细胞经不同分组药物干预48 h后,用Trizol法提取总RNA,根据试剂盒说明书将总RNA逆转录为cDNA,在八联管中配制20 μl 的反应体系进行RT⁃PCR,其中包括1 μl cDNA、1 μl 引物、10 μl SYBR⁃Green DNA 聚合酶和8 μl 去RNA 酶水,引物序列如表1所示。
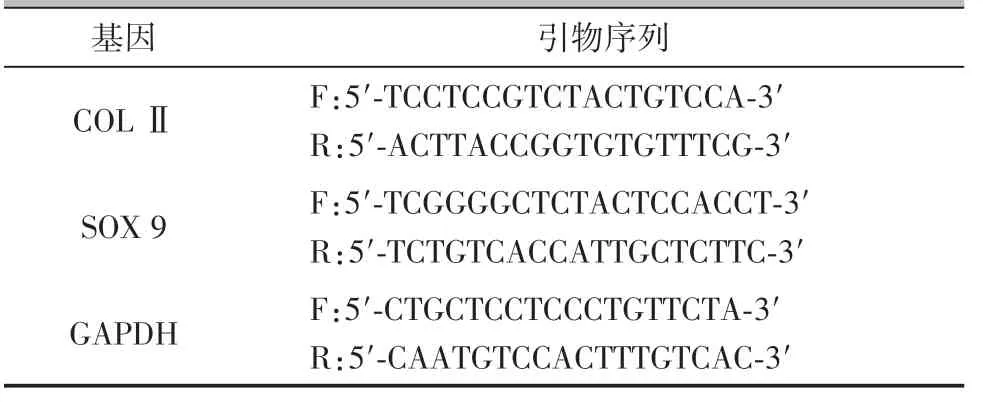
表1 引物序列
三、统计学分析
每组实验至少重复3 次,数据分析采用SPSS 20.0 软件(IBM 公司,美国),数据采用均数±标准差()表示,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
结 果
一、不同浓度FGF18促进软骨细胞增殖活性
以不同浓度的FGF18 分别干预软骨细胞48、72 h,CCK8 细胞活性检测结果如图1 所示,不同浓度的FGF18 对软骨细胞均表现出促增殖活性作用,并且呈现一定的浓度依赖性,在20 ng/ml 时促增殖活性最为明显,与0 ng/ml 组相比,差异具有统计学意义(P<0.05)。
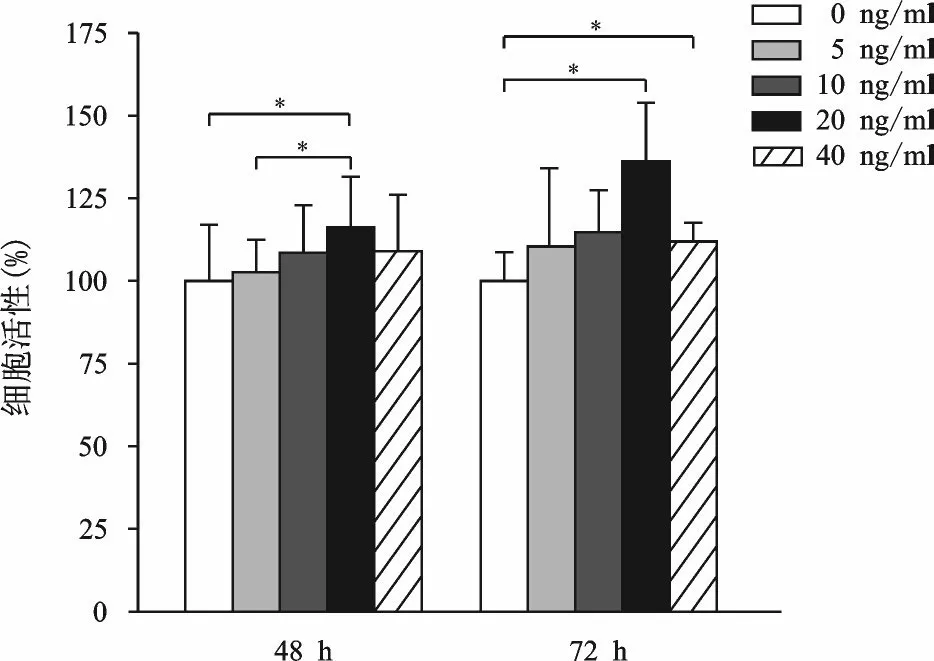
图1 不同浓度FGF18对软骨细胞增殖活性的影响(*P<0.05)
二、不同浓度FGF18 影响软骨细胞初级纤毛表达水平和长度变化。
以不同浓度FGF18 干预软骨细胞48 h 后通过荧光染色检测初级纤毛表达水平(图2),0 ng/ml 时初级纤毛发生率为(77.91±5.53)%,长度为(1.63±0.67)μm;FGF18 浓度为5 ng/ml 时,初级纤毛发生率为(52.91±5.61)%,长度为(2.67±0.90)μm;FGF18浓度为10 ng/ml 时,初级纤毛发生率为(42.12±5.20)%,长度为(2.71±0.97)μm;FGF18 浓度为20 ng/ml 时,初级纤毛发生率为(36.53±4.88)%,长度为(2.76±1.37)μm;FGF18 浓度为40 ng/ml 时,初级纤毛发生率为(33.44±5.98)%,长度为(2.79±1.13)μm。与0 ng/ml组相比,各浓度组初级纤毛表达水平和长度的差异均有统计学意义(P均<0.05)。
三、初级纤毛参与FGF18 对软骨细胞增殖和表型的调控
根据前面实验结果,选择FGF18 组中FGF18 的浓度为20 ng/ml。如图3 所示,FGF18 组干预48 h、72 h 后软骨基质的分泌增多,有效维持软骨细胞活性和软骨表型。而水合氯醛组初级纤毛表达明显下调(9.10%±2.44%),凋亡软骨细胞比例增加(活细胞占比为72.86%±2.95%),而水合氯醛+FGF18组初级纤毛的表达水平没有明显变化(10.01%±2.23%),同时伴有一定比例的细胞凋亡(活细胞占比为76.94%±5.62%),相比对照组(纤毛发生率为77.91%±5.53%,活细胞占比为96.81%±1.38%)和FGF18 组(纤毛发生率为36.53%±4.88%,活细胞占比为96.29%±2.17%)均明显降低,差异均具有统计学意义(P均<0.05)。
CCK8细胞活性实验的结果显示,FGF18组软骨细胞的增殖活性上调,而当水合氯醛破坏纤毛结构后,不论是否再加入FGF18,软骨细胞的增殖活性较FGF18 组均明显受到抑制,差异均具有统计学意义(P均<0.05)。此外,破坏初级纤毛结构能够明显抑制FGF18 对软骨基质的促分泌作用,并且明显下调软骨表型相关基因COLⅡ和SOX9 的表达,结果与FGF18 组相比,差异均具有统计学意义(P均<0.05)。

图2 不同浓度FGF18对初级纤毛表达水平和长度变化的影响 a~e:初级纤毛的荧光染色;f:不同浓度组初级纤毛的发生率;g:不同浓度组初级纤毛的长度(*P<0.05)
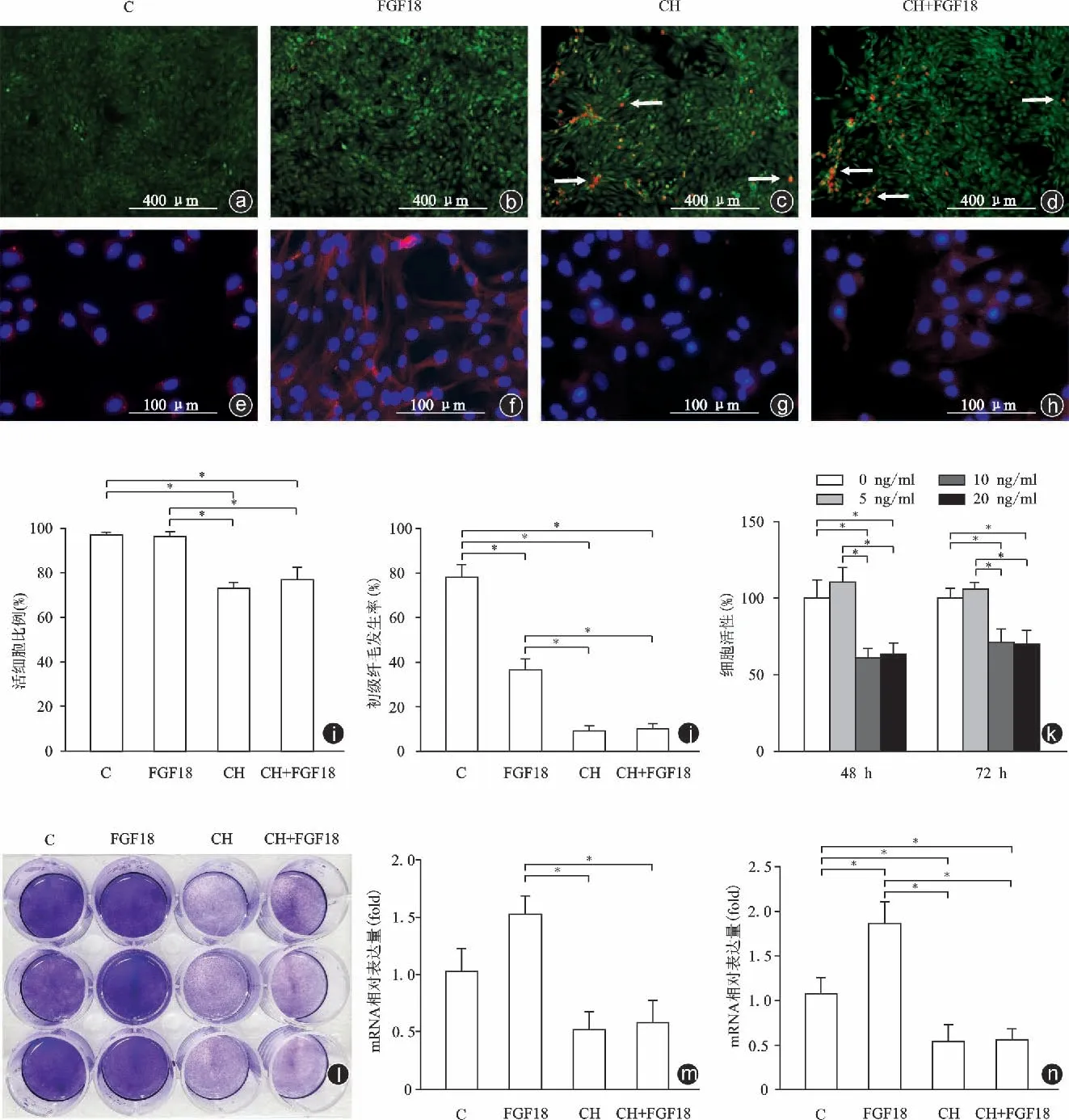
图3 初级纤毛参与FGF18对软骨细胞增殖和分化发育的调控 a~d:Live/dead荧光染色;e~h:初级纤毛的荧光染色;i:活细胞所占比例;j:初级纤毛的发生率;k:药物干预48 h和72 h后细胞增殖活性;l:甲苯胺蓝染色;m:药物干预后表型相关基因COL Ⅱ的mRNA相对表达量;n:药物干预后表型相关基因SOX9的mRNA相对表达量(C:对照,CH:水合氯醛,*P<0.05)
四、ERK通路参与FGF18对软骨发育的调控
如图4所示,20 ng/ml FGF18能够明显促进增殖蛋白CyclinD1 和表型蛋白COLⅡ表达增加,而水合氯醛破坏初级纤毛结构后,FGF18 对相关蛋白的促表达作用受到抑制,与对照组和FGF18 组相比,差异均有统计学意义(P均<0.05)。与此同时,FGF18能维持P⁃ERK 的表达,并且呈上调趋势;破坏纤毛结构后,P⁃ERK 的表达降低,此时再加入FGF18时,其对P⁃ERK 的促表达效应明显受到抑制。与FGF18组相比,水合氯醛组中P⁃ERK/T⁃ERK 的比值均明显下降,差异均有统计学意义(P均<0.05)。
讨 论
FGF18作为成纤维细胞生长因子家族中的重要成员,是一种具有潜力可以改善骨关节炎疾病的药物,对调控软骨细胞的生长发育具有非常重要的作用,同时因其具有较少的副作用,表现出重要的临床应用价值,但是目前对FGF18调控软骨发育机制的认识仍十分有限。研究发现,FGF18 能够作为软骨合成代谢的促进因子。体内环境中,FGF18 广泛分布于软骨膜和关节间隙,可以作为软骨细胞增殖的启动因子,促进胞内物质的合成代谢[11]。FGF18能特异性结合FGFR3 活化FGF 信号通路来调控软骨基质的合成及分泌,进而调控软骨发育[6]。FGF18还能参与调控骨髓间充质干细胞的软骨诱导分化,促进软骨基质的分泌并且延缓细胞向终末期肥大软骨细胞分化[12]。FGF18还能参与骨关节炎软骨组织的再生修复,延缓软骨退变。例如,FGF18可以通过调控PI3K⁃AKT信号传导减弱白细胞介素1β(Interleukin⁃1β,IL⁃1β)诱导的细胞凋亡,同时增强线粒体融合和裂变,恢复线粒体功能并减少炎症因子诱导的活性氧(Reactive oxygen species, ROS)产生[6]。FGF18能够促进骨关节炎软骨细胞Ⅱ型胶原表达并分泌更多的透明软骨细胞基质,促进功能化的软骨再生[11]。在关节腔内注射FGF18 能延缓创伤性关节炎软骨退变,增加软骨厚度,而FGF18 在体内的抗分解代谢效应可以通过调控金属蛋白酶组织抑制因子1(tissue inhibitors of metalloproteinase⁃1,Timp1)的表达来发挥效应[13]。而在骨关节炎病人中,关节腔内注射FGF18 能减少软骨厚度与体积的丢失,并且呈一定的浓度依赖性[14]。目前,FGF18在临床的应用价值不断得到重视,深入认识其软骨保护作用机制具有重要的研究价值。
初级纤毛作为具有多样功能的细胞器结构,被证实能够参与调控软骨组织发育,软骨力学信号转导,软骨相关疾病和软骨肿瘤的发生[8,10,15,16]。初级纤毛结构和功能的完整性对维持细胞内稳态,调控软骨生长发育至关重要。研究发现,FGFR 能够通过与细胞内激酶的交互作用来影响初级纤毛的长度和功能[17]。而调节FGFR3 介导的FGF 信号能够影响初级纤毛的长度和物质转运功能,初级纤毛是FGF通路中重要的组成部分[15]。这些研究有助于认识异常的FGF 信号和初级纤毛在软骨发育不全和软骨肿瘤发生过程中的作用及机制。而本研究发现,不同浓度的FGF18 对体外培养的软骨细胞具有明显的促增殖活性,并且在20 ng/ml 浓度时表现出最显著的促增殖效应。初级纤毛作为一种由微管结构聚合而成的细胞器,其在结构上与纺锤体同源,参与细胞的分裂周期,在功能上又具有感受外界理化刺激、转导信号分子等多种功能,其表达水平和长度改变能反应细胞新陈代谢和功能的变化。

图4 ERK通路参与FGF18对软骨细胞增殖和表型的调控 a:不同组别中表型蛋白COL Ⅱ、增殖蛋白CyclinD1、通路蛋白P⁃ERK和T⁃ERK的表达情况;b:定量分析COL Ⅱ蛋白的相对表达量;c:定量分析CyclinD1蛋白的相对表达量;d:定量分析P⁃ERK/T⁃ERK 的蛋白表达比值(C:对照,CH:水合氯醛,*P<0.05)
在本研究中,通过分析软骨细胞初级纤毛的发生率和长度变化时发现,随着FGF18 浓度的增加,初级纤毛的表达水平逐渐降低,但是其纤毛的平均长度则逐渐增加。这可能是因为FGF18 能够通过启动细胞进入分裂周期,促进了初级纤毛结构和纺锤体结构的转化,初级纤毛微管解聚并且重新聚合为纺锤体样结构,细胞进入增殖状态,此时细胞代谢活动增加,细胞内物质转运活跃,在纺锤体与初级纤毛周期性转化的同时也在不断强化初级纤毛的物质转运功能,包括对营养物质和信号蛋白的转运,从而又促进纤毛的延长以强化其物质转运、信号转导和理化感受器等功能[18]。而破坏初级纤毛后,FGF18对软骨基质的促分泌作用受到抑制,增殖活性受到抑制,凋亡软骨细胞增加,下调软骨表型基因表达,同时在蛋白水平抑制FGF18 对软骨细胞增殖和表型蛋白的促表达效应。说明破坏初级纤毛结构后,软骨细胞内新陈代谢紊乱,微管结构破坏,无法实现纺锤体和初级纤毛的结构转化,细胞增殖活性受到抑制,而初级纤毛结构的破坏使得其物质转运功能、感受器功能和信号转导功能均受到破坏,也直接影响了软骨细胞对微环境变化的反应和适应能力,并且阻断了纤毛相关信号通路的转导,进而对软骨细胞包括增殖、分化等多种生命活动产生负面调控效应[19]。因此,初级纤毛结构和功能的完整性可能影响FGF18 对软骨细胞增殖和表型维持的调控过程,而初级纤毛在软骨细胞内的解聚、重构以及延伸变化可能是影响FGF18 发挥生物学效应的重要调节因素,也为探究FGF18 介导的软骨发育调控机制提供了新的思路。