氨基酸功能化Dawson结构磷钨酸盐的制备及催化合成苯甲酸
2020-04-04周德志叶志刚曹小华占昌朝
周德志 ,叶志刚 ,2,曹小华 ,2,占昌朝 ,2,王 珏
(1. 九江学院 化学与环境工程学院,江西 九江 332005;2. 江西省生态化工工程技术研究中心,江西 九江 332005)
苯甲酸是一种重要的化工原料,可用作抑菌剂、防腐剂、定香剂、润滑剂、涂料助剂及制药和染料的中间体[1]。目前工业上主要通过甲苯的液相催化空气氧化法制备苯甲酸,虽然工艺成熟、产品收率高,但能耗高、环境污染严重[2]。随着环保法规日趋严格及人们环保意识的日益增强,苯甲酸绿色合成工艺的开发备受关注[2-10]。
近年来,国内外学者开发了系列催化剂催化30%(w)H2O2氧化苯甲醛合成苯甲酸绿色新工艺,取得了较好的效果[3-10]。其中,Keggin结构杂多酸(盐)因独特的组成与结构,在催化30%(w)H2O2氧化苯甲醛合成苯甲酸反应中表现出优异的催化活性[6-10]。但尚未见Dawson结构杂多酸(盐)催化氧化苯甲醛合成苯甲酸的相关报道。氨基酸可通过离子键、氢键或共价键引入到多酸体系中,对杂多酸进行功能化修饰,优化催化剂的催化等性能[11]。
本工作制备了新型L-精氨酸功能化Dawson结构磷钨酸([Arg]3P2W18O62·nH2O)催化剂,采用了EDS,FTIR,SEM,XRD,BET,TG等分析方法对催化剂的结构进行表征,研究了催化剂催化30%(w)H2O2氧化苯甲醛合成苯甲酸的优化工艺。
1 实验部分
1.1 原料与仪器
H6P2W18O62·13H2O:自制[12];苯甲醛、30%(w)H2O2、L-精氨酸:分析纯,中国医药集团上海化学试剂公司。
1.2 [Arg]3P2 W18O62·nH2O催化剂的制备
采用文献[11]的方法制备[Arg]3P2W18O62·nH2O催化剂:将11.73 g Dawson结构磷钨酸和1.31 g L-精氨酸分别溶于20 mL蒸馏水中,然后在磁力搅拌下,将磷钨酸溶液滴加到L-精氨酸溶液中,控温90 ℃,边反应边蒸发,得浅黄色固体。120 ℃下干燥3.0 h,研细,即得([Arg]3P2W18O62·nH2O)催化剂。
1.3 苯甲酸的合成
将10.20 mL(100 mmol)苯甲醛、一定量的[Arg]3P2W18O62·nH2O和30%(w)H2O2依次加入到100 mL圆底烧瓶。油浴控制反应温度为80~100 ℃,磁力搅拌回流2.0~4.0 h。反应结束后,趁热将反应液倒入烧杯中,然后放入冰箱中静置过夜,即有大量固体析出,抽滤、冷水洗涤、得白色产品。
2 结果与讨论
2.1 催化剂的表征结果
2.1.1 FTIR表征结果
图1为催化剂的FTIR谱图。由图1可知,[Arg]3P2W18O62·nH2O(图 1b)分别在 912.64,962.90,789.93,1 091.33 cm-1处出现特征峰,与H6P2W18O62·13H2O(图1a)的特征吸收峰基本一致[12],未发现Keggin结构磷钨酸的特征吸收峰,说明功能化后磷钨酸仍保持Dawson结构。此外,[Arg]3P2W18O62·nH2O在3 360,3 201,1 736,1 660,1 499,522 cm-1处出现吸收峰,与L-精氨酸的特征峰[13]吻合,只是部分发生红移或蓝移。说明[Arg]3P2W18O62催化剂中L-精氨酸结构保持良好。

图1 H6P2W18O62·13H2O(a)和[Arg]3P2W18O62·nH2O (b)的FTIR谱图Fig.1 FTIR spectra of H6P2W18O62·13H2O(a) and[Arg]3P2W18O62·nH2O(b) .Arg:L-arginine.
2.1.2 XRD表征结果
图2为功能化前后催化剂的XRD谱图。由图2可知,Dawson结构磷钨酸(图2a)的3组特征衍射峰分别在31°~38°,25°~30°,17°~22°[12],而[Arg]3P2W18O62·nH2O(图 2b)在 22°~ 28°,50°~65°处出现宽化衍射峰,两者特征衍射峰差异很大。说明[Arg]3P2W18O62·nH2O催化剂晶化不完全,试样粒子较大。
“互联网+”亲职教育是未来亲职教育发展的必然趋势,是互联网与教育之间的深度耦合,将对教育产生深刻的变革。可是,至今在全国范围内并没有形成成熟的教育模式。究其原因,其中很重要的一点就是跨界人才的缺乏。
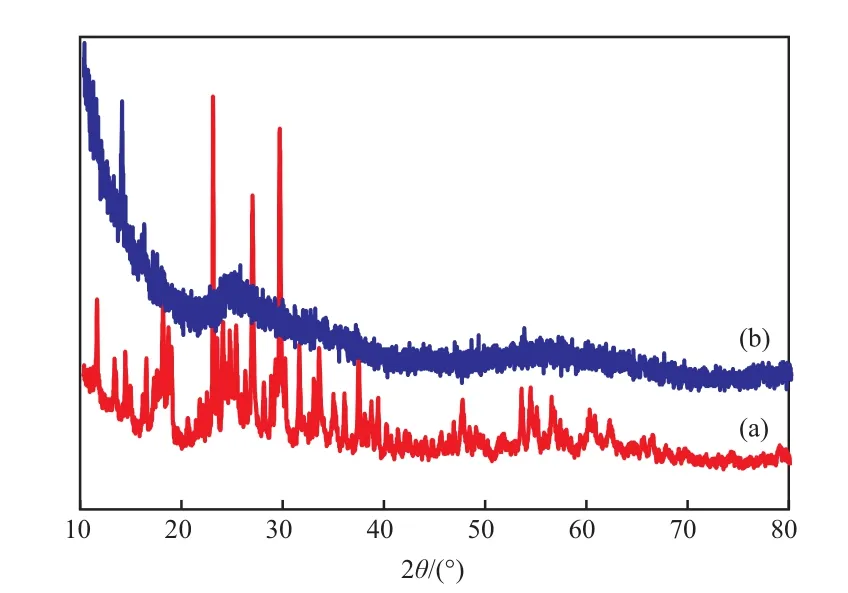
图2 H6P2W18O62·13H2O(a)和[Arg]3P2W18O62·nH2O (b)的XRD谱图Fig.2 XRD patterns of H6P2W18O62·13H2O(a) and[Arg]3P2W18O62·nH2O(b).
2.1.3 EDS表征结果
图3为H6P2W18O62·13H2O和[Arg]3P2W18O62·nH2O的EDS谱图。从图3b可观察到C,N,O,P,W元素的特征峰,定量分析发现C/N原子个数比接近3∶2,与L-精氨酸分子式(C6H14N4O2)吻合;W/P原子个数比约为9,与H6P2W18O62·13H2O(图3a)分子式中W/P原子个数比接近,证明L-精氨酸功能化后磷钨酸仍保持Dawson结构。由于H元素相对原子质量太小,未观察到特征峰。
2.1.4 SEM表征结果
图4为催化剂的SEM照片。从图4可看出,H6P2W18O62·13H2O(图4a)呈规则的酵母状[12],而[Arg]3P2W18O62·nH2O(图4b)呈碗状,且部分发生团聚结块,晶型差,粒子颗粒较大,比表面积减少。SEM表征结果与XRD表征结果一致。

图3 H6P2W18O62·13H2O(a)和[Arg]3P2W18O62·nH2O (b)的 EDS 谱图Fig.3 EDS spectra of H6P2W18O62·13H2O(a) and[Arg]3P2W18O62·nH2O(b).

图4 H6P2W18O62·13H2O(a)和[Arg]3P2W18O62·nH2O(b)的SEM照片Fig.4 SEM images of H6P2W18O62·13H2O(a) and[Arg]3P2W18O62·nH2O(b).
2.1.5 TG分析结果
图5为[Arg]3P2W18O62·nH2O的TG曲线。由图5可知,[Arg]3P2W18O62·nH2O的失重过程分为3个阶段。第一阶段为60~230 ℃,对应结晶水的失去;第二阶段为230~330 ℃,与L-精氨酸的分解温度244 ℃相吻合,对应精氨酸分子分解;第三阶段为330~600 ℃,为结构性失水,即磷钨酸盐开始分解为钨氧化合物,其中,300~500 ℃区间失重较快,500~600 ℃区间失重缓慢。
2.1.6 BET测试结果
表1为H6P2W18O62·13H2O和[Arg]3P2W18O62·nH2O 的BET表征结果。由表1可知,与H6P2W18O62·13H2O相比,[Arg]3P2W18O62·nH2O的粒径增大,孔体积和比表面积相应减小。这是因为在催化剂制备温度下存在水蒸气,在水蒸气作用下,多酸微粒不断发生溶解与缩合作用而生成大的微粒,相应生成了较大的孔径,总比表面积减小,结构趋于稳定。
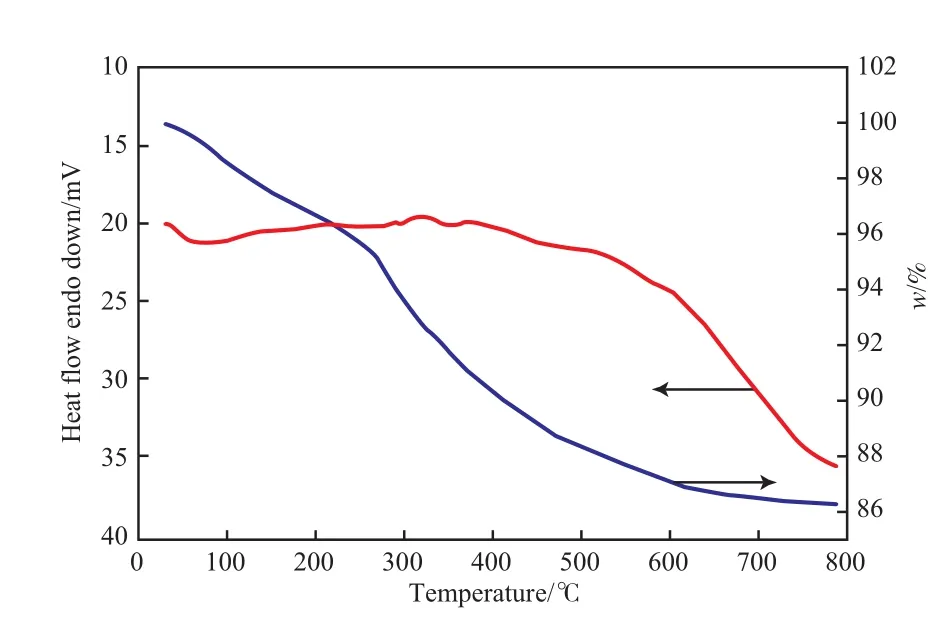
图5 [Arg]3P2W18O62·nH2O的TG曲线Fig.5 TG curves of [Arg]3P2W18O62·nH2O.

表1 H6P2W18O62·13H2O和[Arg]3P2W18O62·nH2O 的BET表征结果Table 1 Results of BET for H6P2W18O62·13H2O and[Arg]3P2W18O62·nH2O
2.2 苯甲酸合成工艺条件的优化
2.2.1 催化剂用量的影响
催化剂用量对苯甲酸收率的影响见图6。由图6可知,随催化剂用量的增加,反应活性分子数增加,收率提高。当催化剂用量超过0.4 g后,产物收率开始下降。这是因为催化剂用量过多促使H2O2无效分解,有效氧化反应不充分[8]。因此,催化剂适宜的用量为0.4 g(占原料质量分数为1.4%)。
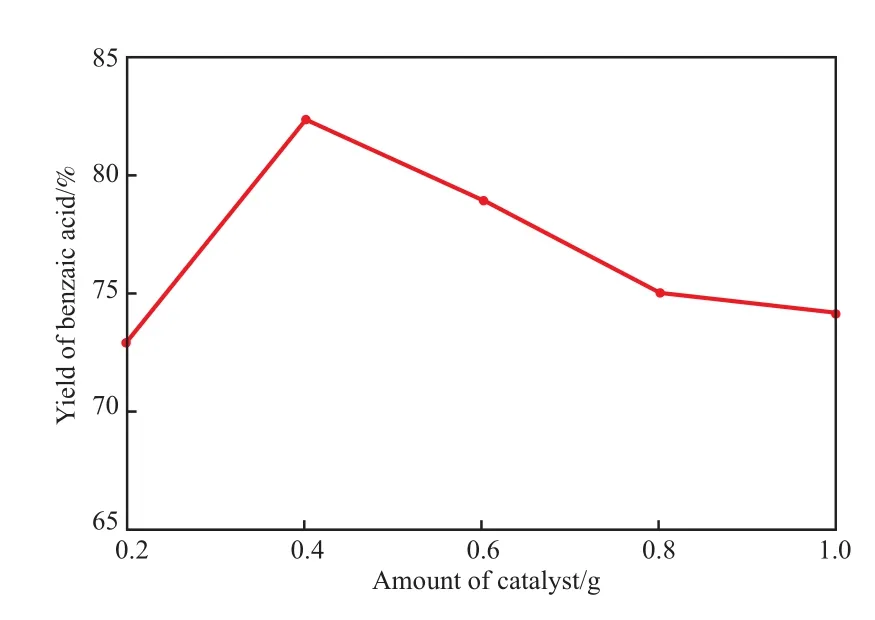
图6 催化剂用量对苯甲酸收率的影响Fig.6 Effect of the amount of catalyst on the yield of benzoic acid.Reaction conditions:10.20 mL benzaldehyde,55 mL 30%(w) H2O2,85 ℃,3.0 h.
2.2.2 H2O2用量的影响
H2O2用量对苯甲酸收率的影响见图7。由图7可看出,当H2O2用量为55 mL时,产物收率最高。H2O2用量不足时,氧化反应不充分,反应停留在中间体阶段,产物颜色偏黄;H2O2用量过多时,产物会进一步深度氧化裂解,致使收率下降[10]。因此,30%(w) H2O2的适宜用量为55 mL,即n(苯甲醛)∶n(H2O2)=1∶5。

图7 H2O2用量对苯甲酸收率的影响Fig.7 Effect of H2O2 amount on the yield of benzoic acid.Reaction conditions:10.20 mL benzaldehyde,0.4 g [Arg]3P2W18O62·nH2O,85 ℃,3.0 h.
2.2.3 反应时间的影响
图8为反应时间对苯甲酸收率的影响。从图8可看出,反应时间少于3.0 h时,反应不完全,产物收率较低;当反应时间为3.0 h时,反应充分完成,产物收率最高;再继续反应,则加速了产物深度氧化,收率反而下降。因此,适宜的反应时间为3.0 h。
2.2.4 反应温度的影响
图9为反应温度对苯甲酸收率的影响。

图8 反应时间对苯甲酸收率的影响Fig.8 Effect of reaction time on yield of benzoic acid.Reaction conditions:10.20 mL benzaldehyde,55 mL 30%(w) H2O2,0.4 g[Arg]3P2W18O62·nH2O,85 ℃.

图9 反应温度对苯甲酸收率的影响Fig.9 The effect of reaction temperature on yield of benzoic acid.Reaction conditions:10.20 mL benzaldehyde,55 mL 30%(w) H2O2,0.4 g [Arg]3P2W18O62·nH2O,3.0 h.
从图9可知,当温度较低时,催化剂活性低,反应速度慢,氧化不充分(可观察到反应液始终出现较多黄色油状物质),产物收率较低;随反应温度地升高,产物收率增加,90 ℃时收率最高;进一步升高温度,可能加快了H2O2的无效分解及加速了产物深度氧化(颜色逐渐开始发黄变黑),收率下降。因此,适宜的反应温度为90 ℃。
2.2.5 平行实验
在优化条件下,即苯甲醛10.20 mL、30%(w)H2O255 mL、[Arg]3P2W18O62·nH2O 0.4 g、90 ℃、3.0 h条件下,进行5次平行实验。实验所得苯甲酸收率分别为89.9%,90.1%,89.3%,90.2%,89.7%,89.1%,平均收率为89.9%。5次平行实验产物收率变化很小,说明优化条件下催化工艺运行稳定。
2.2.6 催化剂重复使用次数的影响
反应结束后,将抽滤分离产物时所得滤液蒸发浓缩至10 mL左右,再补加10.20 mL苯甲醛和55 mL 30%(w)H2O2,在90 ℃下反应3.0 h,考察了催化剂重复使用性能,实验结果见图10。由图10可知,当催化剂重复利用5次时,苯甲酸收率仍可达80.4%。因此,催化剂稳定性较好,且具有较好的重复使用性能。随着重复使用次数增加,苯甲酸收率都会有所下降。这是因为重复使用过程中催化剂活性组分酸脱溶,有效组分含量减少,催化效果减弱。同时反应中副产物覆盖在催化剂活化中心,造成催化剂“中毒”,降低了催化活性。

图10 催化剂的重复使用次数对苯甲酸收率的影响Fig.10 Effect of repeated use of catalyst on yield of benzoic acid.Reaction conditions:10.20 mL benzaldehyde,55 mL 30%(w) H2O2,0.4 g [Arg]3P2W18O62·nH2O,90 ℃,3.0 h.
3 结论
1)以自制H6P2W18O62·13H2O及L-精氨酸为原料制备了[Arg]3P2W18O62·nH2O催化剂,L-精氨酸功能化后磷钨酸的Dawson结构未发生改变,但L-精氨酸功能化后催化剂形貌发生了较大变化。
2)以30%(w)H2O2为氧化剂、[Arg]3P2W18O62·nH2O为催化剂,当n(苯甲醛)∶n(H2O2)=1∶5,反应时间为3.0 h,反应温度为90 ℃时,苯甲酸的收率最高,可达89.9%。在此优化条件下催化剂重复使用5次,苯甲酸收率仍能达80.4%。
