BES 对污泥厌氧发酵产酸性能的影响
2020-04-03陈思远陈刚高彩琪董姗燕刘祖文
陈思远, 陈刚, 高彩琪, 董姗燕,b, 刘祖文,b
(江西理工大学,a. 建筑与测绘工程学院;b. 赣江流域水质安全保障工程技术研究中心,江西 赣州341000)
0 引 言
生物除磷和生物反硝化脱氮过程均需要有机碳源,对于低碳源的城镇生活污水而言,污水中有机物浓度往往不能同时满足这两个过程的需要[1]。在实际工程应用中,为了使低碳源污水达到同步脱氮除磷的效果, 可以通过投加外碳源来提高碳氮比,但会增加污水处理的成本。其次,大量剩余污泥的处理和处置也成为污水处理厂面临的棘手问题。因此,近年来利用剩余污泥开发碳源成为新的研究热点[2]。
污泥厌氧发酵过程分为水解、酸化、产乙酸和产甲烷等一系列阶段。为了实现污泥厌氧发酵过程中酸的积累,需要抑制产甲烷过程,使其停留在产氢产乙酸阶段。 目前,产甲烷抑制技术主要包括生物动力学参数控制(如调节pH、HRT)和添加化学抑制剂两大类,其中化学抑制剂因操作简单、见效快等优点而被广泛用于各种产甲烷代谢途径及相关的碳流和电子流研究中[3]。
李军等[4]研究发现,在污泥厌氧发酵开发碳源的试验中,当酸化液中溶解态有机物(SCOD)、挥发性脂肪酸(VFAs)分别降低且酸化液SCOD 浓度小于进泥SCOD 浓度时,投加三氯甲烷(CHCl3)24 h后,酸化液SCOD、VFAs 值迅速增加,即三氯甲烷对产甲烷菌的活性具有明显的抑制作用。Norma 等[5]研究表明,乙炔(C2H2)能够抑制厌氧降解工艺中甲烷的生成,同时促进产氢、产丁酸过程。 张丽杰等[6]在研究C2H2和CHCl3对餐厨垃圾中甲烷减排影响的实验研究中发现, 二者都能较好地抑制甲烷的释放, 且乙炔对产甲烷菌的抑制效果比氯仿更显著;当乙炔含量分别为0.1%和1.2%时,甲烷抑制率分别达到83.42%和100%,但高浓度的乙炔对产酸菌有抑制作用。 刘和等[7]采用溴乙烷磺酸盐(BES)和CHCl3作为抑制剂研究污泥厌氧发酵产酸过程,结果表明:污泥未添加抑制剂时,甲烷产量基本没有延滞期并快速增加; 添加BES (50 mmol/L) 和CHCl3(0.05%)的两组实验中,甲烷抑制率均达到95%左右,乙酸含量明显积累,且添加BES 的实验组中乙酸的最终积累量比添加CHCl3的实验组中高。 罗艳等[8]研究发现,4-氯酚对厌氧颗粒污泥产甲烷的活性具有一定的抑制作用,当4-氯酚的质量浓度为400 mg/L、500 mg/L、600 mg/L 时,甲烷抑制率分别为31%、68%、54%,即随着4-氯酚浓度的增加, 厌氧颗粒污泥的产甲烷的活性显著下降。 江水英等[9]研究了CaO2对污泥厌氧消化性能的影响,发现污泥中CaO2的存在会严重抑制产甲烷菌的活性,且随着CaO2投加量的增加抑制程度加剧。
综上所述,目前研究较多的产甲烷抑制剂主要为有机类化合物, 其中BES 是产甲烷细菌辅酶M的结构类似物, 适量BES 能有效抑制产甲烷菌的活性。 然而,基于污泥的碱预处理及BES 不同浓度变化对污泥厌氧发酵产酸性能的影响研究却鲜有报道。 本研究采用碱预处理的方法对污泥进行破解, 研究不同BES 浓度下污泥发酵液中各组分浓度的变化状况,为进一步研究污泥厌氧发酵产酸过程中产甲烷抑制机制提供必要的基础数据。
1 材料与方法
1.1 实验装置
污泥厌氧发酵产酸装置主要由四部分组成:一是厌氧发酵罐,罐体为圆柱形,呈密闭状态,直径20 cm、高30 cm,总容积为9.42 L;二是搅拌装置,平均每8 h 搅拌一次, 每次搅拌15 min, 转速为150 r/min,目的是加快厌氧发酵产酸速率;三是恒温水浴装置,水箱温度设置为30 ℃,实现中温厌氧发酵产酸;四是排气装置。图1 为实验装置简图,实际实验过程,水浴装置中有5 个厌氧发酵罐同时进行厌氧发酵,每个发酵罐配有相应的搅拌装置和排气装置。
1.2 污泥来源及性质
实验所用污泥为赣州市某污水处理厂储泥池的湿污泥和脱水机房的干污泥,湿污泥用于碱预处理和厌氧发酵,干污泥用于种泥的培养和驯化。 原始湿污泥性质见表1。

图1 厌氧发酵装置简图

表1 污泥性质
为了缩短厌氧发酵产酸时间和提高产酸量,湿污泥首先采用碱预处理法进行细胞破壁。取6 L 湿污泥,用2 mol/L NaOH 溶液将其pH 值调节为11,静置2 h 后,测定污泥性质。由表1 可知,污泥经碱处理后, 溶出了大量有机物,SCOD 比未处理前增加了近2 倍, 溶解态蛋白质 (SP) 和溶解态多糖(SC) 也分别增加了2.5 倍和1.5 倍;NH3-N、TN 和TP 含量均有所升高,同时TSS 含量显著下降。
1.3 种泥的培养与驯化
称取975 g 干污泥于1000 mL 烧杯中,加入适量自来水充分浸泡,置于104 ℃的烘箱中加热2 h,杀灭污泥中的产甲烷细菌。 将加热后的污泥取出冷却后,加入配置好的营养液[10](葡萄糖14.40 g/L,酵 母 膏3.20 g/L,KH2PO40.56 g/L,MgSO4·7H2O 0.96 g/L,NH4Cl 2.40 g/L,CaCl20.72 g/L,NaHCO30.96 g/L,MnCl20.11 g/L,FeSO4·7H2O 0.12 g/L)和自来水至1 L, 然后将其倒入15 L 厌氧发酵桶中,再加入8 L 自来水, 在35 ℃的恒温水浴锅中进行种泥驯化。 每日测定发酵液pH 值,pH 值的变化如图2 所示。从图2 可以看出,pH 值随发酵时间逐渐降低,至第7 d,pH 值快速降至4,随后缓慢下降,第14 d 时pH 值为3.59,由此判断种泥驯化成功。
1.4 污泥厌氧发酵产甲烷抑制实验
取5 L 碱处理后的污泥与5 L 种泥按照1∶1 的体积比混合,接种污泥的性质见表1。 在5 个厌氧发酵罐内分别加入2 L 接种污泥, 发酵罐编号为0、1、2、3、4。其中,0 号发酵罐不添加任何物质,作为空白对照; 1、2、3、4 号发酵罐分别添加5、 10、15、20 mmol/L 的BES 进行厌氧发酵。 从实验启动的第2 天开始,每日取适量发酵液,离心过滤后测定污泥上清液性质。 每日取样后用NaOH 调节1 次发酵液pH 值, 使其维持在碱性条件下(pH=11)。

图2 pH 值变化曲线
1.5 分析项目与测定方法
各指标测定方法参考环境保护部颁布的《水和废水监测分析方法(第四版)》,具体测试指标及测试方法见表2。

表2 检测指标及分析方法
2 结果与讨论
2.1 BES 对SCOD、SP 和SC 的影响

图3 SCOD 浓度变化曲线
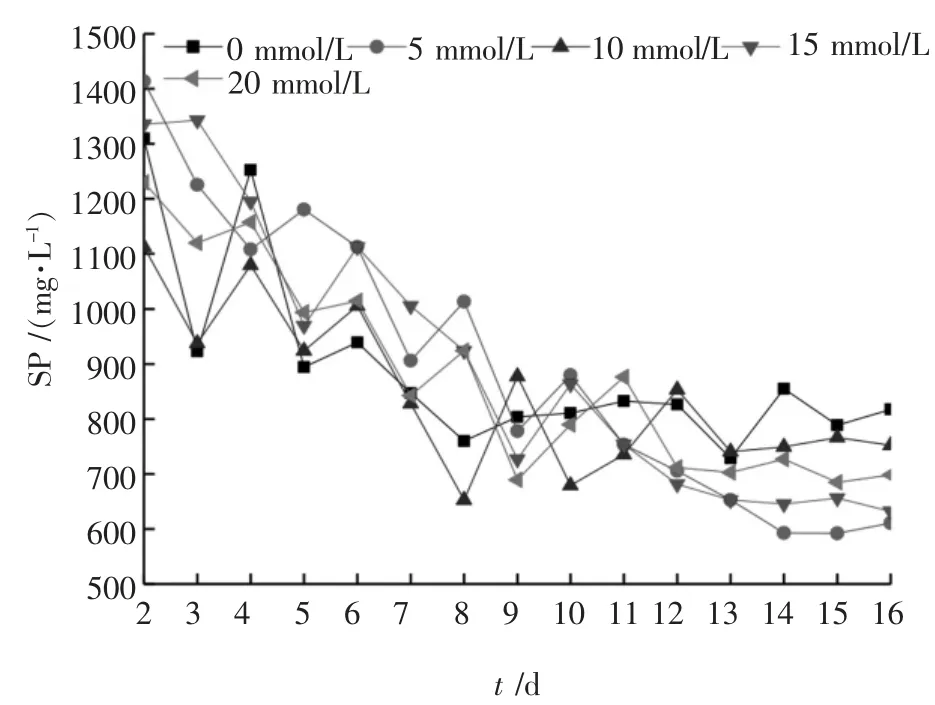
图4 SP 浓度变化曲线

图5 SC 浓度变化曲线
图3 、图4、图5 分别为厌氧发酵罐中投加不同浓度BES 的SCOD、SP 和SC 的变化状况。SCOD 浓度反映了厌氧发酵过程中颗粒态有机物的水解产酸效果。 不同BES 浓度下,各发酵罐内SCOD 浓度随发酵时间的推移总体呈上升趋势,约在第13 d 趋于稳定。 在发酵的第13 ~16 d 四天内,0 ~4 号发酵罐内SCOD 平均浓度分别为26664.25、33043.25、29664.00、29048.00、29008.00 mg/L,其中1 号发酵罐内SCOD 浓度相较于空白组(未添加BES)增加了23.92%。 由此可知,在发酵过程中,BES 对产甲烷过程具有一定的抑制作用, 且BES 为5 mmol/L时生成的SCOD 最多。 同时,碱性发酵是污泥厌氧发酵产酸及污泥减量的有效方法[11]。 由于厌氧发酵过程中每日用NaOH 调节1 次发酵液pH, 使其维持在碱性条件下,因而对污泥发酵液中SCOD 浓度的增加也起到一定的促进作用。
剩余污泥中含有大量的胞外聚合物(EPS),其中蛋白质和糖类化合物是其主要组成部分[12]。 厌氧水解过程能将颗粒态有机物质释放到发酵液中,且只有SP 和SC 才能被厌氧微生物所利用[13]。 由图4可知,各发酵罐内SP 浓度总体处于下降趋势。趋于稳定后的四天(13 ~16 d)内,0~4 号发酵罐中SP 平均浓度分别为820.15、565.61、755.89、644.43 mg/L、703.17 mg/L,其中1 号发酵罐内SP 浓度比空白组(未添加BES) 下降了31.04%, 即添加5 mmol/L BES 的发酵罐中溶解态蛋白质的下降趋势最显著,原因可能是发酵产酸菌大量利用SP 并产生更多的VFAs。
由图5 可知,SC 浓度呈现先上升再下降的趋势,趋于稳定后的四天(13 ~16 d)内,0 ~4 号发酵罐 中SC 平 均 浓 度 分 别 为315.29、217.97、271.43、228.93、335.85 mg/L, 其中添加5 mmol/L BES 的发酵罐内SC 浓度最低, 相较于空白下降了30.86%。SC 最初上升的原因可能是碱性条件下部分污泥细胞壁破坏或者部分微生物死亡释放胞内SC, 使得SC 的释放量大于消耗量; 随后在厌氧微生物的作用下,消耗多糖产生VFAs,且SC 消耗速率大于产生速率,导致多糖含量开始下降,并于13 d 左右趋于稳定。
2.2 BES 对VFAs 的影响
厌氧发酵不仅能将污泥中的有机质释放到发酵系统中,还能将有机质进一步转化成生物处理过程的优质碳源,如挥发性脂肪酸[14]。厌氧发酵产酸是指通过抑制产甲烷菌的活性将厌氧发酵过程控制在酸化阶段,使发酵液中VFAs 的产生效果最佳。 图6 为厌氧发酵后半段各发酵罐内VFAs 的变化状况。 由图6 可知, 各发酵罐内VFAs 的浓度逐渐升高, 并于13 d 左右趋于稳定。 在13~16 d 内,0~4 号发酵罐中VFAs 的平均浓 度 分 别 为 464.12、 662.73、647.55、633.02、624.95 mg/L, 相较于空白分别增加了42.79%、39.52%、36.39%和34.65%。

图6 VFAs 浓度变化曲线
BES 作为产甲烷菌辅酶M 的典型结构类似物被认为可以特异性地抑制产甲烷菌的活性[15],且BES 可以有效促进污泥厌氧发酵过程中VFAs 的积累[16]。 本实验中,随着BES 浓度的增加,VFAs 的生成量有所降低, 可能是高浓度的BES 对产酸菌亦会产生一定的抑制作用, 且添加5 mmol/L BES的发酵罐内VFAs 生成量最多, 这与刘和等[6]、Siriwongrungson 等[17]采用单一的BES 浓度研究结果不同,原因可能是由于实验所用污泥成分特性及实验条件不同,因而得到了不同的抑制产甲烷过程的BES 浓度。
2.3 BES 对TSS 的影响
TSS 浓度变化能在一定程度上反映污泥的厌氧发酵情况。 图7 为各发酵罐内TSS 的变化状况,由图7 可以看出, 各发酵罐内TSS 浓度逐渐下降,且下降的速率逐渐降低, 趋于稳定后的四天(13~16 d)内,0 ~4 号发酵罐中TSS 的平均浓度分别为37.98、27.85、34.57、34.47、30.82 g/L, 添 加BES的各发酵罐内TSS 浓度比空白组TSS 浓度显著降低,其中1 号发酵罐内TSS 的浓度比空白组下降了26.67%。 污泥TSS 的浓度变化趋势与发酵液中SCOD 的浓度变化趋势相反,表明添加BES促进了污泥中颗粒态有机质向溶解态有机质的转化过程。
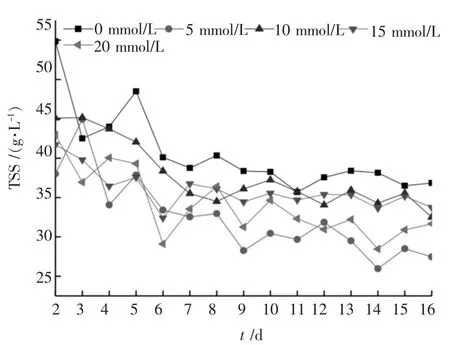
图7 TSS 浓度变化曲线
2.4 BES 对氮磷释放的影响
图8 、 图9 分别为不同BES 浓度下发酵液中TN、TP 浓度随时间变化状况。
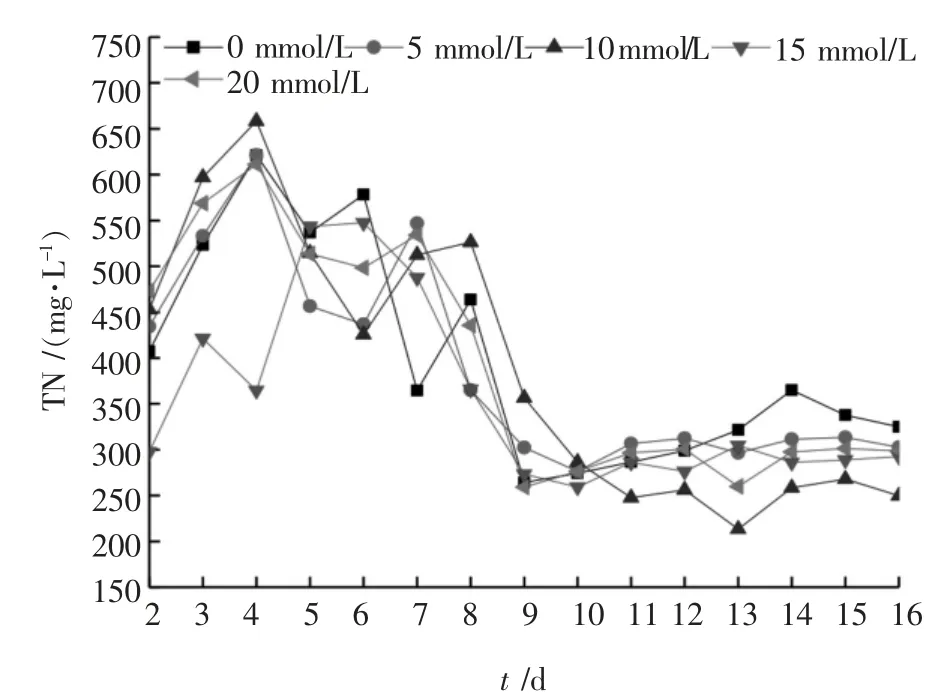
图8 TN 浓度变化曲线

图9 TP 浓度变化曲线
由图8 可以看出,各发酵罐内TN 浓度在最初的几天内快速上升,在6 ~13 d 左右逐渐下降,且下降的速率逐渐降低。在趋于稳定后的四天(13~16 d)内,0 ~4 号发酵罐内TN 的平均浓度分别为307.15、306.03、247.42、292.92、289.27 mg/L, 添加BES 的各发酵罐内TN 浓度均比空白组的TN 浓度低,其中2 号发酵罐内TN 浓度比空白组低19.45%。TN 浓度开始上升的原因可能是在碱性条件下, 污泥中蛋白质水解成溶解态含氮有机物, 导致TN 浓度开始增加;随后TN 浓度下降的原因可能是发酵液中铵根离子、磷酸根离子与污泥释放的金属离子(如Mg2+、Ca2+)结合生成难溶沉淀物质[3],且蛋白质水解速率小于难溶沉淀物质生成速率, 使得TN 浓度开始下降直至趋于稳定。 晏波等[18]、Cokgor 等[19]指出:发酵液中氮与磷的摩尔比大于1.1~1.6 时有利于沉淀物质生成。 由实验数据可知,发酵液中总氮与总磷摩尔比约为10~20,因此有利于沉淀物质的生成。
由图9 可以看出, 各发酵罐内TP 浓度逐渐下降, 添加BES 的各发酵罐内TP 浓度比空白组的TP 浓度低, 且添加5 mmol/L BES 的发酵罐内TP 浓度最低,原因可能是随时间的增加,厌氧发酵污泥在碱性条件下破壁, 释放出金属离子,与发酵液中的磷酸根离子和铵根离子结合形成难溶物质沉淀[3],这与发酵液中TN 浓度后期下降的原因是一致的。
3 结 论
1) 碱预处理有利于污泥中颗粒态有机质向溶解态有机质转化。相比于预处理前,污泥的固体含量显著下降, 同时溶出了大量可溶性有机物, 其 中TSS 下 降 了28.53%,SCOD 增 加 了93.07%。
2)BES 对产甲烷过程具有抑制作用。 添加BES的发酵罐内VFAs 和SCOD 的浓度均较空白显著升高,TSS 变化则相反,其中添加5 mmol/L BES 的发酵罐内VFAs 的最大平均累积量为662.73 mg/L,SCOD 相较于空白增加了23.92%,TSS 相对于空白下降了26.67%; 添加BES 的发酵罐内SP、SC浓度均较空白有所降低, 说明BES 促进了发酵产酸菌的生长, 并大量消耗水解生成的SP、SC;添加BES 的发酵罐内TN、TP 浓度均较空白有所降低,原因是碱性发酵促进了发酵液中磷酸根离子、铵根离子与金属离子的结合,并形成难溶物质沉淀。
3)高浓度BES 对发酵产酸过程有一定的抑制作用。 随着BES 浓度的升高, 反应稳定时发酵罐内VFAs 浓度呈下降趋势。 在考虑成本和产酸性能的前提下, 建议采用5~10 mmol/L 的BES 抑制污泥产甲烷过程和增强污泥发酵产酸过程。
