西达本胺联合苦参碱对皮肤T细胞淋巴瘤细胞系增殖、凋亡的影响及可能的凋亡机制
2020-04-03何杏兰王艺萌王冠钰张春雷
何杏兰 王艺萌 王冠钰 张春雷
北京大学第三医院皮肤科 100191
皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL)是一种原发于皮肤的T细胞克隆增生性非霍奇金淋巴瘤。绝大多数CTCL病程较长,疾病发展缓慢,但目前尚缺乏治愈的方法[1]。西达本胺是我国自主研发合成的、拥有自主知识产权的选择性组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi),在多种肿瘤的治疗上显示出良好的疗效及低毒性[2]。苦参碱为中药苦参的一种提取物,大量肿瘤细胞系及相关动物模型实验均显示其高抗肿瘤作用[3]。本研究旨在观察西达本胺和苦参碱对CTCL细胞系HH和Hut78增殖、凋亡的影响,并通过进一步检测细胞凋亡相关蛋白的表达,初步研究西达本胺联合苦参碱治疗CTCL的潜在机制。
材料与方法
一、细胞来源与试剂
HH细胞系(ATCC号CRL-2105),Hut78细胞系(ATCC号TIB-161),RPMI 1640培养基(美国Gibco公司)、胎牛血清(美国HyClone公司),西达本胺(美国Selleck公司,目录号S8567),苦参碱(中国科学院成都生物研究所),MTS细胞增殖检测试剂盒(美国Promega公司),异硫氰酸荧光素-膜联蛋白Ⅴ(FITC-AnnexinⅤ)凋亡检测试剂盒(美国BD公司),兔抗人多克隆抗体胱天蛋白酶(caspase)3(美国Cell Signaling公司)、兔抗人多克隆抗体核因子(NF)κB p65、兔抗人单克隆抗体p-Bad、兔抗人单克隆抗体Bad、兔抗人单克隆抗体E钙黏蛋白(cadherin)、兔抗人单克隆抗体Bcl-2、鼠抗人单克隆抗体GAPDH(北京普利莱基因技术有限公司)。
将1 mg西达本胺粉末溶于2.5614 ml二甲基亚砜(DMSO)中配置为1 mmol/L储存液,置-20℃保存,使用前采用DMSO稀释至1 μmol/L。将100 mg苦参碱粉末溶于1 ml DMSO配置成100 g/L苦参碱液,-4℃保存。
二、细胞培养
HH、Hut78细胞在含10%胎牛血清和1%青链霉素的RPMI 1640培养基,37℃、5%CO2孵育箱中培养传代,取对数生长期HH、Hut78细胞进行后续实验。
三、MTS法检测西达本胺及苦参碱对HH、Hut78细胞增殖的影响
取对数生长期HH、Hut78细胞,计数后以2×104/ml接种于6孔板,每孔2 ml。实验药物浓度的选择参考本课题组前期研究[4-5]和预实验结果。2种细胞分别分为4组:西达本胺组(加入西达本胺使其终浓度为0.4 μmol/L)、苦参碱组(加入苦参碱使其终浓度为0.6 g/L)、联合组(加入终浓度为0.4 μmol/L西达本胺溶液后立即加入0.6 g/L苦参碱溶液)、对照组(仅加入DMSO),分别培养24、48、72 h。每个时间点混匀细胞,取100 μl细胞悬液至96孔板中,每组做3个复孔,每孔加入20 μl预先配置的MTS溶液,37℃孵箱中培养2 h,酶标仪测490 nm处吸光度(A值),重复测定3次。细胞增殖率 =[(A处理组-A培养基对照)/(A对照组-A培养基对照)]×100%。
四、流式细胞仪检测西达本胺及苦参碱对HH、Hut78细胞凋亡率的影响
取对数生长期HH、Hut78细胞,以2×104/ml接种至6孔板中。按上述分4组,处理HH、Hut78细胞48 h。每组计数5×105细胞,冷磷酸盐缓冲液清洗细胞2次,1×106/ml细胞重悬于结合缓冲液中。取100 μl细胞悬液至5 ml培养管中,每管加入人FITC偶联的AnnexinⅤ5 μl以及碘化丙锭5 μl。混匀,避光孵育15 min。每管加入400 μl结合缓冲液,1 h内用流式细胞仪检测。以上实验重复3次。细胞凋亡率=早期凋亡率+晚期凋亡率。
五、Western印迹法检测西达本胺及苦参碱对HH、Hut78细胞凋亡相关蛋白表达的影响
HH、Hut78细胞按上述分组处理48 h后,取106个细胞,离心后弃上清液,磷酸盐缓冲液洗涤细胞2次,加入蛋白裂解液并置于冰上,混匀。4℃震荡孵育1 h,4℃18 000×g离心15 min。收集上清液,用二喹啉甲酸(BCA)法蛋白定量试剂盒进行蛋白定量。总蛋白溶液中加入蛋白电泳上样缓冲液,充分混匀,水浴锅中100℃煮沸变性5 min。十二烷基硫酸钠-聚丙烯酰胺凝胶每孔分别加入30 μg总蛋白或2 μl预染色蛋白质分子量标准标志(marker),90 V恒压40 min,蛋白进入分离胶后,130 V恒压电泳90 min。250 mA 90 min将电泳蛋白电转印至聚偏氟乙烯膜上,5%脱脂奶粉封闭1 h,分别加入目的蛋白一抗:兔抗人多克隆抗体caspase-3(1∶1 000)、兔抗人多克隆抗体NF-κB p65(1∶1 000)、兔抗人单克隆抗体p-Bad(1∶1 000),兔抗人单克隆抗体Bad(1∶1 000),兔抗人单克隆抗体E-cadherin(1∶10 000),兔抗人单克隆抗体Bcl-2(1∶1 000),摇床上4℃过夜。封闭洗涤缓冲液(TBST)洗涤3次,每次15 min,加入IRDye®800CW染料标记的山羊抗兔二抗或山羊抗鼠二抗,室温孵育1 h,TBST漂洗3次,每次15 min。双红外激光扫描成像系统进行荧光显色、分析。以GAPDH为内参,使用Image J软件定量分析各条带灰度值。
六、统计学分析
结 果
一、西达本胺和苦参碱对HH、Hut78细胞体外增殖的影响
与对照组相比,西达本胺组、苦参碱组和联合组HH、Hut78细胞增殖率均有不同程度降低,见图1。HH细胞系重复测量方差分析显示,各处理组细胞增殖率有随时间变化的趋势(F=137.41,P<0.001),且不同处理组间细胞增殖率差异有统计学意义(F=15.88,P<0.05)。各处理组间两两比较显示,24 h时,联合组细胞增殖率与苦参碱组和西达本胺组相比,差异无统计学意义(LSD-t=1.84、3.12,P=0.12、0.21);48、72 h时,联合组细胞增殖率显著低于苦参碱组(LSD-t=4.90、2.64,均P<0.05)和西达本胺组(LSD-t=4.89、6.32,均P <0.05)。
Hut78细胞系各处理组细胞增殖率有随时间变化的趋势(F=138.69,P <0.001),且不同处理组间细胞增殖率差异亦有统计学意义(F=558.26,P < 0.001)。各处理组间两两比较显示,24、48、72 h时,联合组细胞增殖率均显著低于苦参碱组(LSD-t=2.60、10.18、14.93,均P < 0.05)和西达本胺组(LSD-t=6.56、4.86、4.71,均P < 0.05)。见图1。
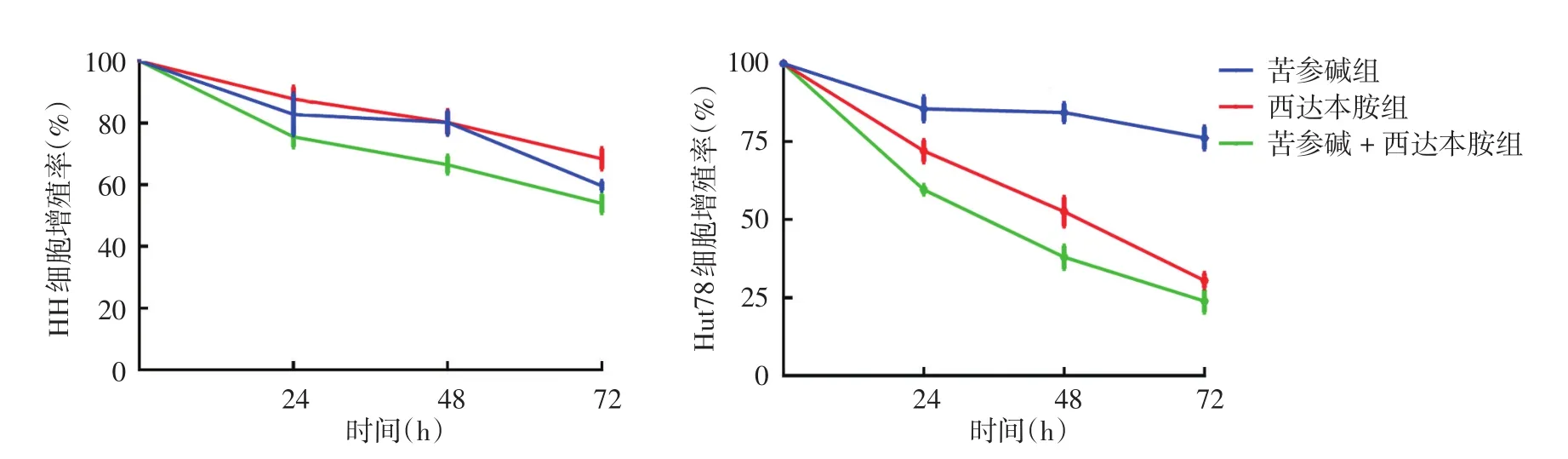
图1 西达本胺和苦参碱单药或联合处理对HH、Hut78细胞增殖活力的影响 西达本胺、苦参碱单药或联合处理均使HH、Hut78细胞增殖率有不同程度降低,且各处理组细胞增殖率有随时间延长逐渐降低的趋势。24 h时,各处理组间HH细胞增殖率无明显差异,但48、72 h时联合组低于苦参碱组和西达本胺组;24、48、72 h时,联合组Hut78细胞增殖率均低于苦参碱组和西达本胺组
二、西达本胺和苦参碱对HH、Hut78细胞凋亡的影响
48 h时,西达本胺组、苦参碱组、联合组和对照组HH细胞凋亡率差异有统计学意义(F=10.22,P<0.05)。两两多重比较显示,苦参碱组、西达本胺组与对照组相比差异无统计学意义(LSD-t=1.97、1.69,P=0.20、0.27),苦参碱组与西达本胺组相比差异亦无统计学意义(LSD-t=0.29,P=0.84),但联合组显著高于对照组、苦参碱组和西达本胺组,差异有统计学意义(LSD-t=7.37、5.40、5.69,均P < 0.05)。见图2、表1。
西达本胺组、苦参碱组、联合组和对照组Hut78细胞凋亡率差异有统计学意义(F=32.36,P<0.05)。两两比较显示,苦参碱组、西达本胺组和联合组均显著高于对照组(LSD-t=4.76、5.31、13.69,均P<0.05),且联合组仍显著高于苦参碱组和西达本胺组(LSD-t=8.93、8.37,均P < 0.01)。见图2、表1。
三、西达本胺和苦参碱对HH、Hut78细胞凋亡相关蛋白表达的影响

图2 流式细胞仪检测西达本胺、苦参碱单药或联合对HH、Hut78细胞凋亡的影响 48 h时,联合组HH细胞凋亡率高于对照组、苦参碱组和西达本胺组,而对照组、苦参碱组和西达本胺组间无明显差异;苦参碱组、西达本胺组和联合组Hut78细胞凋亡率均高于对照组,且联合组高于苦参碱组和西达本胺组
表1 西达本胺、苦参碱单药或联合对HH、Hut78细胞凋亡率及凋亡相关蛋白表达的影响(±s)

表1 西达本胺、苦参碱单药或联合对HH、Hut78细胞凋亡率及凋亡相关蛋白表达的影响(±s)
注:a与对照组相比,差异有统计学意义(P<0.05)。caspase-3:胱天蛋白酶3
组别 细胞凋亡率(%) 细胞凋亡相关蛋白表达E钙黏蛋白p65Bad p-Bad Bcl-2caspase-3剪切体HH细胞系对照组苦参碱组西达本胺组联合组F值P值Hut78细胞系对照组苦参碱组西达本胺组联合组F值P值11.44±1.43 13.98±3.86 13.61±1.62 20.94±0.64a 10.22<0.05 2.06±0.27 1.61±0.23 1.28±0.10a 0.76±0.12a 24.83<0.05 2.90±0.47 2.74±0.53 2.72±0.56 1.46±0.24a 6.196<0.05 2.89±0.86 2.96±0.72 2.64±0.60 2.76±0.70 0.11 0.95 1.50±0.11 1.27±0.09 1.16±0.19 0.83±0.06a 12.64<0.05 3.68±0.49 3.12±0.33 2.90±0.19 2.06±0.09a 13.71<0.05 0.77±0.14 0.79±0.16 0.90±0.04 1.27±0.17a 8.58<0.05 8.42±4.23 20.98±1.53a 22.44±7.74a 44.53±1.85a 32.36<0.05 3.91±0.23 3.11±0.49a 2.63±0.23a 1.78±0.43a 22.08<0.05 3.34±0.20 2.56±0.18a 2.53±0.36a 1.46±0.34a 22.15<0.05 2.72±0.39 2.44±0.32 2.15±0.22 2.10±0.09 2.78 0.11 1.97±0.18 1.23±0.35a 1.26±0.16a 0.49±0.28a 16.64<0.05 1.25±0.07 0.94±0.12a 0.79±0.17a 0.32±0.10a 30.67<0.05 1.02±0.15 1.37±0.05 1.48±0.14a 2.09±0.17a 32.63<0.05

图3 Western印迹法检测西达本胺、苦参碱单药或联合对HH、Hut78细胞凋亡相关蛋白表达的影响 苦参碱、西达本胺单药或联合处理48 h后,Hut78细胞caspase-3剪切体蛋白表达有不同程度升高,而E钙黏蛋白(cadherin)、p65、p-Bad、Bcl-2蛋白表达有不同程度降低,Bad蛋白表达基本无差异;HH细胞联合组caspase-3剪切体蛋白表达明显升高,而E-cadherin、p65、p-Bad、Bcl-2蛋白表达明显降低,4组间Bad蛋白表达无明显差异
如图3、表1所示,HH细胞中,联合组caspase-3剪切体蛋白表达显著高于对照组、苦参碱组和西达本胺组(LSD-t=6.37、5.98、4.67,均P < 0.05),而E-cadherin(LSD-t=11.82、7.80、4.78)、p65(LSD-t=5.36、4.76、4.12)、p-Bad(LSD-t=9.70、6.35、4.84)及Bcl-2蛋白(LSD-t=8.92、5.84、4.64)表达显著低于其他3组(均P>0.05)。4组间Bad蛋白表达差异无统计学意义(P>0.05)。与对照组相比,苦参碱组、西达本胺组caspase-3剪切体蛋白、p65、p-Bad和Bcl-2蛋白表达差异无统计学意义(均P>0.05),且苦参碱组E-cadherin蛋白表达差异亦无统计学意义(LSD-t=4.02,P=0.08),而西达本胺组E-cadherin蛋白表达显著低于对照组(LSD-t=7.036,P < 0.05)。
Hut78细胞中,苦参碱组、西达本胺组和联合组E-cadherin(LSD-t=4.57、6.97、11.75)、p65(LSD-t=4.74、4.94、11.46)、p-Bad(LSD-t=5.01、4.76、9.99)、Bcl-2蛋白(LSD-t=4.55、6.65、13.47)表达均显著低于对照组(均P<0.05)。苦参碱组caspase-3剪切体蛋白表达与对照组相比差异无统计学意义(LSD-t=4.50,P>0.05),而西达本胺组和联合组显著高于对照组(LSD-t=5.90、13.72,均P < 0.05),联合组显著高于苦参碱组和西达本胺组(LSD-t=9.22、7.82,均P < 0.05)。联合组E-cadherin、p65、p-Bad、Bcl-2蛋白表达显著低于苦参碱组(LSD-t=7.18、6.72、4.98、8.92,均 P < 0.05)和西达本胺组(LSD-t=4.78、6.52、5.19、6.82,均P < 0.05)。4组间Bad蛋白表达差异无统计学意义(P>0.05)。
讨 论
CTCL是一组表现多样的结外霍奇金淋巴瘤,虽然其治疗方法多样,但并无完全治愈的方法,因此探索具有更好疗效的药物至关重要[6]。组蛋白去乙酰化酶(HDAC)与许多肿瘤发生有强相关性,目前已成为肿瘤研究的热点方向。其抑制剂HDACi可通过抑制细胞周期和DNA修复、诱导细胞凋亡等方式抑制多种肿瘤细胞增殖,在肿瘤治疗方面显示出极大的潜力[7]。西达本胺是我国自主研发合成的选择性HDACi,能选择性抑制HDAC-1、2、3、10,毒性低,并被证实对多种肿瘤均有良好的治疗效果[2]。一项西达本胺治疗79例难治性、复发性皮肤外周T细胞淋巴瘤患者的Ⅱ期临床试验显示,治疗后患者中位生存时间提高,可达21.4个月[8]。西达本胺对CTCL也有明显抗肿瘤疗效,一项西达本胺治疗难治性CTCL患者的Ⅱ期临床试验显示,连续给药组总缓解率可达36%,且不良反应少[9]。本课题组前期研究[4]显示,西达本胺作用于CTCL细胞系可明显抑制细胞增殖并诱导细胞凋亡。苦参碱是一种豆科类植物苦参的提取物,具有良好的药理学活性。既往研究表明[3,10],苦参碱在多种肿瘤的治疗上都有着良好的疗效,并显示出巨大的潜力。我们前期研究[5]显示,苦参碱能有效抑制CTCL细胞系HH增殖并诱导其凋亡。
我们采用西达本胺、苦参碱单药或二者联合体外干预人CTCL细胞系HH和Hut78,研究西达本胺和苦参碱对肿瘤细胞增殖与凋亡的影响。结果显示,西达本胺与苦参碱二者联合能显著抑制HH和Hut78细胞增殖并促进其凋亡。Western印迹结果显示,经西达本胺、苦参碱单药或联合处理HH和Hut78两个细胞系后,E-cadherin蛋白表达明显下调,而caspase 3剪切体的表达上调。E-cadherin是相对分子量为120 000的糖蛋白,大多分布于上皮细胞表面,目前有研究[11]发现,E-cadherin也可高表达于一些非霍奇金淋巴瘤的肿瘤细胞上。在多种肿瘤中,E-cadherin不仅对细胞间粘附发挥作用,也对凋亡的发生起关键作用。Galaz等[12]研究认为,E-cadherin的表达减少是诱导凋亡的一个重要触发点。E-cadherin表达下调能直接激活caspase-3,caspase-3激活后产生caspase-3剪切体从而执行细胞凋亡[13]。在尤因肉瘤、肝癌等多种肿瘤[14-16]中,E-cadherin表达下调可促进肿瘤细胞凋亡。结合既往文献报道,本研究结果提示,西达本胺联合苦参碱可能也通过抑制E-cadherin,激活caspase-3,产生caspase-3剪切体,从而诱导Hut-78、HH细胞凋亡。
Bad属于Bcl-2家族一员,是一种仅含BH3区域蛋白的促凋亡分子,Bad促凋亡作用由其丝氨酸磷酸化调控。细胞质中,磷酸化Bad与一种支架蛋白14-3-3结合,而无法与抗凋亡蛋白Bcl-2形成二聚体,进而无法发挥促凋亡作用;一旦细胞受到刺激,Bad立即去磷酸化,迁移至线粒体中与抗凋亡分子Bcl-2相结合形成复合体,从而抑制Bcl-2抗凋亡作用而诱导凋亡[17-18]。NF-κB是一种极为重要的介导细胞内信号转导的核转录因子,其与细胞凋亡发生也有密切关联。既往研究[19]显示,CTCL中NF-κB的激活与肿瘤细胞存活有明显正相关性。多种肿瘤研究[20-22]表明,抑制NF-κB的表达能下调Bcl-2蛋白的表达水平,通过激活下游caspase-3等分子而引发凋亡级联反应,从而起到抑制肿瘤生长的作用。Bcl-2与Bad一样,同属于Bcl-2蛋白家族,在细胞凋亡过程中发挥不容忽视的作用。目前最主流的Bcl-2调节凋亡模型认为,Bcl-2能与Bcl-2家族中其他促凋亡蛋白紧密结合,从而抑制细胞色素c的释放而使后续的凋亡级联反应无法进行[23-24]。本研究显示,西达本胺、苦参碱单药或联合处理HH、Hut78细胞后均可抑制p-Bad、p65、Bcl-2的表达。结合上述文献我们认为,西达本胺和苦参碱可能通过抑制p-Bad与NF-κB的表达,进一步干扰Bcl-2的表达,促进凋亡发生。
西达本胺或苦参碱单药对多种肿瘤作用机制的研究[25-28]显示,两药皆可通过下调Bcl-2、p65蛋白表达水平,进一步激活下游的caspase-3蛋白,从而抑制多种肿瘤生长。本研究结果显示,与单药组相比,西达本胺联合苦参碱对HH、Hut78细胞的增殖抑制和凋亡诱导作用更明显,对凋亡相关蛋白caspase-3剪切体表达的升高及E-cadherin、p65、p-Bad、Bcl-2表达的降低作用均明显强于单药组,显示西达本胺联合苦参碱能协同抑制HH、Hut78细胞的生长。可能西达本胺与苦参碱在诱导CTCL细胞系凋亡的作用机制上有所重叠,联合用药比单药处理效果更加显著。与Hut78细胞上有白细胞介素(IL)-2受体全链相比,HH细胞仅有IL-2受体β + γ链[29-30],对IL-2的亲和力要低于Hut78细胞。IL-2可通过激活JAK1和JAK3激酶参与CTCL的发生,而抑制IL-2能抑制信号传导及转录激活蛋白5(STAT5),从而抑制抗凋亡蛋白的产生,进而诱导细胞凋亡[31]。苦参碱和HDACi均能抑制IL-2的产生[32-33]。因此,我们推测苦参碱和西达本胺诱导HH细胞凋亡的作用不如Hut78细胞。
西达本胺联合苦参碱处理CTCL细胞系,可能通过抑制E-cadherin蛋白表达而激活caspase-3、产生caspase-3剪切体,从而促进凋亡,或通过抑制p65、p-Bad蛋白表达而干扰Bcl-2蛋白的表达,进而激活caspase-3,产生caspase-3剪切体,从而促进凋亡。本研究中我们仅对HH、Hut78两个细胞系进行了初步研究,后续将探索更多细胞系或进行动物实验,深入研究西达本胺与苦参碱联合作用于CTCL的机制。
利益冲突所有作者均声明不存在利益冲突
