熔融沉积技术增量制造不同孔隙率聚醚醚酮材料的骨相容性实验研究
2020-04-03黄嘉蕊钟业宏俞哲元韦敏
黄嘉蕊 钟业宏 俞哲元 韦敏
聚醚醚酮(Polyetheretherketone,PEEK)是一种半结晶化合物,通过双酚类化合物的逐步二烷基化反应生成。PEEK是一种高耐热的热塑性材料,其抗拉强度及弹性模量几乎接近人类骨骼,是优良的骨植入物[1]。
颅面骨组织缺损的修补与形态重建,是颅颌面外科极具挑战的难题。目前,临床常使用钛网对颅面骨缺损进行修补,但长期随访发现,存在钛板外露、不明原因癫痫发生等并发症;此外,钛网与组织间产生较高的剪切力,以及影像学下产生金属伪影等问题,均限制了钛金属移植物的应用[2-3]。部分工程聚合物材料已被证明能够很好地匹配人体骨骼的机械性能,具有降低应力屏蔽和骨丢失的潜力,有助于改善患者预后。PEEK材料是目前较常使用的工程聚合物材料,与钛合金相比,具有过敏性低、无离子泄露、可影像学透视、可行三维定制打印等优点。虽然该材料的脆性较低,但因颅面部移植物对材料脆性要求不高,故PEEK材料仍有望成为颅面硬组织的替代物。
PEEK植入物的惰性疏水表面会导致纤维包裹并阻碍骨附着,导致在体内的骨整合性能及骨诱导能力方面存在重大缺陷。为提高PEEK的组织相容性,可通过表面涂层、化学物质混合、经化学处理等方式丰富PEEK表微结构。经处理的PEEK虽然提高了组织相容性[4-6],但往往会出现其他的潜在问题,如经过磺化处理的PEEK留有腐蚀性、表面孔径大小不一,HA-PEEK放置体内一段时间后涂层剥落等[7-8]。
熔融沉积技术(FDM)是将加工成丝状的热熔性材料(PEEK、PLA、蜡等)经过送丝结构送进热熔喷嘴,在喷嘴内丝状材料被加热熔融,同时喷头沿零件层片轮廓和填充轨迹运动,并将熔融的材料挤出,使其沉积在指定的位置后凝固成型,经层层堆积后形成产品模型的打印技术。本研究不采用化学处理方法,仅用FDM技术3D打印,直接对材料表面进行微孔化处理,避免了化学处理导致的不良效果,并检测3D打印不同孔隙率PEEK材料对成骨细胞成骨活性的影响,从而为PEEK材料3D打印增材制造方法在临床上的进一步应用提供基础依据[9]。
1 材料与方法
1.1 主要材料与仪器
PEEK颗粒(Victrex,英国),α-MEM培养基(Biological industries,以色列),胎牛血清、胰蛋白酶、三抗(Gibco,美国),AKP碱性磷酸酶定量检测(Beyotime,中国),0.2%茜素红染色液(Solarbio,中国),4%多聚甲醛(赛戈,中国),10%氯化十六烷基吡啶(Sigma,美国),10%磷酸缓冲液(HyClone,美国),成骨诱导培养液(Cyagen,美国),Triton-X100(Sigma-Aldrich,美国)。
FDM打印机(牛魔王3,三的部落科技股份有限公司,中国),场发射扫描电子显微镜(Philips,荷兰);高温消毒柜(ldzm-40kcs,上海茸研仪器有限公司);倒置显微镜(Nikon,日本)。
1.2 多孔隙材料的制备
以三维CAD模型数据为基础,通过FDM技术以35 mm/s的速度、420 ℃、直径0.4 mm喷头,以逐层叠加的方式打印出直径13 mm、高度3 mm的圆柱形PEEK材料,孔隙率分别为40%、50%、60%,以实心PEEK材料为对照组(图1)。

从左往右:40%、50%、60%孔隙率PEEK及实心PEEKFrom left to right: 40%, 50%, 60% porosity PEEK and solid PEEK
1.3 SEM电镜检测
以场发射扫描电子显微镜对所获取的样品进行扫描,获取样品表面微观形貌,观察样品表面的多孔结构。
1.4 PEEK材料表面多孔化处理对细胞成骨活性的影响
1.4.1PEEK材料预处理
将4组不同孔隙率(40%、50%、60%及实心)的PEEK材料放置于高温消毒柜里消毒风干,取出后置培养皿中,用10%PBS冲洗湿润2~3遍。
1.4.2细胞的接种和生长
各组PEEK材料分别置于24孔板中,将培养于混有1%三抗、16.7%胎牛血清的α-MEM培养液里的MC3T3-E1细胞,调整细胞密度为4×105cells/cm2,取1 mL接种于材料孔中及无材料的空白孔中,无材料空白孔为空白对照组。接种24 h后首次换液,37 ℃、5% CO2保温箱内培养3 d,第4天更换为成骨诱导培养液。
1.4.3细胞黏附和增殖情况
成骨诱导期间,倒置相差显微镜连续观察细胞黏附生长情况,观察细胞在不同时间段的形态学变化。
1.4.4MC3T3-E1细胞的骨向诱导
成骨诱导培养液每3天全量换液。分别在第7、14天进行碱性磷酸酶(AKP)活性检测;第14、28天进行茜素红定量检测。
1.4.4.1AKP活性检测
成骨诱导第7、14天抽弃培养液,用10% PBS清洗2遍,每孔加入500 μL裂解液(含0.05% Triton-X100的PBS),置于37 ℃摇床30 min。按照AKP活性检测盒说明书检测裂解液中的AKP活性,波长405 nm下测定吸光度值。
1.4.4.2骨钙素定量检测
成骨诱导第14、28天时,各组样本甲醛固定20 min,10% PBS溶液清洗2遍,茜素红染色15 min, 10% PBS清洗2遍,各孔中加入10%氯化十六烷基吡啶(Cetylpyridinium chloride,Cpc)500 μL溶解钙结节,置于37 ℃、5% CO2保温箱15 min,所得溶液在波长570 nm下测定吸光度值。
1.4.5SEM电镜检测
成骨诱导第7、14、28天行SEM电镜观察,记录细胞的黏附生长情况。
1.5 统计学方法
2 结果
2.1 细胞黏附增殖情况
PEEK材料与MC3T3-E1细胞共培养24 h后,大部分细胞贴于PEEK材料上生长,亦有少量细胞零星散落于材料孔隙中。成骨诱导第7天,细胞体积开始增大,细胞生长情况良好,在材料孔隙中呈梭形或多角形;成骨诱导第14天,可见孔隙间成骨细胞更大程度地汇合,有的成簇生长,中心密集,外层逐渐稀疏,有的在孔隙间形成漩涡状;成骨诱导第28天,可见细胞数量明显增加,汇合堆叠成团,有的长满材料孔隙。成骨细胞在不同孔隙率材料上没有特定的生长形态(图2)。
2.2 SEM电镜检测
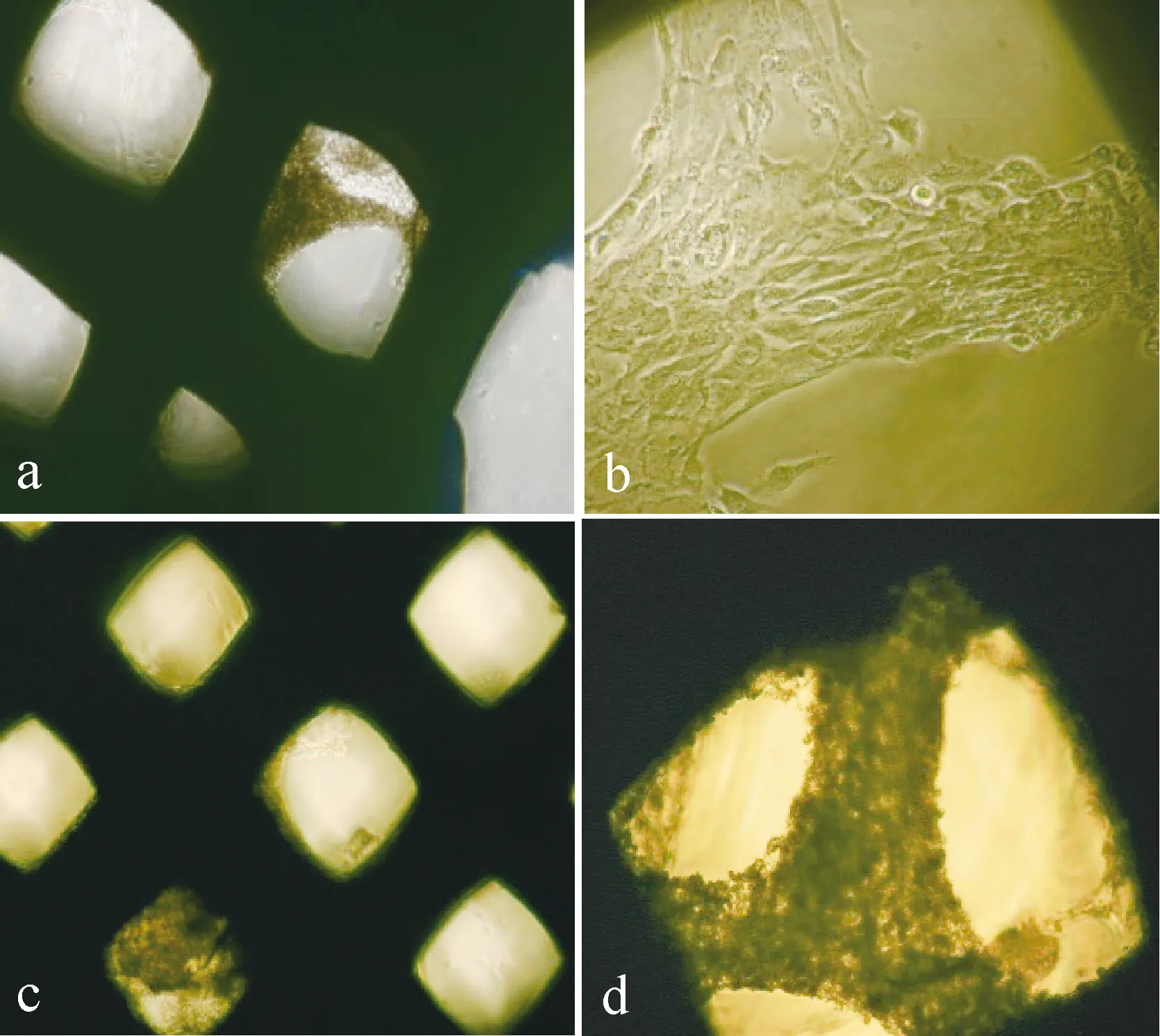
a: 60%孔隙率PEEK/MC3T3-E1成骨诱导第7天(4×);b:40%孔隙率PEEK/MC3T3-E1成骨诱导第10天(20×);c:40%孔隙率PEEK/MC3T3-E1成骨诱导第14天(4×);d:60%孔隙率PEEK/MC3T3-E1成骨诱导第28天(10×)a: 60% porosity PEEK/MC3T3-E1 on the 7th day of osteogenesis (4×); b: 40% porosity PEEK/MC3T3-E1 on the 10th day of osteogenesis (20×);c: 40% porosity PEEK/MC3T3-E1 on the 14th day of osteogenesis (4×);d: 60% porosity PEEK/MC3T3-E1 on the 28th day of osteogenesis (10×)
SEM电镜检测可见PEEK材料上喷头(直径400 μm)挤压堆叠出的条索纹路,PEEK材料基本光滑,偶见多余拉丝结构、孔径堵塞现象,应为生产工艺不稳定所致。尽管使用同一个喷头打印材料,但由于打印过程中浆料黏度、供料压力及出丝速度等工艺参数的综合影响,使不同孔隙率的整体多孔材料横梁宽度会有误差。SEM电镜下测量40%、50%、60%孔隙率及实心PEEK材料的横梁宽度分别为:(397±33)μm、(370±16)μm、(330±0)μm和(347±5)μm;孔隙宽度分别为:(273±40)μm、(357±21)μm、(573±21)μm。40%孔隙率PEEK材料最容易出现孔径堵塞现象;50%孔隙率PEEK材料的孔隙宽度与实验理想值(350 μm)最接近;60%孔隙率PEEK材料的横梁宽度及孔隙宽度相对比较稳定,有较清晰的微孔结构(图3)。

a:40%孔隙率;b:50%孔隙率;c:60%孔隙率;d:实心材料a: 40% porosity; b: 50% porosity; c: 60% porosity; d: solid PEEK
2.3 AKP活性检测
分别于成骨诱导第7天、14天,对在不同孔隙率PEEK材料上培养的MC3T3细胞的AKP活性进行检测,结果显示:①成骨诱导第7天,4种不同孔隙率的PEEK材料对MC3T3细胞成骨活性有影响(P<0.05),其中在40%、50%、60%孔隙率PEEK材料上培养的MC3T3-E1细胞的成骨活性相比空白对照组均明显升高(P<0.05),其中40%孔隙率PEEK材料上的成骨活性最高(P<0.05)。②成骨诱导第14天,4种不同孔隙率PEEK材料对MC3T3细胞成骨活性有影响(P<0.05),在4种不同孔隙率PEEK材料上培养的MC3T3-E1细胞的成骨活性均明显高于空白对照组(P<0.05),其中60%孔隙率PEEK材料上的成骨活性最高(P<0.05)。③在4种不同孔隙率PEEK材料上培养的MC3T3细胞的成骨活性均随培养时间延长而升高(P<0.05)(图4)。
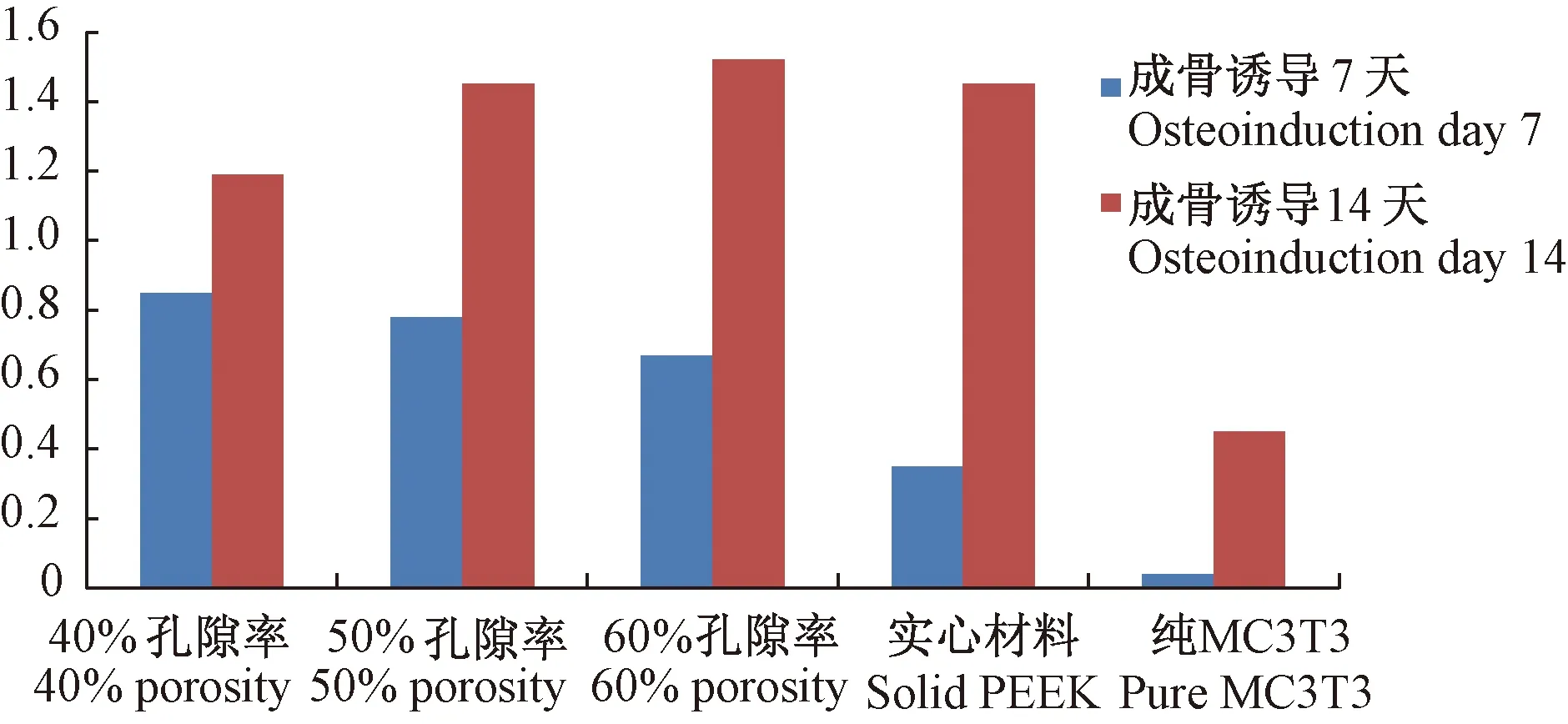
图4 AKP活性检测。
2.4 骨钙素定量检测
分别于成骨诱导第14、28天对在不同孔隙率PEEK材料上培养的MC3T3细胞的骨钙素定量检测,结果显示:①成骨诱导第14天,在4种不同孔隙率的PEEK材料上培养的MC3T3-E1细胞的骨钙素含量不同(P<0.05),其中在实心PEEK材料上培养的MC3T3-E1细胞的骨钙素含量最高(P<0.05)。②成骨诱导第28天时,在40%孔隙率PEEK材料上培养的MC3T3-E1细胞的骨钙素含量最高(P<0.05)。③在40%、50%、60%孔隙率PEEK材料上培养的MC3T3细胞的骨含量均随培养时间延长而升高(P<0.05)(图5)。
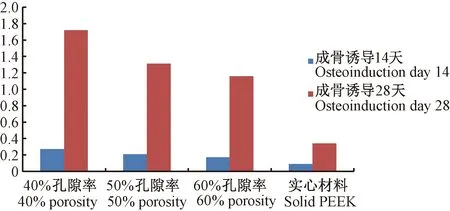
图5 骨钙素定量检测
3 讨论
理想状态下,植入物的设计是为了更好地模拟其替换的生物组织,以提供结构稳定性并支持骨生长。PEEK材料具有耐高温性、耐腐蚀性、机械特性、耐水解性等,但其生物惰性和疏水性严重,在人体内会被周围的纤维组织包裹,形成纤维包囊,从而延缓、抑制植入材料与周围骨组织的融合[10-11]。通过不同方法可丰富PEEK材料的表面微结构,能够有效地增加材料与周围骨组织间的融合,但仍存在缺陷和不足[12]。随着制造工艺的进步,目前已突破了处理材料移植物的限制,提供了更大的选择范围。
目前,临床使用的PEEK植入物都是通过注塑成型(减材)制造的方式,通过将粉末状PEEK聚合物填入注塑机内,加热使之变成黏流态,在一定压力和速度下使熔体注入模型后冷却而成。这种方法制造出来的PEEK材料,其表面光滑,具有足够的强度、刚度,但无益于PEEK与骨组织的结合。本实验通过熔融沉积(FDM)3D打印技术直接在制造材料的过程中进行微孔结构的处理(包括控制孔隙率、孔径大小等),既节约了制造成本且不改变材料的化学生物特性,同时又提高了PEEK材料与骨的整合。
骨生成在不同阶段有不同活跃的代谢指标,透过检测不同时期的骨生成指标可以检测成骨细胞在该时期的成骨活性。骨性碱性磷酸酶(Alkaline Phosphatase,ALP)由成骨细胞分泌,在成骨过程中水解成磷酸酯和焦磷酸盐,有利于成骨过程,因其具有高特异性和灵敏性,在体外实验中常作为成骨早期的指标;骨钙素(Osteocalcin,OC)是由成熟成骨细胞、软骨细胞合成和分泌的,是成骨分化晚期成骨细胞成熟的标志物,OC对骨矿化过程起正向作用[13]。一般而言,ALP值的高峰在成骨细胞成骨第14天,而OC值随着成骨时间推移而增高,ALP及OC的表达可以反映骨形成的过程。本实验中,成骨细胞成骨早期(第7天)的ALP活性随着孔隙率的增高而下降,实心材料最低;但到成骨中期(第14天),AKP活性却随着孔隙率的增高而上升,其中40%孔隙率PEEK材料中细胞的AKP活性最低,其次是实心材料中细胞的AKP活性。另外,成骨早期、中期空白对照组(纯MC3T3-E1细胞)的AKP活性均为最低,虽然各孔中种植的细胞密度相同,但由于纯MC3T3-E1细胞中没有放置材料,导致可供细胞黏附的表面积减少,使得细胞数减少,最终导致AKP分泌量减少[14-15]。各组不同样本成骨第14天的AKP活性均比第7天高。在成骨中后期MC3T3-E1矿化过程中OC含量随着孔隙率的增高而下降,以实心材料中细胞的OC含量最低;而成骨诱导第28天各组样本的OC值均比第14天的高。4组样本(40%、50%、60%孔隙率PEEK和实心PEEK)间比较,材料孔隙率越低,MC3T3-E1细胞矿化时间越早,这可能是由于孔隙率越低所创造的缺氧条件诱导成骨细胞表达VEGF,加快成骨细胞分化过程所致[16-17],到成骨中后期仍然以40%孔隙率样本中细胞的OC含量最高,因此我们认为40%孔隙率PEEK材料的成骨细胞相容性最佳。随着培养时间延长,各组AKP活性及OC含量均有上升,说明改变PEEK材料表面结构对MC3T3-E1细胞没有明显的毒性反应。
本实验采用FDM增材制造(3D打印)PEEK材料表面的微孔结构,在不改变PEEK的化学结构及不添加化学物质的前提下进行表面微孔化处理,证实增加表面微孔的PEEK材料比实心PEEK材料有更好的生物相容性[18]。成骨细胞在4组不同样本的PEEK表面黏附、铺展,生长良好,表明微孔处理PEEK材料具有良好的体外成骨细胞相容性。
4 小结
本研究证实通过生产工艺改变PEEK微结构,包括孔隙率、孔隙直径等可达到提高生物相容性的效果。通过增加PEEK材料的表面微孔结构,可达到提高体内材料-骨整合能力,有利于增加植入物的弹性、稳定性及使用寿命,PEEK有望成为更理想、应用更广泛的新型骨替代材料。
