一种用于肌腱二级纤维束及周围腱内膜形态观察的扫描电镜制样方法研究
2020-04-03张忆苏波杨桢胡若楠宁良菊
张忆 苏波 杨桢 胡若楠 宁良菊
理想的脱细胞肌腱材料需尽可能地保留肌腱天然的超微结构与生化组分,以及近似完整肌腱的力学性能。脱细胞肌腱材料已被广泛用于动物跟腱、肩袖等组织缺损的修复与重建,并取得了较好的修复重建效果[1-7]。然而,由于肌腱组织过度致密,对完整肌腱直接进行脱细胞处理效果不佳,因此对肌腱进行冰冻切片处理已成为脱细胞肌腱支架材料常用的制备方法之一。肌腱结构中的腱内膜将胶原纤维束分为第一级(Primary fiber bundle)、第二级(Secondary fiber bundle)、第三级(Tertiary fiber bundle)3个不同等级的腱束。已有研究证实,切片厚度只要能保留完整的二级腱束结构就能维持肌腱切片材料的基本力学特性[8-10]。在前期研究中,我们已经摸索出一套染色方法来观察肌腱胶原纤维束及周围腱内膜的组分分布情况[11]。但此方法在光学显微镜下对于腱内膜较薄弱区域的二级纤维束仍难以辨别,所以我们设想通过扫描电镜观察来提高分辨率。然而,常规扫描电镜的制样方法往往会失去肌腱本身的结构细节,无法观察到二级纤维束及周围腱内膜分布情况[12-14]。结合前期制样经验,我们摸索出适用于肌腱二级纤维束及周围腱内膜形态观察的扫描电镜制样方法,具体报告如下。
1 材料与方法
1.1 实验材料及主要试剂、仪器
无水乙醇(成都科伦药业有限公司);Masson染色试剂盒(珠海贝索生物技术有限公司);OCT冰冻切片包埋剂(Tissue-Tek公司,美国);冰冻切片机(Leica公司,德国);双光子荧光显微镜(Nikon公司,日本);荧光显微镜(ZEISS公司,德国);体视显微镜(ZEISS公司,德国);扫描电子显微镜(ZEISS公司,德国)。
1.2 实验方法
1.2.1双光子荧光显微镜观察
由市售新鲜猪后蹄分离获取猪趾浅屈肌腱,以1 cm长度横切,将肌腱段横切面直接放置于双光子荧光显微镜下,用1 000 nm波长光源激发,二次谐波显微成像观察组织完整性。
1.2.2冰冻切片配合特殊Masson染色观察
肌腱段经OCT包埋,于-20 ℃下行6 μm厚冰冻切片,行特殊Masson染色。荧光显微镜下观察肌腱二级纤维束与周围腱内膜组分分布情况。
1.2.3扫描电镜制样分组及观察
根据制样方法不同,将固定后的肌腱段随机分为5组。A组,直接进行单纯梯度脱水;B组,行冰冻切片,再将肌腱切片梯度脱水;C组,梯度脱水至70%,行冰冻切片,再将肌腱切片继续梯度脱水;D组,梯度脱水至80%,行冰冻切片,再将肌腱切片继续梯度脱水;E组,梯度脱水至100%,行冰冻切片。各梯度脱水试剂为乙醇配制,梯度脱水终浓度为100%。冰冻切片厚度均为100 μm。经临界点干燥喷金后行体视显微镜观察肌腱切片大体结构,扫描电镜观察肌腱二级纤维束及周围腱内膜形态。
2 结果
2.1 双光子荧光显微镜观察
二次谐波显微成像观察示,肌腱段横切面连续完整,二级纤维束在FITC通道呈现阳性,周围腱内膜呈现阴性(图1)。
2.2 冰冻切片配合特殊Masson染色观察
荧光显微镜下观察示,切片连续均匀,二级纤维束呈红色,周围腱内膜呈蓝色,但在周围腱内膜较薄弱区域的二级纤维束边界难以区别(图1)。

a:肌腱横切;b:双光子荧光显微镜二次谐波显微成像观察(200×);c:Masson染色荧光显微镜观察(200×);d:肌腱切片喷金后体视显微镜观察(25×)a: Crosscutting of the tendon; b: Two-photon fluorescence and second harmonic imaging microscopic observation (200×); c: Fluorescence microscopic observation after Masson staining (200×); d: Stereo microscopic observation of tendon slices after gold sputter coating (25×)
2.3 经不同方法制样后体视显微镜与扫描电镜观察
体视显微镜观察示肌腱切片喷金后结构完整连续,三级纤维束的周围腱内膜清晰可见(图1)。扫描电镜观察显示:A组,整体过度收缩,呈致密板块状,无法观察到二级纤维束分布情况,高倍镜下无法辨认胶原纤维排列;B组,有较大冰晶空隙形成,二级纤维束结构难以辨认,高倍镜下胶原纤维排列清晰可见;C组,二级纤维束及其周围腱内膜、胶原纤维排列均清晰可见;D组,整体明显收缩,二级纤维束区别困难,高倍镜下胶原纤维排列清晰可见;E组,整体过度收缩,由于过于致密,冰冻切片时造成肌腱出现规律性断裂纹,无法观察到二级纤维束分布形态,高倍镜下也无法观察到胶原纤维排列及形态(图2、3)。
3 讨论
对完整肌腱进行冰冻切片处理在制备脱细胞肌腱支架材料时可有效促进脱细胞效果。其中,切片厚度可决定是否保留肌腱切片的生物力学特性,然而在表征测量与肌腱力学结构单元相关的二级纤维束形态数据时常采用常规的组织学制片方法配合光学显微镜采图[10,15]。传统表征方法由于对肌腱纤维束与周围腱内膜缺乏差异化的特异性染色,导致观察效果较差。在前期工作中,我们摸索出了针对肌腱胶原纤维束与周围腱内膜的差异化特殊染色方法。该方法能观察到大部分二级纤维束及周围腱内膜结构,但是周围腱内膜较薄弱区域在光学显微镜下还是难以区别,所以我们设想通过扫描电镜来提高表征的分辨精度。在利用扫描电镜观察肌腱组织时,大多数研究侧重于观察平行于胶原纤维束的纵切面,但是纵切面无法观察到完整的二级纤维束及周围腱内膜形态[16-19]。清晰地观察到肌腱横切面对于制备脱细胞肌腱切片材料的厚度选择至关重要。然而,目前仅有少数研究报道了肌腱横切面扫描电镜结果,而且所利用的扫描电镜制样方法对组织本身结构破坏严重并导致肌腱本身的细微结构消失[12]。
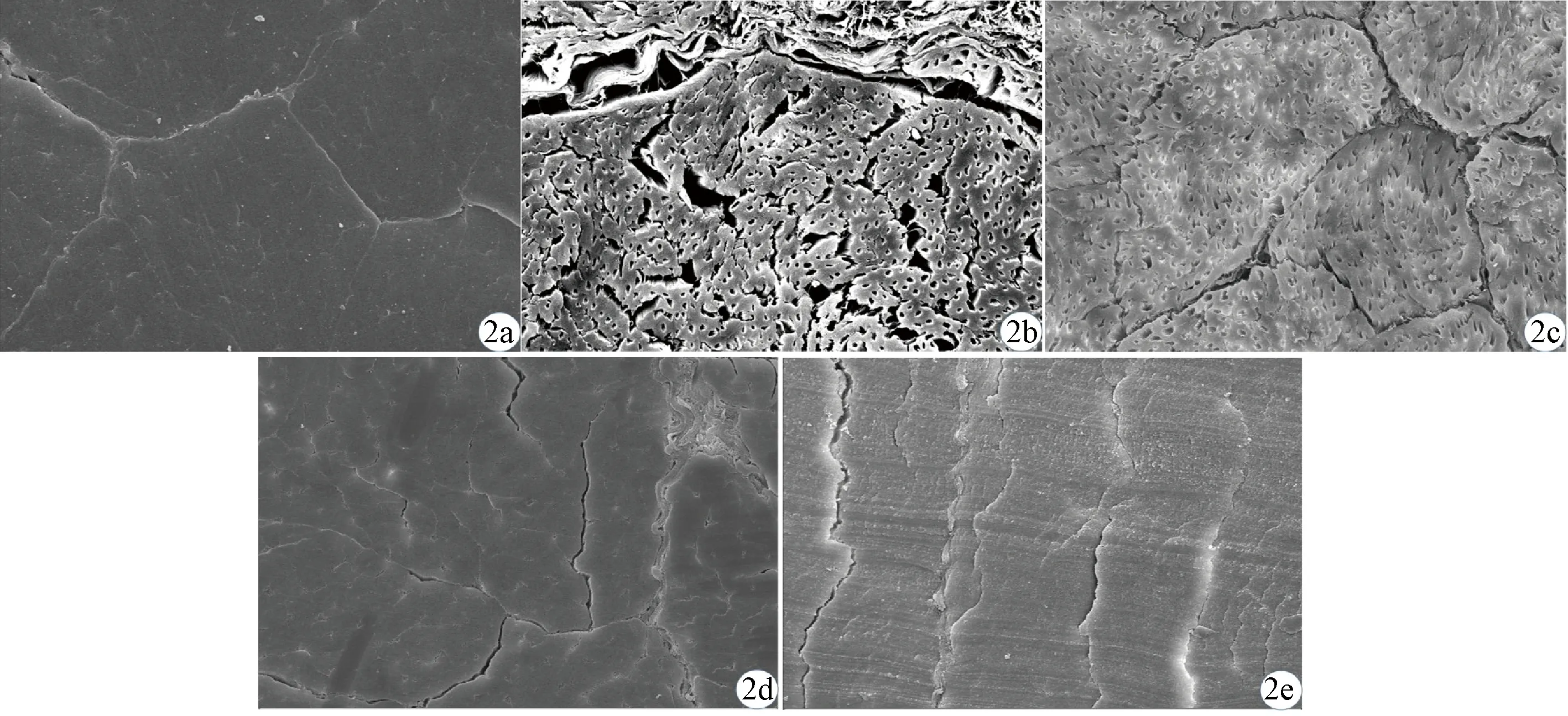
a:A组;b:B组;c:C组;d:D组;e:E组a: Group A; b: Group B; c: Group C; d: Group D; e: Group E
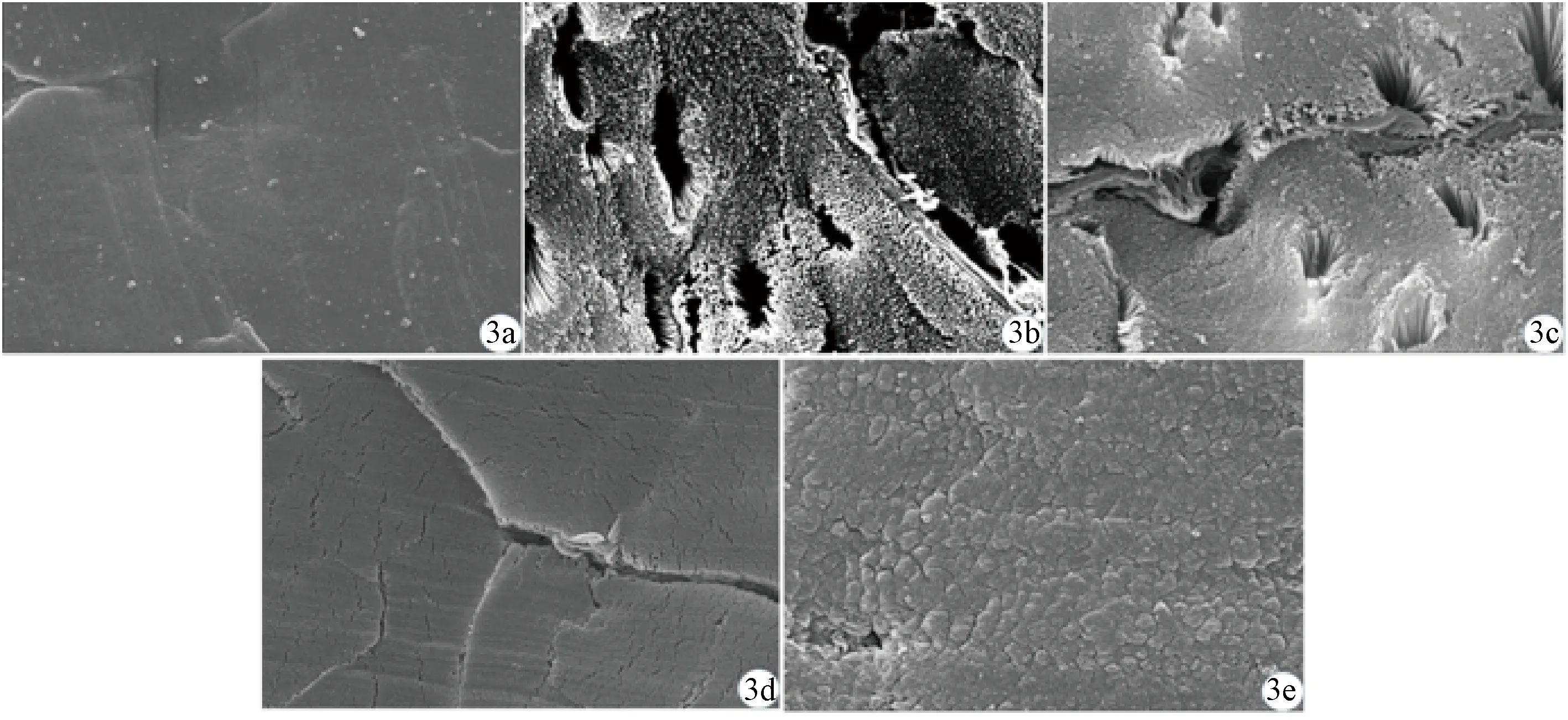
a:A组;b:B组;c:C组;d:D组;e:E组a: Group A; b: Group B; c: Group C; d: Group D; e: Group E
本研究的5组不同的扫描电镜制样方法中,A组是最常用的方法,但该方法会导致肌腱整体过度收缩,无法区分胶原纤维束及周围腱内膜。由于肌腱属于致密结缔组织,纤维束中的胶原纤维致密而有序地平行排列,腱外膜及腱内膜连续且有规律地包裹纤维束[8,20],因此我们推测当肌腱段作为一个整体进行梯度脱水至100%时,组织会呈现过度收缩。肌腱胶原纤维束与周围腱内膜均主要由Ⅰ型胶原构成,但胶原纤维束因为要提供抗拉功能,其绝大多数胶原纤维极其有序地紧密平行排列,而起支持和营养作用的周围腱内膜的纤维则呈现明显的疏松网状分布[21],我们猜测在整体过度收缩过程中疏松的周围腱内膜被二级纤维束挤压至无法观察。B组将固定后的肌腱段先冰冻切片再进行梯度脱水,由于肌腱切片样本失去了肌腱段作为整体的收缩能力,保留了二级纤维束及周围腱内膜的形态,且在高倍镜下观察也保留了胶原纤维排列形态。但由于肌腱组织含水量丰富,直接进行冰冻切片非常容易形成大量冰晶[22-23]。冰晶的形成会严重干扰对二级纤维束完整形态的判断。所以我们设置了不同梯度脱水时间节点,对肌腱段脱去不同程度的水分后再进行冰冻切片制备。D组与E组都由于脱水过度,肌腱二级纤维束与周围腱内膜形态消失,高倍镜下仅D组保留了胶原纤维的排列及形态,E组还由于过度脱水导致肌腱段硬度变高,在冰冻切片时极易发生脆裂。C组脱水程度适当,肌腱段失去70%水分后在冰冻切片环境下无明显冰晶形成,也未出现过度收缩情况,并且硬度适中,能轻松均匀连续地切出具有完整性的肌腱切片。
综上所述,本实验通过10%甲醛固定猪趾浅屈肌腱,乙醇梯度脱水至70%,行冰冻切片横切,厚100 μm,再将肌腱切片继续梯度脱水至100%,按照常规扫描电镜临界点干燥与喷金后,能清晰地观察到肌腱二级纤维束及周围腱内膜形态,同时能保留胶原纤维排列状态。在制备脱细胞肌腱切片支架材料时,此方法对指导材料生物力学性能的保护具有重要的组织形态学意义。
