离子色谱电导法检测白酒、红酒、啤酒和 多种黄酒中的6 种阳离子
2020-04-02茅嘉田周晚晴PavelNESTERENKO叶明立谢广发陈梅兰
茅嘉田,周晚晴,Pavel N. NESTERENKO,叶明立,谢广发,陈梅兰,
(1.浙江树人大学生物与环境工程学院,浙江 杭州 310028;2.莫斯科国立莱蒙诺索夫大学物理化学部化学系,俄罗斯 莫斯科 119991)
黄酒也称为米酒,属于酿造酒,在世界三大酿造酒中占有重要的一席,它有养胃健脾、和血行气、调经止痛等功效,适合冬天畏寒怕冷、四肢发凉者。黄酒中含有Li+、Na+、NH4+、K+、Mg2+、Ca2+等多种有益于人体健康的阳离子等,Na+和K+是保持人体电解质平衡的基础,适量的Li+能改善人体造血功能,提高免疫机能[1],Mg2+可增强人体代谢时酶的活力,Ca2+可促进糖化,提高酶活性[2-3],还能促进曲中酶的产生与溶出,使α-淀粉酶不易破坏[4],NH4+的毒性未写明,但是氨水具有中等毒性,半数致死量(大鼠,经口)为350 mg/kg,已公布的吸入人体最低中毒质量浓度为408 mg/L[5],超过一定量会对人体产生危害。
目前检测Li+、Na+、NH4+、K+、Mg2+、Ca2+的方法有原子吸收法[6-10]、电位滴定法[8]、分光光度法[9]、电感耦合等离子体质谱法[10-11]、毛细管区带电泳法[12-14]、离子色谱法[15-24]等。在这些方法中,离子色谱法可同时适用于白酒、啤酒、葡萄酒以及黄酒,分析速度快、灵敏度高、选择性好、能实现多组分同时分离定量等特点,简单、快速、准确,在应用中推广性强。
卢中明等[15]采用离子色谱法测定白酒中的Na+、K+、 Mg2+、Ca2+4 种阳离子含量,未检测Li+和NH4+。郭龑茹等[20]的实验测定啤酒样品中的8 种阴离子和5 种阳离子(Na+、NH4+、K+、Mg2+、Ca2+),但缺少Li+。马继平等[2]在20 min内完成啤酒中5 种阳离子的测定。 韩小江等[16]利用非抑制电导离子色谱法在25 min内分离出啤酒中的4 种阳离子和3 种胺类化合物,未检测其中的Li+。目前黄酒中主要研究对象为生物胺,而对黄酒中NH4+的研究鲜见报道。如张凤杰等[25]对黄酒酿造过程中生物胺的变化规律进行研究,以及在酿造的各个阶段探究生物胺的组成成分。
本实验建立离子色谱法同时测定酒中的金属阳离子Li+、Na+、NH4+、K+、Mg2+、Ca2+,并利用建立的方法检测市面上常见的18 种黄酒、3 种白酒、3 种啤酒和3 种葡萄酒的阳离子,对检测结果进行对比分析,对黄酒中较高含量NH4+的来源进行探讨,为黄酒的质量控制及酒类购买选择提供参考依据。
1 材料与方法
1.1 材料与试剂
黄酒、白酒、啤酒、葡萄酒 市购;焦糖色素由黄酒生产厂家提供。
实验用水为超纯水(电阻率为18.2 MΩ·cm) 美国 Millipore有限公司;氯化锂(分析纯) 上海阿拉丁生化科技股份有限公司;六水合氯化锶、硫酸钙、硫酸镁、氯化钠、硝酸钾、氯化铵(均为分析纯) 上海试四赫维化工有限公司。
1.2 仪器与设备
ICS-2100型离子色谱仪 美国Thermo Fisher公司; Ion Pac CS16阳离子分析柱(5 mm×250 mm)、Ion Pac CG16阳离子保护柱(5 mm×50 mm)、CERS-300(4 mm)阳离子抑制器、EGC III MSA淋洗液发生器和CR-CTC连续自动再生捕获柱、数据采集系统Chromeleon 6.8 美国Thermo Fisher公司。
1.3 方法
1.3.1 样品前处理
取市售瓶装黄酒1 mL稀释10 倍后过0.45 μm滤膜和RP(Onguard)小柱(预先经甲醇和水活化),弃去初滤液,续滤液收集后进样分析Na+、NH4+、K+、Mg2+、Ca2+等离子的含量。若酒样底部有沉淀物,先放入50 ℃的恒温箱加热3 min使底部沉淀物溶解。Li+在样品中含量较低,采取直接处理后进样分析。
啤酒样品经超声脱气10 min,稀释5 倍后进行上述处理后进样;白酒样品不稀释直接前处理后进样;葡萄酒稀释20 倍后前处理进样,其中测NH4+含量不稀释处理后直接进样,所有样品溶液制备均用电阻率为18.2 MΩ·cm超纯水;焦糖色素比较黏稠,稀释100 倍后前处理再进样分析。
1.3.2 标准溶液的配制
分别称取6 种阳离子,置于100 mL容量瓶中,用超纯水定容,配制质量浓度为1 000 mg/L的贮备液,于4 ℃冰箱备用。分别移取一定量的贮备液至10 mL的容量瓶中,用超纯水定容,绘制阳离子的回归方程(Li+:0.005~1 mg/L;Na+:0.5~10 mg/L;NH4+: 1~40 mg/L;K+:5~100 mg/L;Mg2+:1~30 mg/L;Ca2+:1~50 mg/L)。
(3)其他利用职务阻碍解救被拐卖、绑架的妇女、儿童应予追究刑事责任的情形。该情形属于兜底情形,是对上述不完全列举的一种补充。其他利用职务阻碍解救的行为,是指除上述利用职权和利用职务上的便利以外,与上述情形相类似的行为,既可能是利用职权的行为,也可能是利用职务上的便利的行为,还可能两者兼而有之。
1.3.3 色谱条件
Ion Pac CS16阳离子分析柱(5 mm×250 mm)和Ion Pac CG16阳离子保护柱(5 mm×50 mm);柱温42 ℃;检测器温度35 ℃;流动相:30 mmol/L甲基磺酸(淋洗液发生器自动生成);进样量25 μL,以峰面积定量;流速1.0 mL/min;抑制电流88 mA。标准样品溶液的色谱峰见图1。
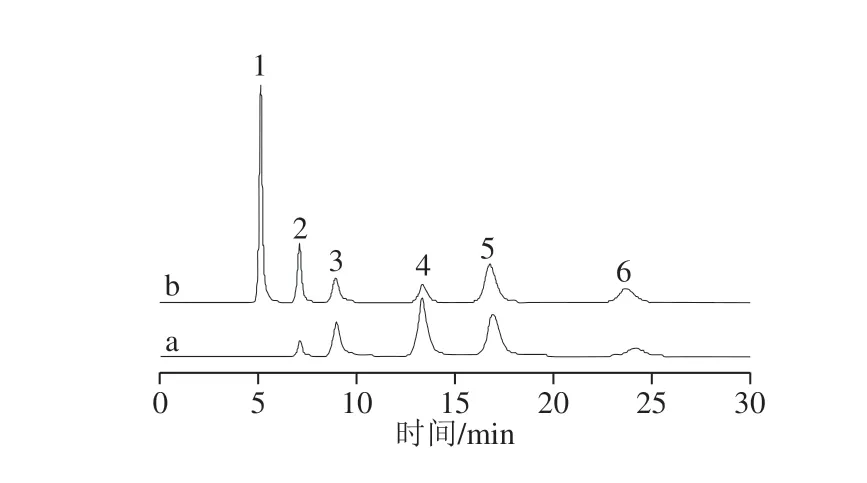
图 1 阳离子黄酒样品(a)与标准样品(b)(10 mg/L)对比图Fig. 1 Comparison of chromatograms of cations in yellow wine sample (a) and cation standards (b) (10 mg/L)
2 结果与分析
2.1 方法线性范围、重复性和检出限结果
用1 000 mg/L标准储备溶液配制6 种阳离子混合标准系列溶液,按1.3.3节色谱条件进样,以峰面积为纵坐标(Y),标准溶液质量浓度为横坐标(x)作标准曲线,并计算回归方程以及相关系数,结果表明6 种阳离子的相关系数R2均不小于0.999 0,可见方法具有良好的线性关系(表1)。
另取混合标准溶液(Li+:0.005 mg/L、Na+:0.5 mg/L、NH4+:5.0 mg/L、K+:10.0 mg/L、Mg2+:1.0 mg/L、Ca2+:1.0 mg/L)重复进样6 次,计算相对标准偏差(relative standard deviation,RSD),以3 倍信噪比计算得出各阳离子的检出限,结果见表1。
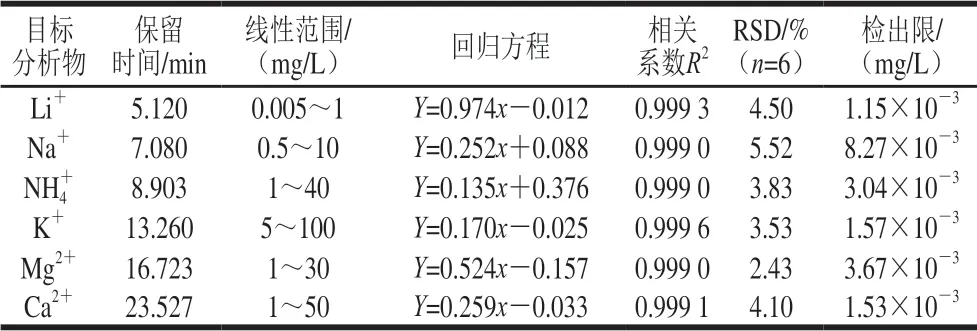
表 1 线性范围、重复性及检出限Table 1 Linear range, reproducibility and limits of detection for the developed method
2.2 方法的回收率结果
在待测黄酒样品5、18中加入3 种质量浓度水平的混合标准溶液,分别为样品质量浓度的120%、100%和80%左右。加标分2 次进行,Li+直接加标,含量较高的 Na+、NH4+、K+、Mg2+、Ca2+加标后稀释10 倍后再进行测定,结果见表2。
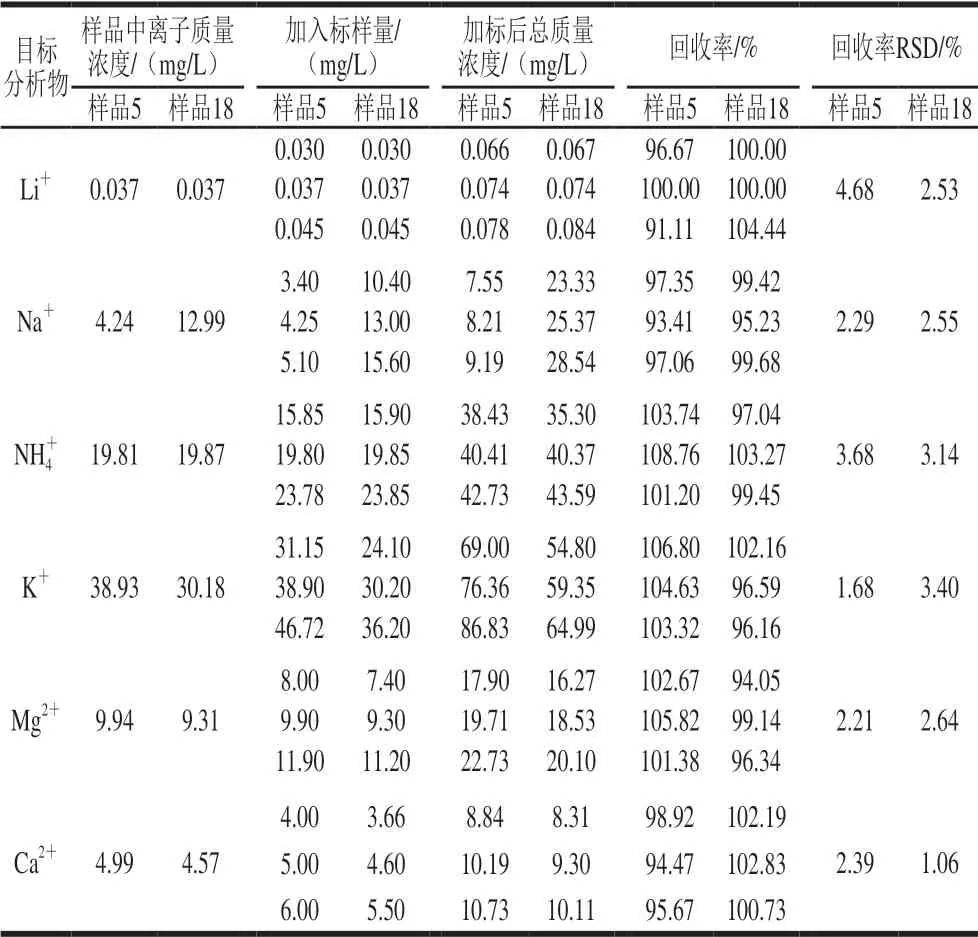
表 2 样品的加标回收率Table 2 Recoveries of spiked samples
2.3 黄酒样品测定结果
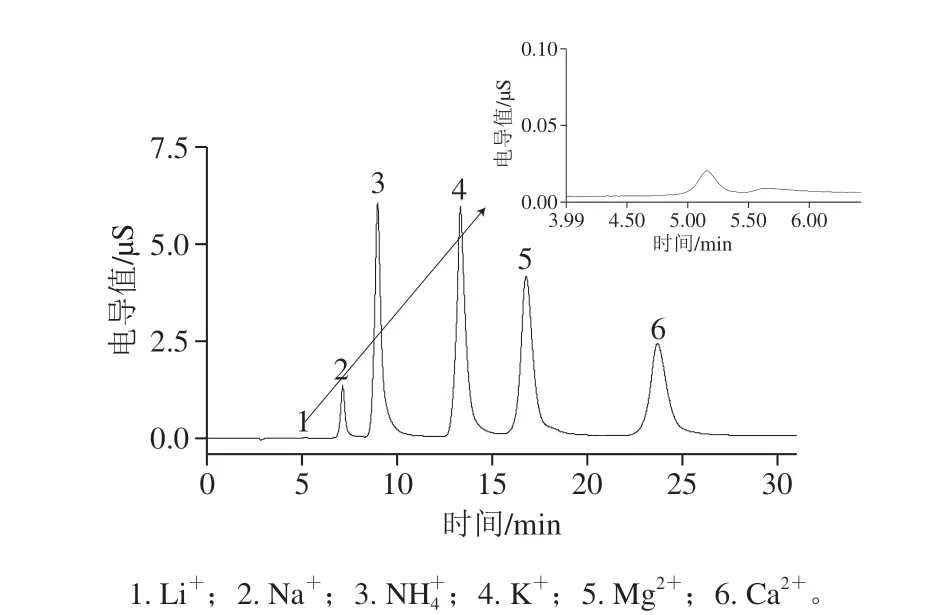
图 2 黄酒样品6的离子色谱图Fig. 2 Chromatograms of cations in yellow rice wine sample 6
考虑样品稀释10 倍过RP(Onguard)小柱后对样品可能吸附,因此实验对过RP(Onguard)小柱样品进行了加标回收实验,结果表明过RP(Onguard)小柱后的回收率在91.11%~108.76%之间,可见对待测阳离子并无吸附作用。样品经1.3.1节前处理后手动进样,外标法定量,测定的质量浓度结果见图2、表3。
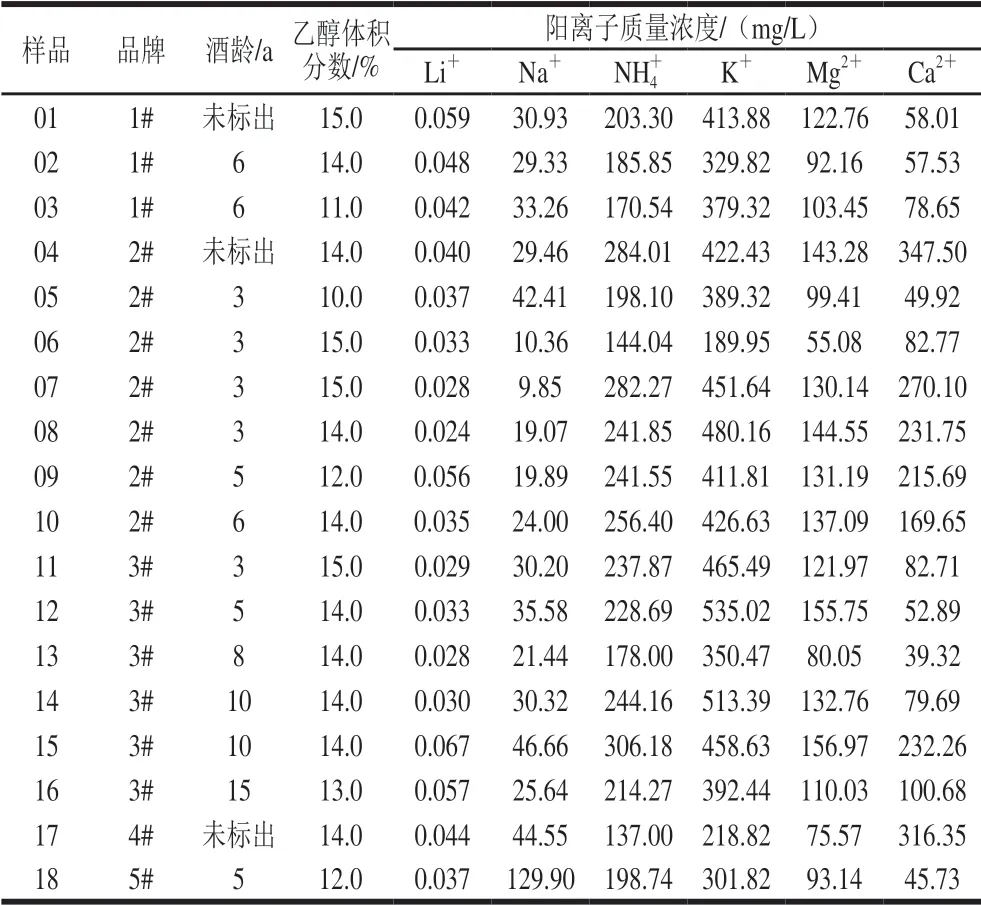
表 3 黄酒样品中各阳离子含量Table 3 Concentrations of cations in yellow rice wine samples
2.4 其他有机胺的影响
考虑到黄酒因有机物非常复杂,可能存在其他有机胺,因此在1.3.3节色谱条件下进样6 种阳离子与6 种有机胺(甲胺、乙胺、二甲胺、丙胺、三甲胺、丁胺各为1 mg/L),如图3所示,阳离子标准样品色谱图中NH4+的保留时间为8.51 min,K+的保留时间为12.03 min,而有机胺标准样品色谱图显示有机胺出峰的位置为4~6,保留时间为9.54~11.51 min,可见有机胺并不影响NH4+和K+的检测。
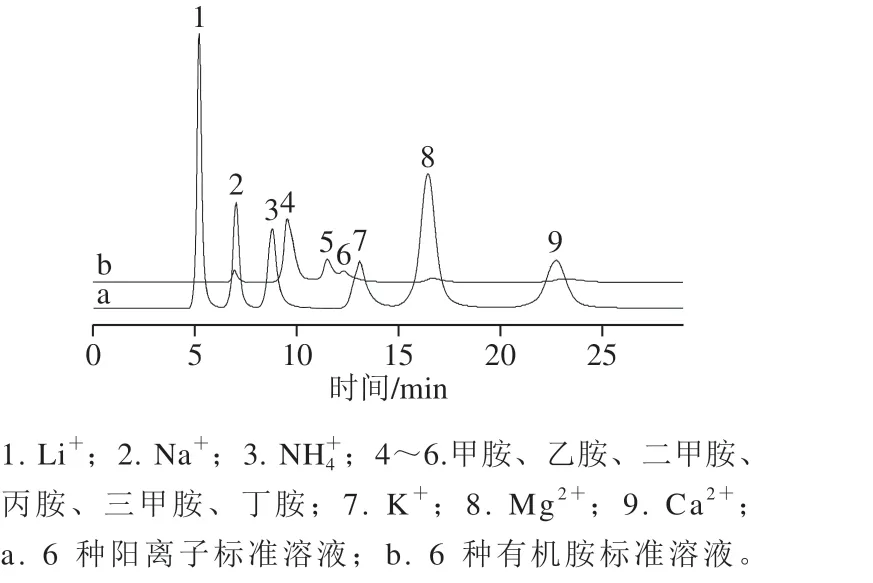
图 3 阳离子标准溶液与有机胺标准溶液对比图Fig. 3 Chromatograms of mixture standard solution of six cations and mixture standard solution of six organic amines
2.5 黄酒中NH4+的来源探讨
2.5.1 焦糖色素的影响
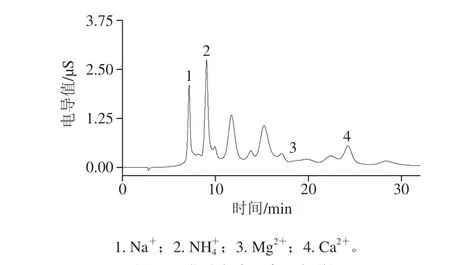
图 4 焦糖色素阳离子色谱图Fig. 4 Chromatogram of cations in caramel pigment
2.5.2 黄酒酿造原料的影响
考虑黄酒中NH4+可能来自于酿酒过程,是原料中氨基酸及含氮化合物通过发酵,在微生物的作用下形成 NH4+[21]。因此分别对白酒、啤酒及葡萄酒3 种不同原料酿制的酒进行检测,结果见表4。酒样19、22、25的色谱对比图见图5。
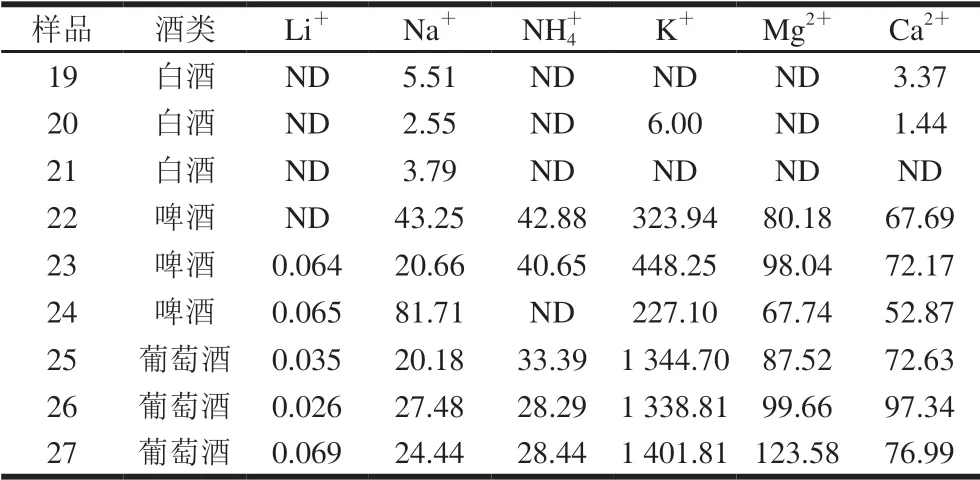
表 4 白酒、啤酒和葡萄酒样品阳离子含量Table 4 Concentrations of cations detected in Chinese liquor, beer and red wine samples mg/L
从表4可知,白酒样品中NH4+低于检出限,且其余阳离子的检出质量浓度偏低,可能是由于白酒的制备方式属于蒸馏酒,仅通过较短时间的发酵和多次蒸馏技术[26]啤酒中22号和23两种品牌检出质量浓度为30~45 mg/L的 NH4+,但质量浓度大大低于黄酒中的NH4+,是黄酒中NH4+的13.28%~31.30%。24号啤酒是纯生啤酒,NH4+未检出,相对于熟啤酒酿造过程,纯生啤酒在整个酿造、过滤、包装全过程对污染微生物严格控制,是酵母的纯种发酵,这可能是未生成NH4+的原因。而3 种葡萄酒(分别来自西班牙、意大利和中国)也全部检测出NH4+,但质量浓度也大大低于黄酒,甚至比啤酒低,这可能原因是葡萄中粗蛋白含量较低(约为0.5%)[27]。
啤酒麦芽汁质量分数在10%~12%之间,相当于1.0 kg麦芽可以制作9.0 kg左右的啤酒,而1.0 kg大米可以酿造2.0 kg左右的黄酒,可见,啤酒的产量约为黄酒产量的4.5 倍,而黄酒中的NH4+含量平均值约为啤酒中NH4+含量的4~5 倍,而大米中粗蛋白含量(8.8%)略低于大麦中粗蛋白含量(9%~12%),两者浓度之间的关系说明酿造酒中NH4+主要来源于原料中的粗蛋白,粗蛋白在微生物的作用下把原料中的含氮化物最终转变成NH4+。
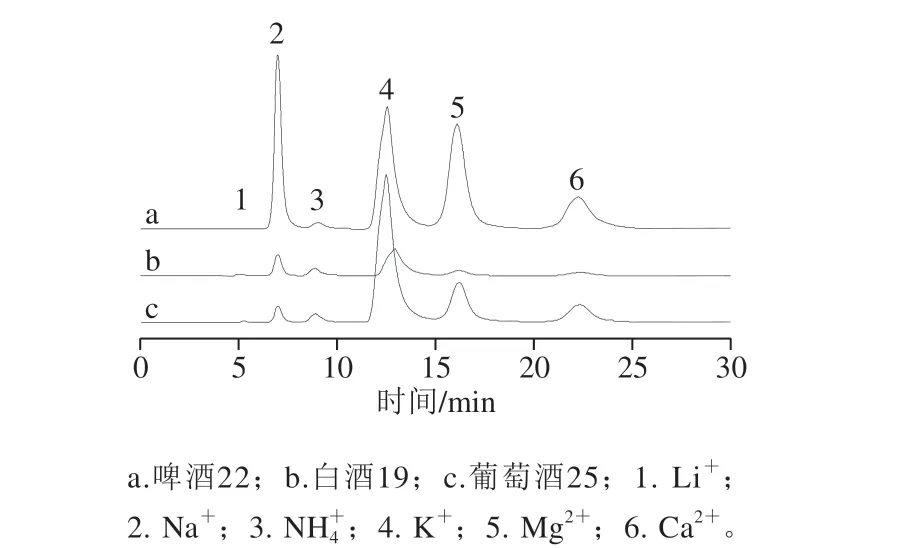
图 5 3 种类型酒样的离子色谱图Fig. 5 Chromatograms of cations in beer, Chinese liquor and wine
2.5.3 黄酒发酵程度(乙醇体积分数)对NH4+生成的影响

图 6 不同乙醇体积分数条件下NH+4质量浓度Fig. 6 Variation in ammonium ion concentration in wines with different alcohol contents
乙醇由酵母发酵转化而来,由相关文献[30-31]可知,氮素营养是酵母菌进行正常乙醇发酵所必需的重要营养元素之一。乙醇发酵启动后,酵母菌优先利用铵态氮形式的氮源。是因为在初级发酵过程中,氮元素作为酵母细胞生长和新陈代谢的重要组成部分,常以营养素形式补充氮的发酵,并且无机氮比有机氮更容易被酵母消耗,即使在初级发酵过程中乙醇体积分数较高,也很容易被酵母吸收。而且在蛋白质水解过程中,如果污染了腐败细菌,会使蛋白质过度(异常)发酵,此时,蛋白质水解生成的氨基酸继续降解,或失去CO2生成胺类,或同时进行脱氨基和脱羧基反应,释放出游离 NH4+和NH3[28]。说明,发酵程度越好,乙醇体积分数越高,生成的NH4+也会越多。为了检验发酵程度与NH4+含量的关系,对比黄酒的乙醇体积分数与NH4+的含量, 见图6。随着乙醇体积分数的上升,NH4+的含量总趋势也是上升,可见发酵程度与NH4+的含量相关。
2.5.4 酿造方式及酒龄对NH4+的影响
实验选择了元红、加饭、善酿和香雪及酒龄分别为3、5、8、10 a及15 a的黄酒进行分析,结果发现,不同酿造方式和酒龄对黄酒成品中NH4+的含量无明显规律。
2.6 黄酒中的阳离子含量
对5 种品牌黄酒及同一品牌不同年份黄酒中阳离子含量进行分析,发现黄酒中Na+、K+、Ca2+、NH4+和Mg2+的浓度普遍较高,相比于同一水源地的自来水和地表水中的K+、Ca2+、Mg2+高出上百倍,最高的Ca2+质量浓度超过310 mg/L,其中地表水中NH4+含量极低,作为 黄酒酿造的自来水中的NH4+含量几乎为零[22],而黄酒中NH4+质量浓度最高的达306.14 mg/L,可见黄酒中阳离子主要来源于酿造原料。白酒中NH4+未检出或低于检出限,Na+和Ca2+的含量相比黄酒相差30~270 倍左右。而葡萄酒Na+、Mg2+和Ca2+含量高于常规地表水2 倍多,K+含量普遍较高(超过1 000 mg/L),是黄酒中K+含量的2.62~6.38 倍。K+含量高的主要原因是葡萄(可食部分)本身K+含量较高,达到995 mg/100 g[29-32]。
3 结 论
综上所述,黄酒酿造以麦曲为糖化发酵剂,麦曲中含有丰富的微生物,所分泌的酶由于催化作用可加快蛋白质转变成氨基酸。由于细菌种类繁多,在微生物作用下使原料中蛋白质分解,产生游离NH3和CO2,这会导致NH4+的增加。其原因有待进一步研究,以明确其形成机理,以实现有效的控制。其次黄酒中阳离子普遍比同一水源地的自来水和地表水高出上百倍,尤其是K+、 Ca2+、Mg2+、NH4+,其中NH4+的差异尤为明显,地表水和自来水中含量极低甚至为0,但黄酒中可达 130~310 mg/L,可见,黄酒中阳离子含量高与水质无关,主要与酿造原料有关。不仅如此,发酵程度也会影响NH4+的含量,由于乙醇由酵母发酵转化而来,酵母菌会优先利用铵态氮形式的氮源,因此乙醇体积分数越高,发酵程度也越完全。随着乙醇体积分数的上升,NH4+的含量总趋势会上升,可见发酵程度与NH4+含量有关。
