高压脉冲电场协同酶法辅助提取玫瑰 精油工艺优化
2020-04-02周亚军李圣桡王淑杰薛长美姚光明
周亚军,李圣桡,王淑杰,薛长美,姚光明
(1.吉林大学食品科学与工程学院,吉林 长春 130062;2.吉林大学生物与农业工程学院,吉林 长春 130025;3.盘锦牙博士口腔门诊部,辽宁 盘锦 124000)
玫瑰资源遍布世界各地,是集观赏、美容、医疗、食用、药用等多方面用途于一身的芳香草本植物。玫瑰花中含有多种天然活性物质,如玫瑰精油、色素等[1-2],玫瑰果中含丰富的VC[3],其中玫瑰精油的应用最为广泛,它由几十种芳香化合物组成[4],具有抗氧化[5]、抗菌[6]和抗抑郁[7]等特点。在国际上玫瑰精油主要因其产量较低,价格高昂[8-9]被誉为“液体黄金”,因此,研究玫瑰精油的高效提取方法具有实际意义。
玫瑰精油的常规提取方法之一是水蒸气蒸馏,此法操作简单,应用广泛,但产量较低[10]。近来酶技术已经逐渐被用来提取植物中有效成分[11-12],而且早有研究表明酶辅助处理可增加油料溶出[13]。高压脉冲电场(high intensity pulsed electric field,PEF)技术是一种非热处理技术,最初被用于食品杀菌[14]。随着研究的深入,PEF技术逐渐被应用于天然成分的提取[15-16]。其原理是利用电穿孔作用将流经两个电极之间的液体样品细胞破坏,使胞内活性成分流出。Zhou Yajun等[15]利用PEF提取蓝莓废弃物中花色苷;Medina-Meza等[17]对比超声波和PEF提取李子和葡萄皮中的活性物质;王文渊等[18]利用PEF协同酶法提取竹叶中茶多酚和多糖;但利用PEF协同酶法辅助提取玫瑰精油的报道较少。在本研究中,将PEF和纤维素酶协同处理方法用于玫瑰精油的辅助提取并对工艺进行优化研究,为玫瑰精油的高效提取提供了一种新方法。
1 材料与方法
1.1 材料与试剂
玫瑰花瓣(大马士革品种,采自吉林长白山),于早5:00~7:00采摘后沥干水分,贮存于-20 ℃冰箱中,备用。
纤维素酶(50 U/mg) 上海源叶生物科技有限公司;氯化钠、无水乙醚、无水硫酸钠(均为分析纯) 北京化工厂;正己烷(色谱纯) 济宁恒泰化工有限公司。
1.2 仪器与设备
BCD-266SN型冷藏冷冻箱 合肥美菱股份有限公司; JJ3003A电子天平 梅特勒-托利多仪器有限公司; WFB-HS0101智能破壁机 江门市西屋厨房小家电有限公司;HH数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;PHSJ-4A pH计 上海雷磁仪器厂;PEF装置 长春华迪生物科技开发有限公司;挥发油提取装置 长春 应化所;RE-2000B旋转蒸发器 上海亚荣生化仪器厂; GC/MS-QP2010气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 日本岛津公司。
1.3 方法
1.3.1 样品处理
取100 g冷冻玫瑰花瓣,加入一定比例蒸馏水打浆,备用。
1.3.2 水蒸气蒸馏提取玫瑰精油
参照文献[19]的方法,提取条件:料液比为1∶6(g/mL),10%氯化钠,蒸馏4 h。按照式(1)计算玫瑰精油得率:

1.3.3 酶法辅助提取玫瑰精油实验
向玫瑰花匀浆中加入适量纤维素酶,调节水浴锅温度和pH值,开始酶解实验。结束后按照1.3.2节中方式提取。分别研究蒸馏时间和酶处理条件对玫瑰精油得率的影响。单因素试验水平如表1所示。
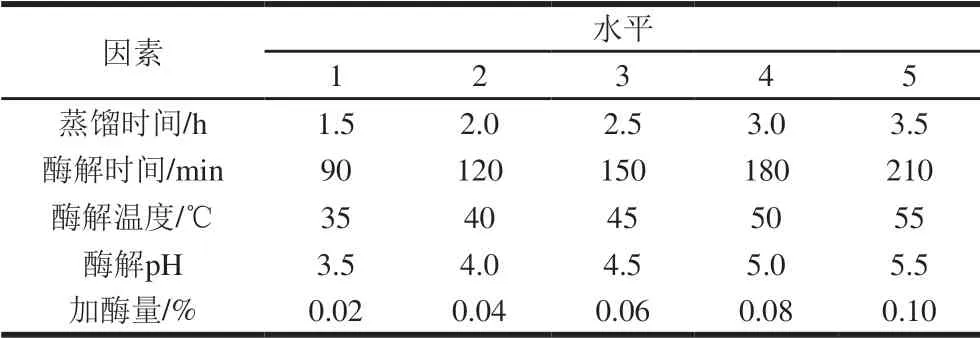
表 1 酶法辅助提取单因素试验水平Table 1 Codes and levels of enzyme-assisted distillation extraction parameters used for one-factor-at-a-time design
1.3.4 PEF协同酶法辅助提取玫瑰精油
1.3.4.1 PEF协同酶法辅助提取方案
由于玫瑰精油得率可能受PEF和酶处理顺序的影响。此外,经过PEF处理,可能会缩短酶解时间。所以设计2 种方案:1)先酶解:酶→PEF→水蒸气蒸馏;2)后酶解:PEF→酶→水蒸气蒸馏。分别测定2 种方案在不同酶解时间条件下的玫瑰精油得率。
1.3.4.2 PEF协同酶法辅助提取
根据酶法辅助提取和PEF协同酶法辅助提取玫瑰精油实验方案,选取适宜的酶解条件和协同辅助提取方法,分别研究蒸馏时间和不同电场处理条件对玫瑰精油得率的影响。单因素试验水平见表2。
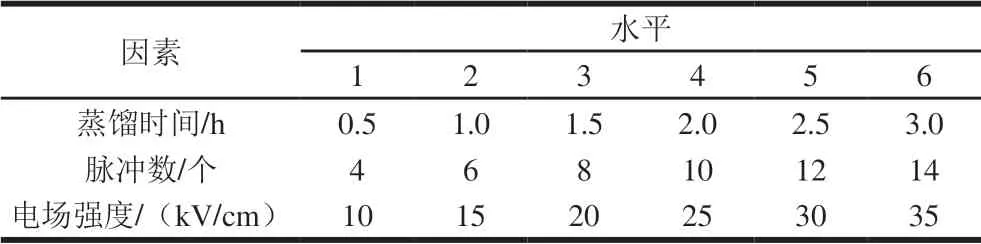
表 2 PEF协同酶法辅助提取单因素试验水平Table 2 Codes and levels of PEF followed by enzyme-assisted distillation extraction parameters used for one-factor-at-a-time design
1.3.5 不同辅助提取方法对比实验
在适宜提取条件下,对比水蒸气蒸馏提取、酶法辅助提取和PEF协同酶法辅助提取3 种方法的精油得率及所用时长。
1.3.6 Box-Behnken响应面试验
根据不同辅助提取方法对比实验,选择最优提取方案,以玫瑰精油得率为响应值,选取对精油得率影响最显著的因素,基于Box-Behnken设计优化玫瑰精油提取的工艺参数。
1.3.7 玫瑰精油成分分析
参考文献[20-21]方法,对最优提取条件下的玫瑰精油进行GC-MS成分分析。
1.3.7.1 色谱条件
色谱柱:HP-5MS石英毛细管柱;升温程序:60 ℃保持1 min、以10 ℃/min升至100 ℃,保持8 min、以5 ℃/min 升至2 3 0 ℃,保持2 0 m i n;载气(H e),流速为 1.0 mL/min;压力15 psi;进样量1 μL,无分流。
1.3.7.2 质谱条件
电子电离源;电子能量70 V;离子源温度200 ℃;接口温度为250 ℃;四极杆温度150 ℃;质量扫描范围m/z 30~500。
1.4 数据统计与分析
每次实验重复3 次取平均值,采用Origin 8.1绘制单因素图像,采用Design-Expert 8.6.0设计3因素3水平Box-Behnken优化试验,各组样品之间的差异采用SPSS 17.0进行分析,P<0.05,差异显著。
2 结果与分析
2.1 酶法辅助提取实验结果
由图1a可知,随蒸馏时间延长,精油得率先逐渐增加后略微下降,3.0 h最大。这是由于蒸馏时间的延长使芳香成分逐渐释放,但达到一定时间后,部分芳香成分因蒸馏过久受到破坏,精油得率下降。因此,选择适宜的蒸馏时间为3.0 h。
从图1b可以看出,精油得率随着酶解时间延长而显著增加,在酶解120 min时,精油得率最大,之后增加不明显。可能原因是反应前期,底物充足,酶解速率快,精油得率升高明显;随着反应时间延长,底物减少直至全部被酶解或酶解产物抑制了酶解反应,使精油得率不再增加。这与Sowbhagya等[22]的研究结果趋势基本一致。因此,选择适宜的酶解时间为120 min。
由图1c可知,精油得率随着酶解温度的升高先上升后下降,在45 ℃时达到最大。这是因为随着温度升高,酶的活性增加,当温度超过一定限度,酶的活性受到抑制,反应速率降低,精油得率下降。这与李晓等[23]的研究结果趋势基本一致。因此,选择适宜的酶解温度为45 ℃。
由图1d可知,随着pH值的升高,精油得率先上升后下降,在pH值为4.5时最大,这是因为在最适pH条件下,酶的活性较高,酶促反应剧烈,最大限度地促进玫瑰精油成分的溶出;而高于或低于最适pH环境都会抑制酶的活性,降低精油得率。这与孟利娜等[24]的研究结果趋势基本一致。因此,选择适宜的酶解pH值为4。
从图1e可以看出,随加酶量的增加,玫瑰精油得率先增加后变化平稳,当加酶量为0.06%时,玫瑰精油得率最大。这是因为加入的纤维素酶逐渐酶解花瓣细胞壁,使其结构破坏,释放出挥发性成分;当酶与花瓣细胞壁全部结合后,精油释放量趋于稳定。Nguyen等[25]的研究也表明酶添加量过多会对细胞壁分解产生不利影响。因此,选择适宜的加酶量为0.06%。
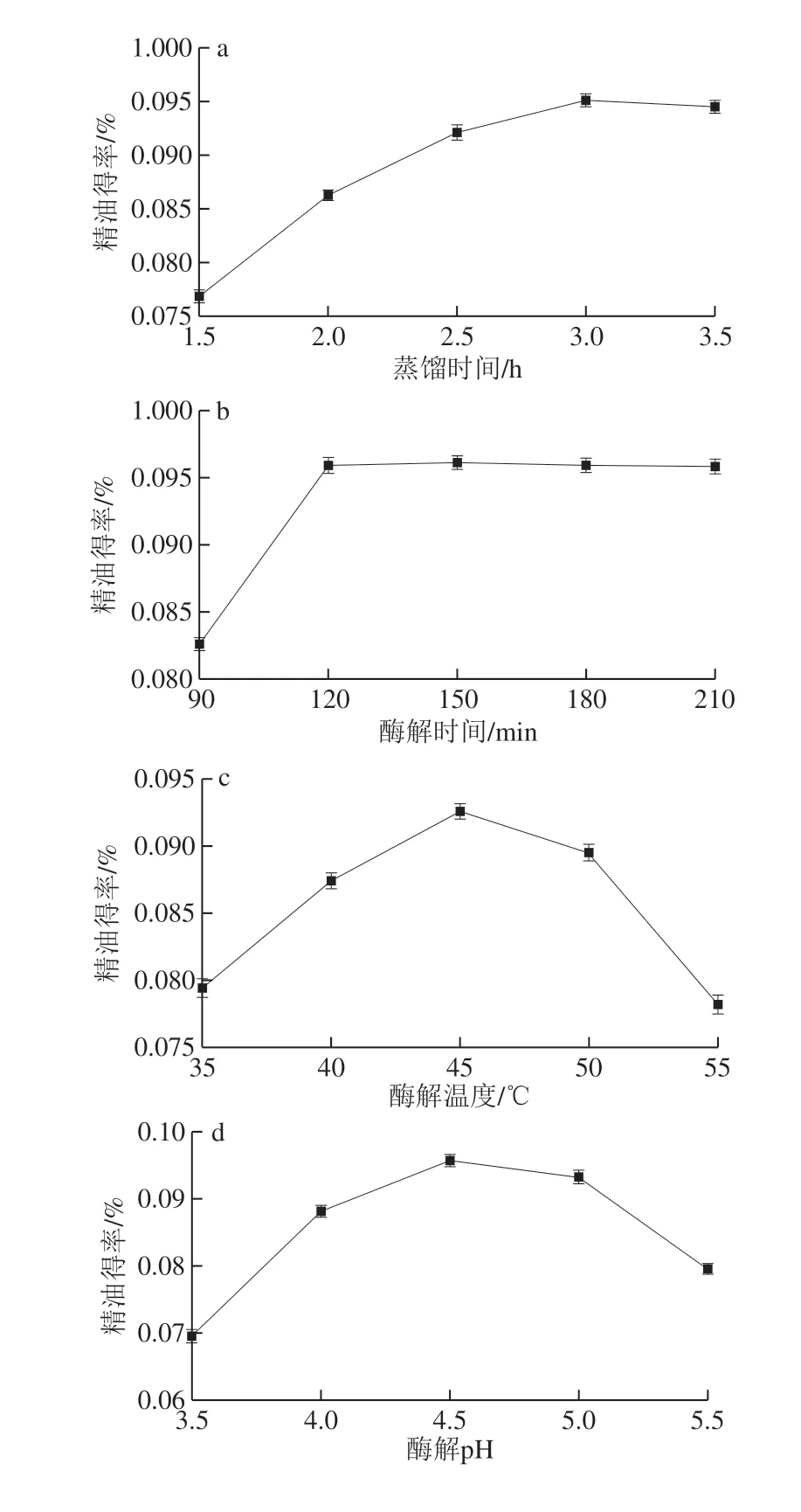
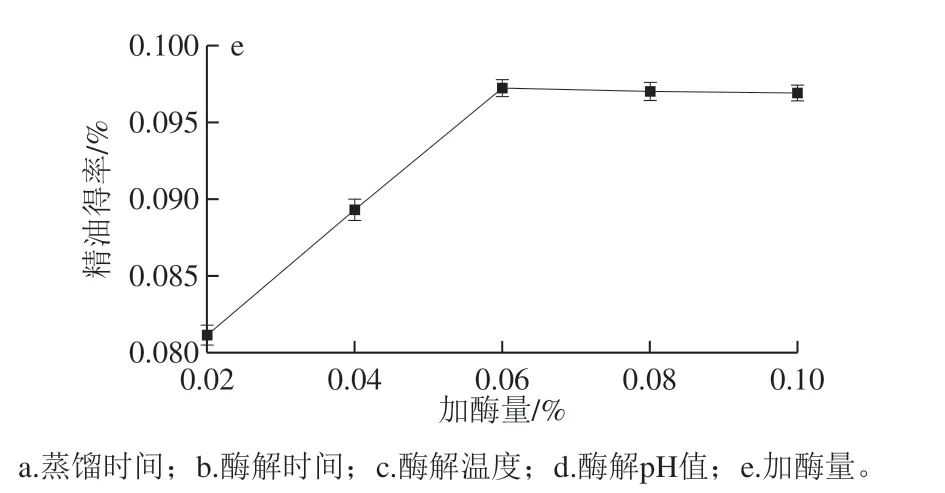
图 1 蒸馏时间和酶处理条件对精油得率的影响Fig. 1 Effect of distillation time and enzyme treatment conditions on the yield of rose essential oil
2.2 PEF协同酶法辅助提取玫瑰精油实验结果
2.2.1 协同处理方式对玫瑰精油得率的影响
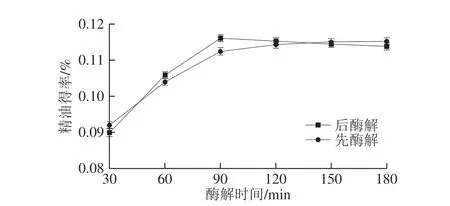
图 2 协同处理方式对玫瑰精油得率的影响Fig. 2 Effect of synergistic treatments on the yield of rose essential oil
由图2可知,随酶解过程的进行,当酶解时间小于90 min时,两种处理方式下精油得率均快速升高。酶解时间大于90 min后,先酶解处理的精油得率升高速率减缓甚至几乎不变,后酶解处理的精油得率缓慢下降。后酶解精油得率在酶解90 min时有最大值且均大于先酶解精油。原因可能是,经过PEF处理后,玫瑰匀浆分散更加均匀,有利于酶与其接触反应,精油得率更高;另一方面,PEF处理可能对酶有激活作用,提高其活性,促进酶解效果。田美玲[26]的研究发现PEF处理能明显提高α-淀粉酶、葡萄糖淀粉酶和果胶酶的活性。因此,选择酶解90 min,先PEF处理后酶解的方式。
2.2.2 蒸馏时间和PEF处理条件对玫瑰精油得率的影响
由图3a可知,随蒸馏时间的延长,精油得率先升高后缓慢降低,蒸馏时间为1.5 h时达到最大。其原因是蒸馏初期,花瓣细胞中芳香成分没有完全溶出,精油得率不断增加,但蒸馏时间过长会破坏热敏成分,降低精油得率。因此,选择适宜蒸馏时间为1.5 h。
由图3b可知,精油得率随着脉冲数的增大呈先上升后下降的趋势,脉冲数为10时取得最大值。其原因可能是随着脉冲数逐渐增大,脉冲频率逐渐增加,PEF对玫瑰匀浆的作用时间相对延长,一方面激活了酶的活性,促进酶解反应,另一方增加了细胞破坏程度,两方面原因同时促进活性成分释放。但当脉冲数达到最大值后,较强的电场作用可能破坏了有效成分的结构和酶的蛋白质结构,降低酶解反应速率,从而降低精油得率。这与Zhou Yajun等[27]的研究结果趋势相似。因此,选择适宜的脉冲数为10 个。
由图3c可知,精油得率随电场强度的增加呈先增大后减小的趋势,电场强度20 kV/cm时取得最大值,这是因为电场能够使细胞内外产生场强差,从而产生极化作用使细胞破坏,随着电场强度的增加,细胞破坏程度越大,更利于与酶接触反应。此外,较低的电场强度激活了酶的活性,使精油得率增加,但当电场强度超过一定限度后,可能会钝化纤维素酶的活性,影响酶解效果,Zhang Ruobing等[28]的研究也认为PEF有钝化酶的作用;而且,过大电场强度可能对芳香成分有所破坏,导致精油得率降低,这与Wang Ke等[29]和He Guidan[30]的研究结果趋势相似。因此,选择适宜电场强度为20 kV/cm。

图 3 蒸馏时间及PEF处理条件对玫瑰精油得率的影响Fig. 3 Effects of distillation time and PEF treatment conditions on the yield of rose essential oil
2.3 不同方法提取玫瑰精油对比实验分析
在适宜条件下,不同提取方法对比实验结果见表3。从精油得率角度看,水蒸气蒸馏提取玫瑰精油得率在0.081 0%左右。酶法辅助提取精油得率在0.096 7%左右,比水蒸气蒸馏提取提高了约19.38%。PEF协同酶法辅助提取精油得率在0.116 5%左右,比水蒸气蒸馏提取和酶法辅助提取分别提高了约43.83%和20.48%。从时间角度看,水蒸气蒸馏提取总用时为4 h。酶法辅助提取总用时为5 h,比水蒸气蒸馏多25%,表明酶法辅助提取虽然能够较为明显的提高精油得率,但耗时较长。PEF协同酶法辅助提取总用时约为3 h,分别比水蒸气蒸馏提取和酶法辅助提取节省25%和40%。与单独酶法辅助提取相比,PEF处理同时缩短了酶解时间和蒸馏时间,这是因为PEF处理,先破坏了花瓣细胞结构,使其更有利于与酶接触反应,导致酶解时间减少,而细胞壁的破坏使蒸馏时间缩短。因此,PEF协同酶法能显著增加玫瑰精油得率并缩短提取时间,是一种玫瑰精油高效提取方法。

表 3 不同提取方法对比实验结果Table 3 Comparison of different extraction methods
2.4 PEF协同酶法辅助提取玫瑰精油工艺优化
以电场强度(A)、脉冲数(B)、蒸馏时间(C)为试验因素,玫瑰精油得率为响应值,基于Box-Behnken设计3因素3水平优化试验,设计及结果见表4。
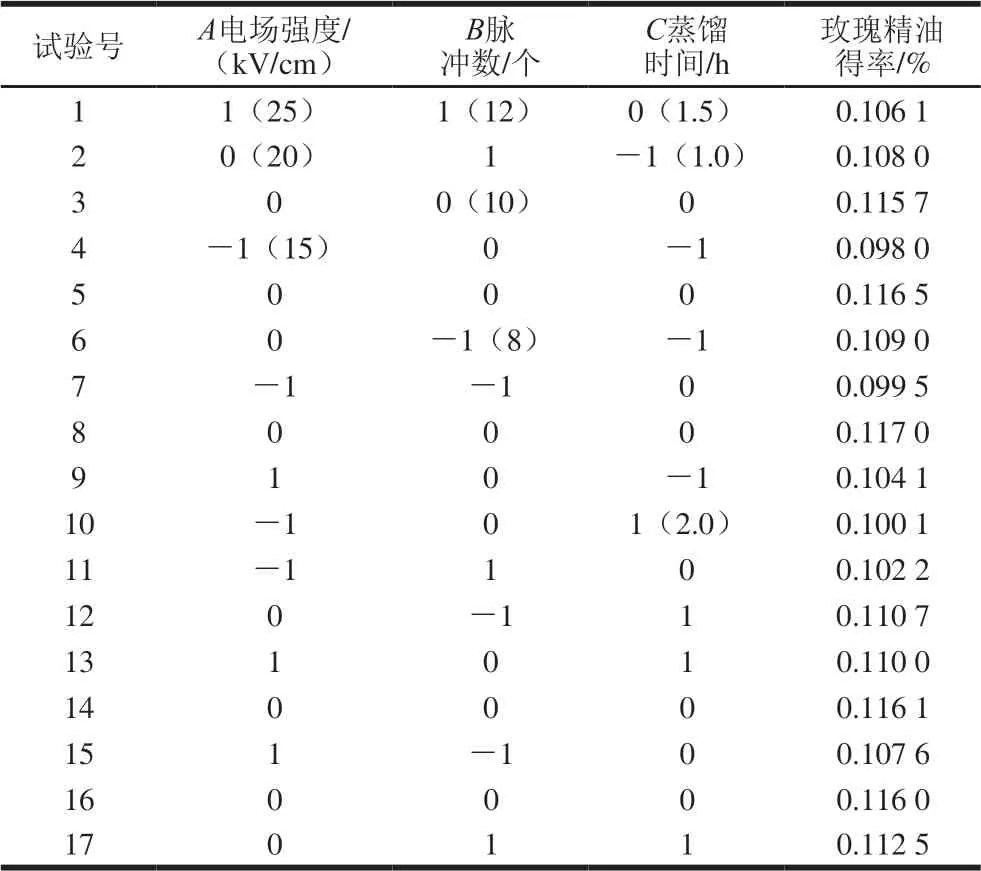
表 4 Box-Behnken试验方案及结果Table 4 Box-Behnken design with experimental results
利用Design-Expert 8.6.0进行电场强度、脉冲数和蒸馏时间对玫瑰精油得率的回归分析,建立二次多项回归方程:
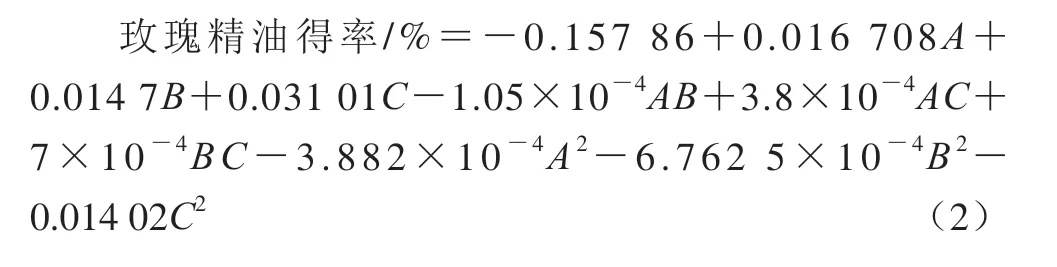
二次回归模型显著性检验与方差分析结果如表5所示。模型F值为146.74,P<0.000 1,说明回归方程模型极显著;失拟项P值为0.145 6>0.05,失拟项检验不显著,方程可以预测响应值。模型的相关系数R2较高,为0.994 7,说明响应值与自变量之间有较高的拟合度,线性关系显著,可对试验进行理论预测。R2Adj为0.987 9,说明试验值与回归方程拟合度高,可以很好的对响应值变化进行解释。因此,此模型可以用来优化PEF协同酶法辅助提取玫瑰精油工艺。电场强度和蒸馏时间的一次项和二次项,脉冲数的二次项,电场强度和蒸馏时间、脉冲数和电场强度的交互作用显著。
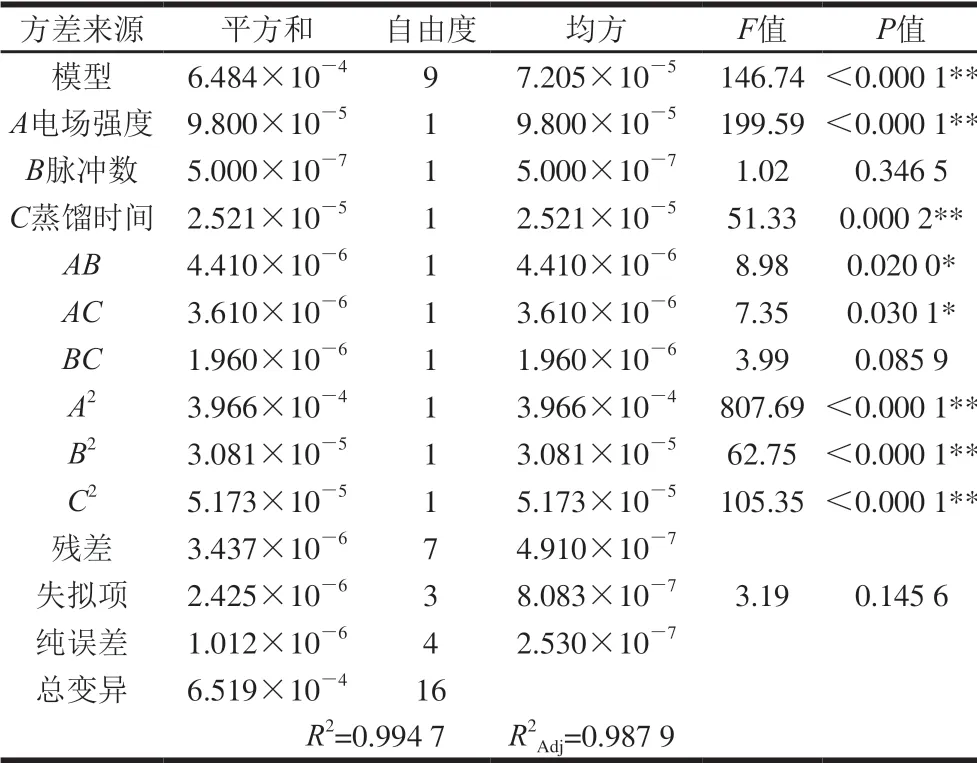
表 5 回归模型方差分析Table 5 Analysis of variance of regression model
图4是电场强度、蒸馏时间和脉冲数3 个因素两两交互作用图,其中电场强度和蒸馏时间、脉冲数和电场强度的交互作用显著,3D效果图的中心区域凸起,表示出现较高的精油得率,并由中心向两边逐渐减小。通过Design-Expert 8.6.0软件分析得出最佳工艺参数:蒸馏时间1.64 h、电场强度20.96 kV/cm、脉冲数10.09 个,玫瑰精油理论预测值为0.116 3%。对最优生产条件进行实际调整,即蒸馏时间1.7 h、电场强度21 kV/cm、脉冲数10 个。通过3 次验证实验,精油得率为0.116 5%,接近预测值。说明响应面法优化PEF协同酶法辅助提取玫瑰精油的参数准确可靠。
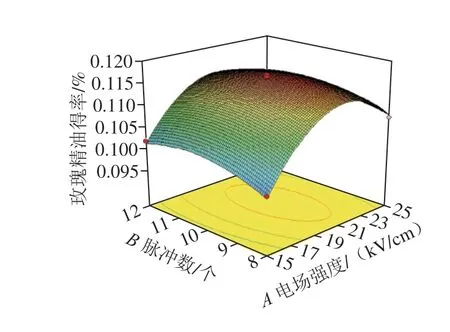

图 4 各因素交互作用的响应面与等高线图Fig. 4 Response surface and contour plots showing interactive effects of various factors on the yield of rose essential oil
2.5 玫瑰精油成分分析
对PEF协同酶法辅助提取玫瑰精油的化学成分进行GC-MS分析,总离子流图见图5,成分分析结果如表6所示。
图 5 玫瑰精油GC-MS总离子流图Fig. 5 Total ion chromatogram of the rose essential oil analyzed by GC-MS
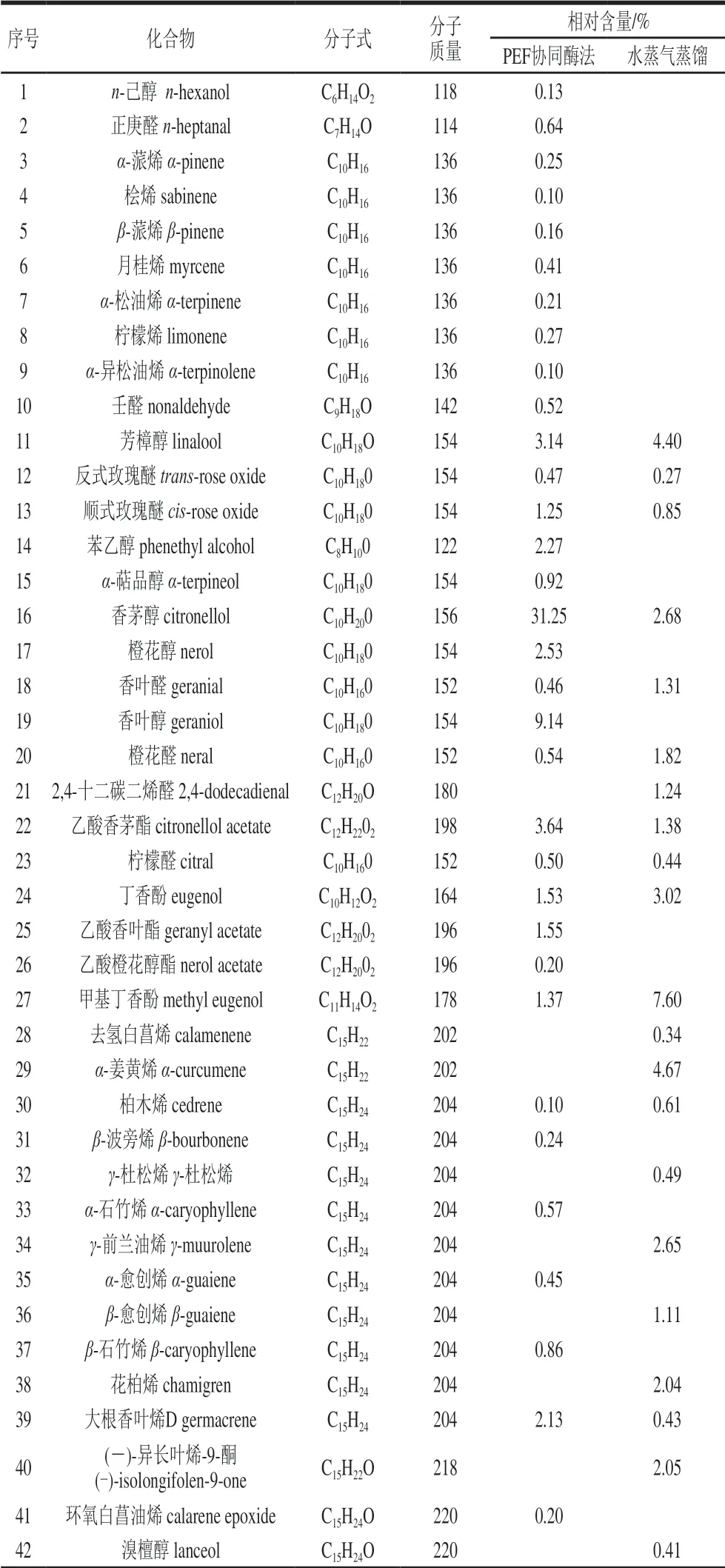
表 6 玫瑰精油化学成分Table 6 Chemical composition of the rose essential oil

续表6
经过GC-MS分析共鉴定出63 种成分,占精油总量的95.04%。其中萜烯类共23 种,醛类共8 种,醇类共13 种,烷烃类共6 种,酯类共6 种以及其他化合物。含量最高的成分是香茅醇(31.25%),其次是十九烷(11.34%),二者是精油的主要芳香成分。其他含量较高的成分还有香叶醇(9.14%)、橙花醇(2.53%)、乙酸香茅酯(3.64%)、芳樟醇(3.14%)、苯乙醇(2.27%)、乙酸香叶酯(1.55%)等,这些丰富的醇类及其酯类构成了玫瑰精油的主体香气成分[31]。此外,对化妆品中呈香物质有较高价值的甲基丁香酚(1.37%)也被检测出[32]。精油中还检测出多种相对含量小于1%的芳香成分,这与文献[33]结果相似,这些微量芳香成分对玫瑰精油综合质量具有重要影响。从水蒸气蒸馏提取的精油中共鉴定出44 种成分,占精油总量的86.74%。由萜烯类、醛类、酮类、醇类、醚类、酚类和其他化合物组成。25 种化合物占比1%以上,其中主要为芳樟醇(4.40%)、香茅醇(2.68%)、香叶醛(1.31%)、橙花醛(1.82%)、丁香酚(3.02%)、甲基丁香酚(7.6%)、乙酸香茅酯(1.38%)、γ-榄香烯(3.72%)、正二十四烷(7.58%)、正三十烷(8.24%)等。对比发现,与不经任何处理的传统水蒸气蒸馏相比,经过PEF协同酶法处理后,鉴定出的精油成分种类显著增多,检测出了更多的小分子化合物,二者共有24 种相同成分,其中重要香气成分种类差别不大,但含量有所不同,表明PEF协同酶法处理使得精油香气成分更多的释放,对成分种类及含量有一定影响,但对主体香气成分种类影响相对较小,保留了玫瑰精油的芳香特性。从成分角度看,PEF协同酶法辅助提取的长白山产玫瑰精油具有很高的利用价值。
3 结 论
酶法辅助提取玫瑰精油最佳工艺条件:蒸馏时间3.0 h,酶解温度45 ℃,酶解时间120 min,酶解pH 4,加酶 量0.06%;PEF协同酶法辅助提取最佳条件:酶解时间90 min,蒸馏时间1.5 h,脉冲数10 个,电场强度20 kV/cm。
PEF协同酶法辅助提取玫瑰精油最佳工艺参数:蒸馏时间1.7 h,脉冲数10 个,电场强度21 kV/cm;对比实验表明,PEF协同酶法辅助提取精油得率比水蒸气蒸馏和酶法辅助提取分别提高了约43.83%和20.48%,总耗时分别节省25%和40%,是一种高效的玫瑰精油提取方法。
GC-MS分析PEF协同酶法辅助提取玫瑰精油鉴定出63 种成分,占精油总量的95.04%,玫瑰精油的主要香气成分均被检测出。与传统水蒸气蒸馏提取相比,PEF协同酶法处理能够促进精油成分释放并保留其芳香特性。
