红树莓果酒发酵过程中功效成分、香气物质及体外降血糖功效的动态变化
2020-04-02饶炎炎唐琳琳陈思睿冯建文傅茂润刘亚敏王金玲
饶炎炎,桑 英,唐琳琳,陈思睿,冯建文,傅茂润,刘亚敏,王金玲,
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江省农业科学院园艺分院,黑龙江 哈尔滨 150040;3.齐鲁工业大学(山东科学院)食品科学与工程学院,山东 济南 250353;4.西南大学资源环境学院,重庆 400716)
红树莓,蔷薇科(Rosaceae)悬钩子属(Rubus L.), 聚合浆果,完全成熟后柔软多汁,不耐贮运,多加工成红树莓果汁、果酱、果酒等,营养丰富,具有保健功效[1]。国内外大都直接借鉴葡萄酒的生产工艺[2],基本 解决了红树莓果酒发酵中的共性问题。针对红树莓成分的研究集中在特定成分[3-5]和挥发性物质[6]的分析测定,而对红树莓果酒发酵过程的主要功效成分的综合性研究鲜见报道。
目前对降血糖功效的研究主要采用体外酶抑制、细胞实验和动物实验[7]等。体外实验法主要利用酶抑制剂降低α-葡萄糖苷酶和α-淀粉酶的活性,阻碍食物中碳水化合物的消化吸收,使用抑制率表征其在体内的降血糖 水平[8]。李萌萌等[9]研究了树莓籽黄酮对α-葡萄糖苷酶和α-淀粉酶的活性有较强的抑制作用。
本实验通过对不同发酵阶段红树莓果酒的活性成分、有机酸种类及含量和香气物质进行测定,同时以 α-葡萄糖苷酶和α-淀粉酶的抑制率为评价指标测定体外降血糖功效,利用高效液相色谱法和气相色谱-质谱联用法分别对8 种有机酸含量和香气物质进行定量研究,揭示果酒发酵过程中功效成分、香气物质及其体外降血糖功效的动态变化,为改进发酵工艺、提高果酒品质提供依据。
1 材料与方法
1.1 材料与试剂
红树莓果(秋福)采自黑龙江省尚志市,速冻处理(-15~-20 ℃)后运回东北林业大学食品科学与工程实验室冻藏。
葡萄酒高活性酵母BV818 安琪酵母股份有限 公司;甲醇、有机酸(草酸、酒石酸、L-苹果酸、乳酸、柠檬酸、富马酸、琥珀酸、莽草酸)(均为色谱纯)、α-葡萄糖苷酶(100 U/g)、α-淀粉酶(4 000 U/g)、 4-硝基苯基-α-D-吡喃葡萄糖苷 上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DK-S电热恒温水浴锅 上海森信试验仪器有限公司;DL-6M榨汁机 湖南星科科学仪器有限公司;ELx800NB型酶标仪 美国BioTek公司;722型可见分光光度计 上海光谱仪器有限公司;KW-3000DE型数控超声波清洗器 昆山市超声仪器有限公司;1200型高效液相色谱仪(配紫外检测器) 美国安捷伦科技有 限公司。
1.3 方法
1.3.1 红树莓果酒制备工艺流程
红树莓冻果→解冻→破碎打浆→浸渍→成分调整→主发酵→分离→后发酵→倒罐→陈酿→澄清→精滤→装瓶→杀菌
1.3.2 操作要点
将红树莓冻果置于室温解冻,破碎打浆得红树莓果醪,4~6 ℃浸渍2 d,向红树莓果醪中添加一定量的白砂糖(第1天调整糖度为21 °Brix,第5天调整糖度为14 °Brix)和质量分数0.3‰ H2SO3;按质量分数0.25‰比例接入酵母种子液(称取2 g葡萄酒高活性酵母BV818于20 倍质量的0.04 g/mL蔗糖溶液中,26~30 ℃活化60 min)于红树莓果醪中,将发酵醪置于20~25 ℃发酵21 d,发酵过程中每12 h搅拌1 次以便完全发酵;经发酵的红树莓果酒密封陈酿10~12 个月;陈酿结束后,将红树莓果酒经板框过滤机过滤调配、装瓶并进行巴氏灭菌。
取样:红树莓果醪计作第0天;将酵母接入发酵醪的时间计作发酵第1天,红树莓果酒的发酵期为21 d左右,从而设置样品采集时间分别为1、3、5、7、9、13、17、21 d;红树莓果酒的陈酿期样品采集时间分别为50、80、130、180、240、300 d。陈酿期间红树莓果酒的质量浓度在(39.20±0.01)~(43.50±0.13)mg/mL范围内变化。
1.3.3 乙醇体积分数和活性成分的测定
量取红树莓果汁和不同发酵阶段的红树莓果酒,进行测定。
乙醇体积分数测定:参照GB/T 15038—2008《葡萄酒、果酒通用分析方法》;花色苷含量测定:采用pH示差法[10];总酚含量测定:采用福林-酚法[10],以没食子酸质量浓度(mg/L)为横坐标,760 nm波长处吸光度为纵坐标,得到回归方程为y=0.077 7x-0.002 6,R2=0.999 5;黄酮含量测定:采用硝酸铝法[11],以芦丁质量浓度(mg/L)为横坐标,510 nm波长处吸光度为纵坐标,得到回归方程为y=0.006 7x+0.001 2,R2=0.999 5;原花青素含量测定:采用盐酸-香草醛法[12],以儿茶素质量浓度(mg/L)为横坐标,499 nm波长处吸光度为纵坐标,得到回归方程为y=3.231 4x+0.003,R2=0.999 0。
1.3.4 有机酸含量的测定
1.3.4.1 色谱条件及标准品制备
色谱柱:Waters C18色谱柱(4.6 mm×250 mm,5 μm);流动相:0.005 g/mL磷酸二氢钾-甲醇(97∶3,V/V);流速0.7 mL/min;柱温35 ℃;进样量10 μL;检测波长210 nm[13]。
分别精密准确称取0.040 0 g草酸、0.020 0 g富马酸、0.020 0 g莽草酸、0.200 0 g酒石酸、0.020 0 g乳酸、0.200 0 g苹果酸、0.040 0 g柠檬酸、0.040 0 g琥珀酸,用超纯水溶解并定容至100 mL容量瓶中,摇匀,得到有机酸标准母液。分别吸取有机酸标准母液配制成质量浓度为2 μg/mL富马酸和莽草酸,20 μg/mL乳酸,40 μg/mL草酸、柠檬酸、琥珀酸,200 μg/mL酒石酸和苹果酸的有机酸混合标准溶液。
1.3.4.2 样品的制备
将红树莓果汁和不同发酵阶段红树莓果酒8 000 r/min离心10 min,以除去菌体和杂质,取上清液1 mL,用纯净水定容至10 mL,用0.45 μm微孔滤膜过滤至进样瓶,随后进行液相色谱测定。在1.3.4.1节色谱条件下,根据保留时间对有机酸定性,采用外标法以有机酸对应的峰面积与标准品的峰面积相比较定量分析样品中有机酸含量,有机酸含量按式(1)计算:

1.3.5 香气物质的测定
1.3.5.1 样品的处理
取约20 mL样品加入40 mL样品瓶中,将样品瓶放入60 ℃水浴中平衡10 min,将老化好(老化时间5 min)的50/30 μm DVB/CAR/PDMS固相微萃取器插入样品瓶中,将石英纤维头暴露于样品瓶的顶空气体中,恒温60 ℃萃取30 min,用手柄将纤维头推回针头内拔出,插入气相色谱-质谱进样器于250 ℃解吸1 min,进行测定[14]。
1.3.5.2 气相色谱-质谱测定条件
色谱条件:DB-5色谱柱(60 m×0.25 mm,0.25 μm);进样口温度250 ℃;载气He,流速1.0 mL/min;采用程序升温方式,由初始温度升至80 ℃保持2 min,然后以 6 ℃/min升至230 ℃,保持13 min,不分流进样。
质谱条件:电子电离源;离子源温度225 ℃;全扫描;电子能量70 eV;质量扫描范围50~500 u。
定性与定量:将采集到的质谱图与NIST02 MS Library图谱库进行检索对比,并用气相色谱峰面积归一化法定量计算出各挥发性成分在红树莓果汁及不同发酵阶段红树莓果酒中的相对含量。
1.3.6 体外降血糖功效的测定
1.3.6.1 α-葡萄糖苷酶抑制率的测定
参照Kumar等[15]的方法并加以改进。取稀释20 倍的不同发酵阶段的红树莓果酒100 μL于96 孔酶标板中,加入1 U/mL的α-葡萄糖苷酶溶液(用0.1 mol/L磷酸缓冲溶液配制,pH 6.8)50 μL,37 ℃孵育15 min使酶活化后,加入10 mg/mL底物4-硝基苯基-α-D-吡喃葡萄糖苷溶液(用0.1 mol/L磷酸缓冲溶液配制,pH 6.8)50 μL,充分混匀后于37 ℃水浴10 min,加入0.1 mol/L的Na2CO3溶液100 μL终止反应,于405 nm波长处测定吸光度,同时设定相同体系下的样品对照组、空白对照组,α-葡萄糖苷酶的抑制率按式(2)计算:

式中:A样品为待测样品与酶参与反应吸光度;A对照为只加待测样品不加酶吸光度;A空白为0.1 mol/L磷酸缓冲溶液和酶反应吸光度。
1.3.6.2 α-淀粉酶抑制率的测定
参照Jdir等[16]的方法并加以改进。取稀释20 倍的不同发酵阶段的红树莓果酒100 μL,加入1 U/mL的α-淀粉酶溶液(用0.1 mol/L磷酸缓冲溶液配制,pH 6.8)50 μL,37 ℃孵育15 min使酶活化后,加入0.01 g/mL可溶性淀粉溶液50 μL,充分混匀后于37 ℃水浴10 min,加入1 mol/L的DNS溶液5 μL终止反应,沸水浴10 min后冷却至室温,加入10 mL蒸馏水稀释后于540 nm波长处测定吸光度,同时设定相同体系下的样品对照组、空白对照组,α-淀粉酶的抑制率按式(2)计算。
1.4 数据处理
采用Excel 2016进行录入、计算实验数据,实验数据表示为±s(n≥3),采用Origin 8.0软件作图,SPSS 22.0软件进行数据处理,Pearson相关系数进行相关 性分析。
2 结果与分析
2.1 红树莓果酒发酵过程中乙醇体积分数的动态变化
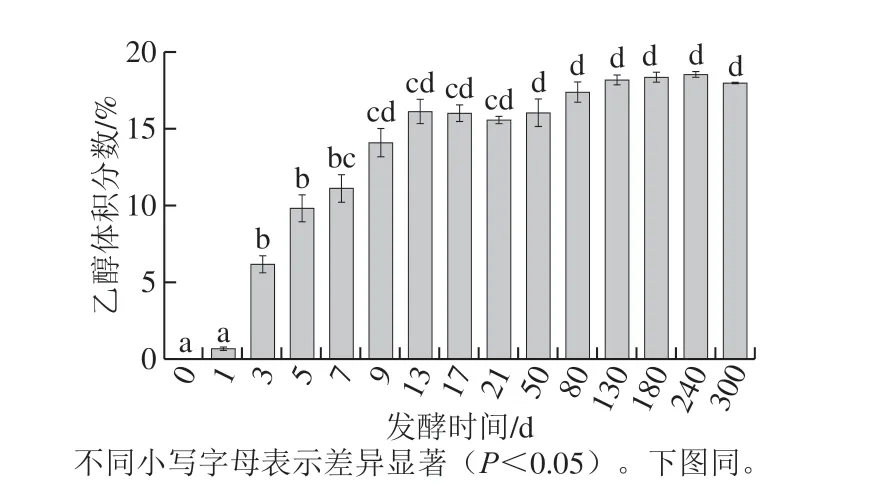
图 1 红树莓果酒酿造期间乙醇体积分数的动态变化Fig. 1 Changes in total sugar and alcohol contents during the brewing of red raspberry wine
由图1可知,红树莓果酒发酵过程中,乙醇体积分数呈先上升后趋于平稳的趋势。发酵0~3 d,乙醇体积分数显著上升(P<0.05),由(0.00±0.005)%升高至(6.16±0.57)%,发酵3~21 d,乙醇体积分数继续上升至发酵期结束为(15.60±0.25)%。造成以上变化的原因主要是在果酒发酵初期,酵母代谢活动旺盛,糖类物质被大量用于酵母的生长繁殖和乙醇发酵,从而导致乙醇体积分数迅速上升,随着发酵进入中后期,酵母能利用的糖类物质减少,乙醇体积分数的变化趋于平稳[17]。
陈酿50~300 d,乙醇体积分数变化幅度较小。这是因为果酒中的糖类物质基本被消耗殆尽,乙醇体积分数因此不再上升,最终稳定在(18.00±0.07)%左右。
2.2 红树莓果酒发酵过程中活性成分的动态变化
2.2.1 红树莓果酒发酵过程中总酚、花色苷的动态变化
由图2可知,红树莓果酒发酵过程中,花色苷、总酚呈先上升后缓慢下降的趋势。红树莓果汁(发酵第0天)的花色苷质量浓度为(165.34±5.37)mg/L,发酵1~9 d,花色苷逐渐降低,由(173.64±5.72)mg/L下降至(90.97±6.36)mg/L,前期可能是花色苷的积累及浸渍作用,后期由于酵母在乙醇发酵期间产生β-葡萄糖苷酶能水解花色苷的糖苷键,造成花色苷下降。王行等[18]研究发现蓝莓酒发酵过程花色苷在第1天达到峰值,之后逐渐降低,与本实验研究结果相似。红树莓果汁(发酵第0天)的总酚为(145.16±3.10)mg/L,发酵1~9 d,总酚质量浓度显著降低(P<0.05),由(153.32± 2.26)mg/L下降至(124.66±0.04)mg/L,前期可能是浸渍作用使总酚升高,后期由于酵母产生大量次级代谢产物,多酚类化合物与蛋白质、多糖等大分子物质结合或吸附,从而导致酒液中总酚含量下降[19]。
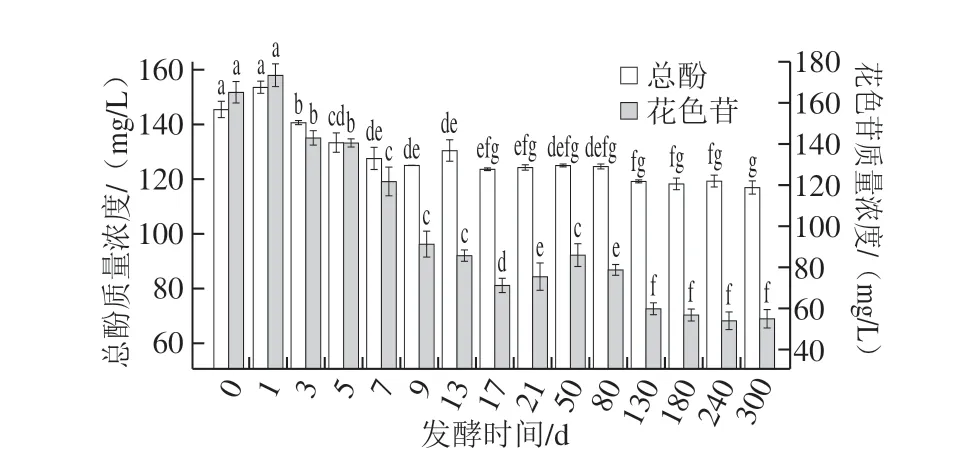
图 2 红树莓果酒酿造期间总酚、花色苷的动态变化Fig. 2 Changes in total phenols and anthocyanins contents during the brewing of red raspberry wine
陈酿50~300 d,酒液的花色苷质量浓度继续降低,最终维持在(54.39±4.51)mg/L左右;总酚质量浓度稳定在(116.53±2.36)mg/L。陈小玲等[20]研究发现在蓝莓果酒发酵过程中,花色苷含量逐渐降低,与本实验研究结果相似。与未发酵的红树莓果汁相比,陈酿300 d的果酒总酚、花色苷分别保留了约80%和33%,这表明花色苷在果酒酿造期间的稳定性不佳,易受酸、碱、光、热、氧气等多种因素的影响。
2.2.2 红树莓果酒酿造期间黄酮、原花青素的动态变化
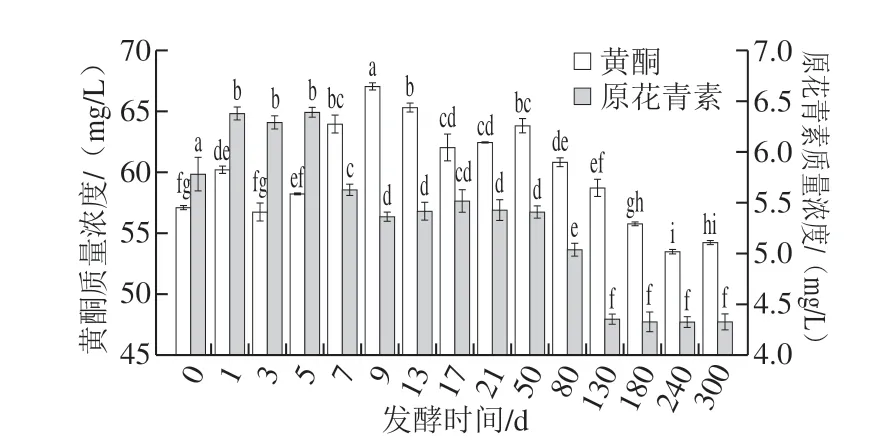
图 3 红树莓果酒酿造期间黄酮、原花青素的动态变化Fig. 3 Changes in flavonoids and procyanidins contents during the brewing of red raspberry wine
由图3可知,红树莓果酒发酵过程中,黄酮、原花青素呈先上升后下降的趋势。发酵0~1 d,酒液的黄酮质量浓度由(57.10±0.17) mg/L上升至(60.19±0.29) mg/L, 发酵3~9 d,黄酮质量浓度显著升高(P<0.05),由(56.72±0.74) mg/L上升至(67.03±0.30) mg/L;发酵0~5 d,原花青素质量浓度由(5.77±0.16) mg/L达到最大值(6.38±0.04) mg/L,这可能是由于原花青素广泛存在于树莓籽、皮中[21],发酵期间树莓籽、皮中的原花青素被浸提出来,导致其含量升高。
陈酿50~300 d,酒液的黄酮质量浓度逐渐降低,由(63.80±0.59) mg/L下降至(54.22±0.17) mg/L, 张强等[22]研究表明红树莓果醋在发酵过程中黄酮含量呈现先上升后下降的趋势,之后趋于稳定。陈酿50~130 d,原花青素呈下降趋势,之后趋于稳定,其质量浓度由(5.40±0.06) mg/L迅速下降至(4.35±0.04) mg/L,300 d果酒的原花青素质量浓度为(4.32±0.07) mg/L。与未发酵的红树莓果汁相比,陈酿300 d的果酒黄酮、原花青素分别保留了约95%和75%,这表明黄酮类物质在果酒酿造期间损失较少。
2.3 红树莓果酒发酵过程中有机酸种类和含量的动态变化
有机酸是红树莓果酒的重要组成部分,在果实的成熟阶段、果酒的加工及陈酿期间都会引起有机酸组成和含量的变化。而有机酸的种类和含量影响红树莓果酒的协调性、口感、色泽及生物稳定性,与果酒的典型性、品质关系密切[23]。通过采用高效液相色谱法对红树莓果汁和不同阶段红树莓果酒中的有机酸进行测定,主要有机酸含量见表1、图4。
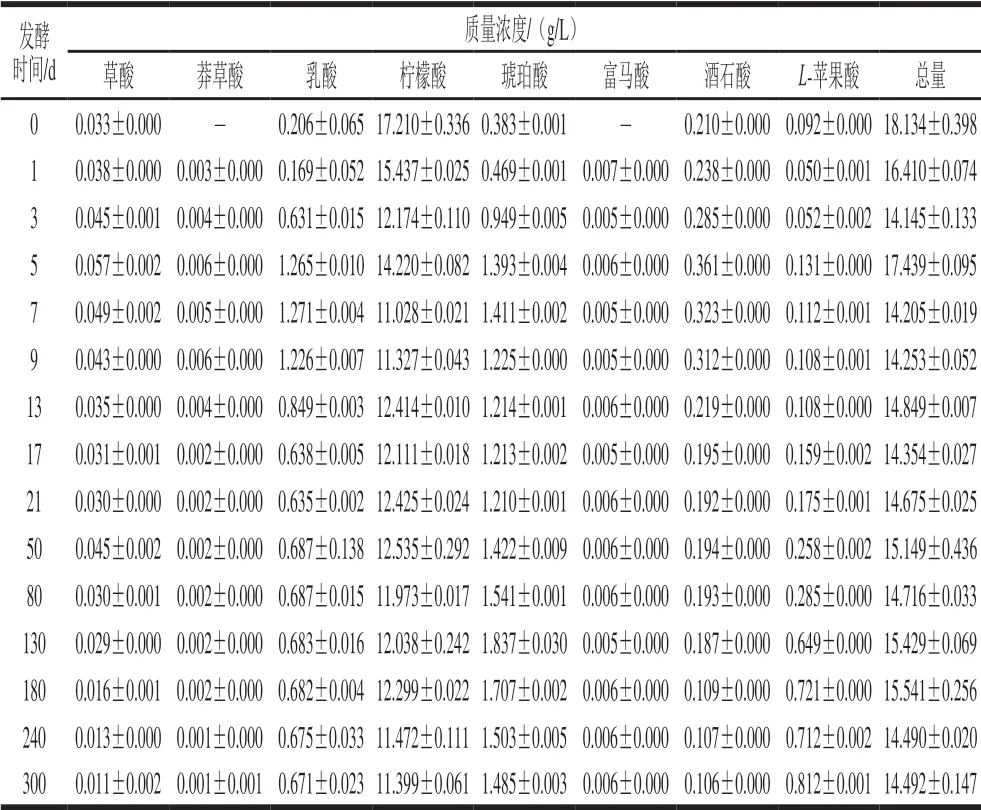
表 1 红树莓果酒酿造期间有机酸含量的动态变化Table 1 Changes in organic acid contents in red raspberry wine during brewing
由表1可知,红树莓果汁(发酵第0天)中的柠檬酸、琥珀酸、酒石酸、乳酸较高,草酸和L-苹果酸较低,未检出富马酸和莽草酸。与红树莓果汁相比,红树莓果酒中有机酸种类增多,新生成了富马酸和莽草酸。红树莓果酒发酵期间,酒石酸、草酸和莽草酸的变化规律相似,随着发酵的进行含量均缓慢升高,在发酵第5天含量达到最高;L-苹果酸随着发酵时间的延长不断积累;乳酸和琥珀酸的变化规律相似,在第5天时大量生成,在发酵第7天时含量达到最大值;柠檬酸随着发酵时间的延长含量逐渐降低。柠檬酸、琥珀酸、乳酸、苹果酸在发酵期间变化幅度较大,主要是由于其为碳代谢的中心物质,是酵母菌糖降解途径的主要中间产物。红树莓果酒陈酿期间,L-苹果酸呈缓慢升高趋势,在第130天时大幅增加;琥珀酸在第130天时大量生成,此后随着陈酿的进行,琥珀酸缓慢降低;草酸、酒石酸和莽草酸呈降低趋势;柠檬酸、乳酸随着陈酿时间的延长其含量略微下降后逐渐稳定。富马酸在果酒酿造期间较少,基本稳定在0.006 g/L。
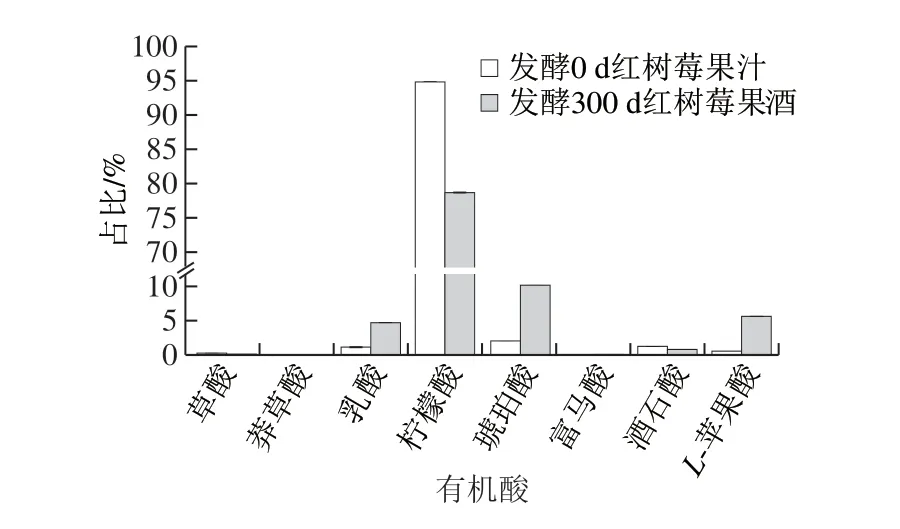
图 4 红树莓果汁与发酵300 d红树莓果酒中主要有机酸占比Fig. 4 Percentages of major organic acids in red raspberry juice and red raspberry wine fermented for 300 d
由图4可知,红树莓果汁和果酒中的有机酸种类和含量存在明显差异。红树莓果汁(发酵第0天)中的柠檬酸约占有机酸总量的95%;发酵300 d的红树莓果酒中的柠檬酸约占有机酸总量的79%,比发酵前降低了16%;与红树莓果汁相比,琥珀酸增加了8.14%,L-苹果酸增加了5.09%,乳酸增加了3.49%,柠檬酸会产生一种令人愉快的兼有清香感的酸味,而乳酸的酸味柔和,有后酸味,可提供柔和的风味,增加了红树莓果酒的醇厚感[15]。
研究表明,红树莓果汁的有机酸成分与葡萄差异很大,成冰等[24]测定分析了不同品种酿酒葡萄的有机酸含量,其中酿酒白葡萄的主要有机酸以酒石酸、苹果酸为主,酿酒红葡萄以苹果酸和柠檬酸为主;红树莓果酒的有机酸以柠檬酸、琥珀酸为主,L-苹果酸、乳酸次之,酒石酸、草酸微量,同时因发酵代谢积累了少量莽草酸和富马酸,与韩晓鹏等[25]的研究结果基本吻合。目前树莓酒的酿酒酵母大多采用葡萄酒专用活性酵母,制成的果酒不能突出树莓的独特风味且酸度较高,今后可以考虑进行树莓专用酿酒酵母的研制、筛选降解柠檬酸的酵母菌或在发酵前去除部分柠檬酸等研究。
2.4 红树莓果酒发酵过程中香气物质的动态变化
香气物质是衡量果酒风味品质的重要指标,果酒的香气主要来自果实本身、酵母发酵及陈酿等过程,是树莓果酒风味化学研究的重点。通过气相色谱-质谱得到的色谱图,与标准质谱库NIST检索匹配,选取匹配度不小于85%的物质进行分析,主要香气成分见表2、3。
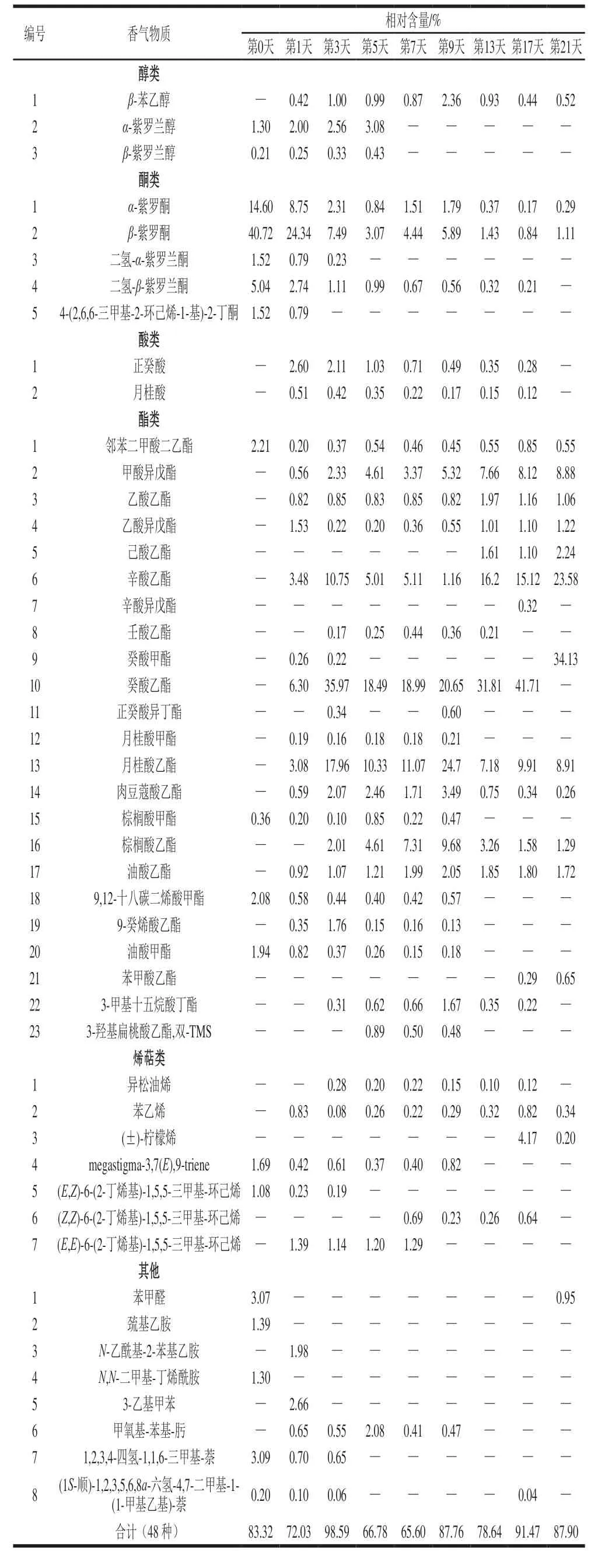
表 2 红树莓果酒发酵期间香气物质及相对含量的动态变化Table 2 Changes in aroma components contents during fermentation of red raspberry wine
由表2可知,发酵第0天(红树莓果汁)鉴别出18 种香气物质,相对含量为83.32%,其中醇类2 种,相对含量为1.51%;酮类5 种,相对含量为63.40%,其中β-紫罗酮相对含量为40.72%,α-紫罗酮相对含量为14.60%;酯类4 种,相对含量为6.59%;烯萜类2 种,相对含量为2.77%;其他类5 种,相对含量为9.05%。α-紫罗酮和 β-紫罗酮是C13降异戊二烯类香气物质,在很多树莓品种中被检出,被认为是树莓中的特征香气物质。α-紫罗酮具有一种罐藏桃子和烤苹果香味,其香气阈值很低,仅为0.09 μg/L;β-紫罗酮具有花香和树莓香[26]。决定树莓风味特征的挥发性化合物——树莓酮,其化学名称为对-羟基苯基-2-丁酮,由于其具有较低的挥发性,因此较难用固相微萃取方法萃取到[27],因此果酒中并未检出。
红树莓果酒发酵期间鉴别出46 种香气物质,其中醇类3 种、酮类5 种、酸类2 种、酯类23 种、烯萜类7 种、其他类6 种,以酯类、醇类和酮类物质为主。香气物质总相对含量呈先升高后降低,之后略有上升趋势。其中酯类物质逐渐增加,其中邻二甲酸二乙酯、辛酸乙酯、癸酸乙酯、甲酸异戊酯、乙酸乙酯、乙酸异戊酯、油酸乙酯逐渐增加,月桂酸乙酯、肉豆蔻酸乙酯、棕榈酸甲酯、棕榈酸乙酯、油酸甲酯先增加后缓慢下降。大多数酯类具有花果香气,如辛酸乙酯略带有玫瑰、橙子的花果香气,是白兰地酒特有的香味物质[28];苯甲酸乙酯具有浓烈的花香,并带有水果的清香气味,癸酸乙酯具有似葡萄的水果香气,是葡萄酒中的重要香气成分[29],这是因为酿造红树莓果酒使用的酵母菌是一种常用的葡萄酒酿造酵母,所以使用不同的酵母菌生产果酒,其香气物质会有很大的差别。醇类物质先增加后降低,在发酵第5天达到最大值;酮类、酸类物质随着发酵的进行逐渐降低。其中酸类物质易与醇类物质发生酯化反应,后发酵中酵母菌的乙醇发酵作用将有机酸降解为乙醇小分子物质[30],因此经过发酵后的红树莓果酒中的酸类物质有所下降,与本实验有机酸的变化趋势一致。
由表3可知,红树莓果酒陈酿期间鉴别出23 种香气物质,其中醇类4 种、酮类2 种、酯类12 种、烯萜类4 种、其他类1 种,以酯类、醇类和酮类物质为主。香气成分的总相对含量呈逐渐升高的趋势。其中酯类物质逐渐降低,主要香气成分有辛酸乙酯、癸酸乙酯、月桂酸乙酯、甲酸异戊酯,但甲酸异戊酯在果酒酿造期间呈逐渐增加的趋势;酮类物质呈逐渐增加的趋势,但仍低于红树莓果汁,主要香气物质为α-紫罗酮、β-紫罗酮,其中α-紫罗酮相对含量在陈酿第130天达到最大值0.78%,β-紫罗酮相对含量在陈酿第180天达到最大值1.66%。醇类物质逐渐增加,异戊醇为主要香气物质。周立华等[30]发现秋福树莓的异戊醇为醇类的主体香气,它的存在使秋福树莓具有草香和成熟的果香特点,与本实验研究一致。红树莓果酒中醇类物质绝大多数体现酵母菌发酵的发酵香,苯乙醇不仅具有一定的杀菌作用,同时具有玫瑰花香和茉莉花香等多种风味,给人以柔和愉悦的感 觉[30],是红树莓果酒典型的醇类香气物质。
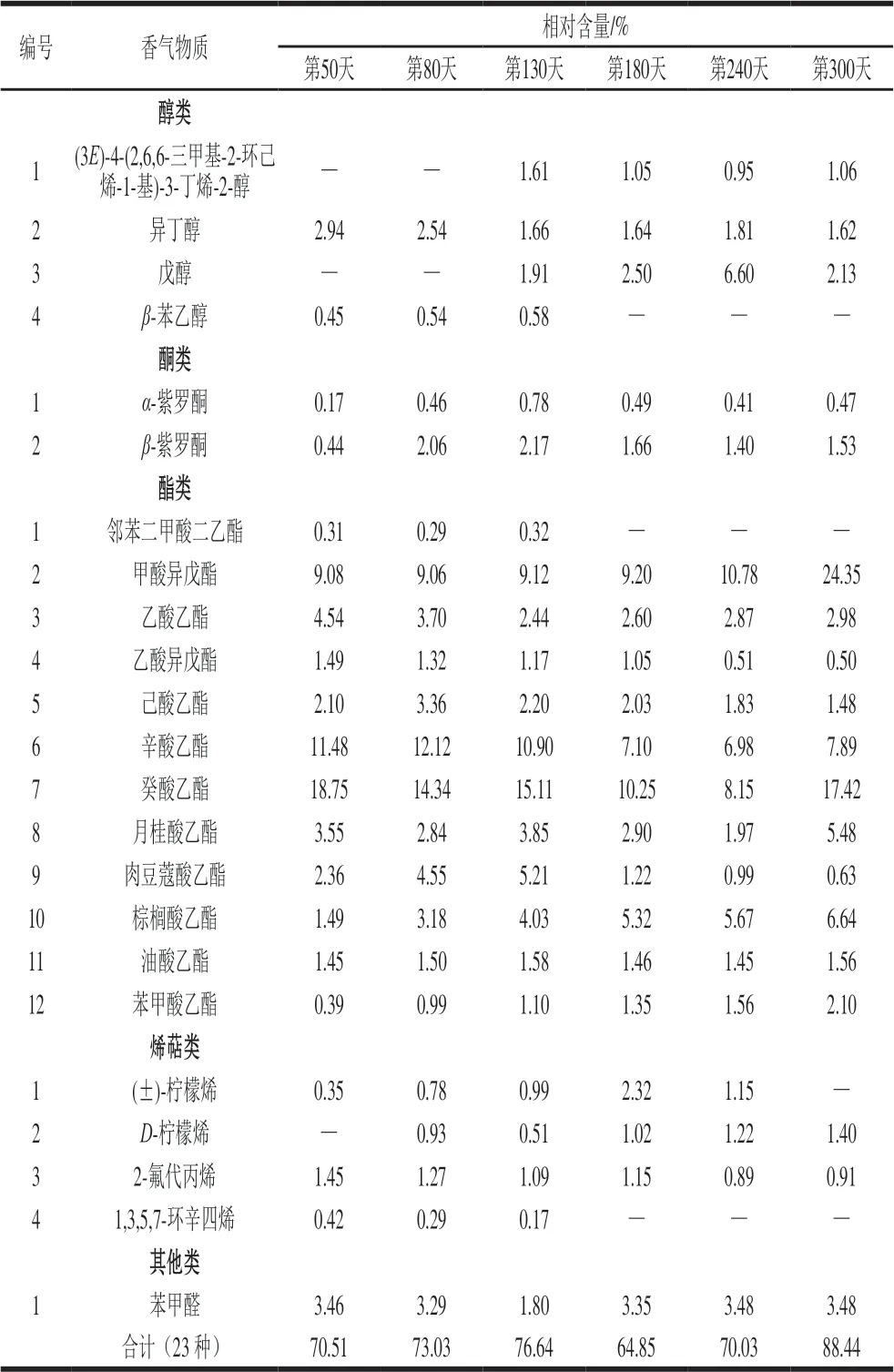
表 3 红树莓果酒陈酿期间香气物质及相对含量的动态变化Table 3 Dynamic changes in aroma components contents of red raspberry wine during aging
红树莓果汁的主要香气物质为酮类,如α-紫罗酮、 β-紫罗酮,红树莓果酒的主要香气物质为酯类,如辛酸乙酯、癸酸乙酯、月桂酸乙酯、甲酸异戊酯。王丽霞等[31]在红树莓汁、红树莓汁发酵酒中共检测出74 种香气物质,其中红树莓汁的主要香气物质为酮类(47.86%),经发酵后酮类物质减少,醇类和酯类物质有明显增加,发酵酒中主要香气物质为酯类(68.65%)。殷俊伟等[32]在红肉火龙果酒中共检测出34 种香气物质,其中酯类物质对火龙果酒的香味贡献最大,其次是醇类和酸类,还有少量的醛类和酚类物质,与本实验研究结果相似。酯类、酮类物质感官阈值较低,对果酒的主体香气贡献最为显著,对红树莓果酒的香气影响最大;醇类、酸类物质感官阈值较高,对红树莓果酒的香气影响有限;烯萜类组分的感官阈值较低,虽然其含量低,但香气很明显,香味独特,对红树莓果酒的香气组成起着不可忽视的作用。红树莓果酒酿造期间,随着糖类物质逐渐被消耗,醇类、酯类、酸类等各种物质大量生成,且各物质相互补充,赋予红树莓果酒独特的风味。
2.5 红树莓果酒发酵过程中降血糖功效的动态变化

图 5 红树莓果酒酿造期间α-葡萄糖苷酶和α-淀粉酶抑制率Fig. 5 Changes in inhibition rates of α-glucosidase and α-amylase during the brewing of red raspberry wine
由图5 可知,红树莓果酒发酵过程中α-葡萄糖苷酶和α-淀粉酶抑制率呈先上升后下降的趋势。红树莓果汁(发酵第0 天)的α-葡萄糖苷酶抑制率为(82.70±1.02)%。发酵1~5 d,α-葡萄糖苷酶抑制率逐渐升高,由(78.92±0.65)%上升至(90.18±0.77)%。发酵0~1 d,α-淀粉酶抑制率显著升高(P<0.05),由(61.81±1.17)%上升至(87.93±2.10)%,从发酵第3天起,α-淀粉酶抑制率由快速降低到缓慢降低后逐渐趋于平稳,发酵第21天后稳定在(60.96±1.29)%,这可能与果酒酿造期间活性成分的消长规律有关。
陈酿50~300 d,α-葡萄糖苷酶抑制率变化不大,最终稳定在(80.58±0.90)%左右。陈酿50~240 d, α-淀粉酶抑制率由(5 9.3 6±1.2 0)%下降至(54.92±1.45)%,陈酿300 d的果酒α-淀粉酶抑制率为(56.41±1.42)%。与未发酵的红树莓果汁相比,两者的降血糖功效相差不大。阳性对照2 mg/mL的阿卡波糖液对α-葡萄糖苷酶和α-淀粉酶抑制率分别为96.14%、95.65%,均高于红树莓果酒。
2.6 红树莓果酒活性成分与降血糖功效的相关性分析
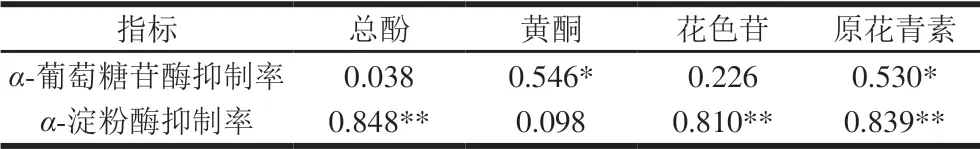
表 4 红树莓果酒活性成分与降血糖功效的相关性Table 4 Correlation between active components and hypoglycemic effect of red raspberry wine
由表4可知,α-葡萄糖苷酶抑制率与黄酮、原花青素显著相关,总酚、花色苷对α-葡萄糖苷酶抑制率最小。王占一等[33]研究发现石榴幼果总黄酮质量浓度为 1.5 mg/mL时,对α-葡萄糖苷酶抑制率达到63.9%。α-葡萄糖苷酶的抑制率与总酚呈较低的正相关,可能是因为多酚、有机酸、多糖、蛋白质等对α-葡萄糖苷酶均具有抑制作用,且抑制作用可能有协同作用[34]。α-淀粉酶抑制率与总酚、花色苷和原花青素极显著相关,黄酮对α-淀粉酶抑制率的贡献率最小。徐艳阳等[35]研究发现黑果腺肋花楸多酚对α-淀粉酶具有显著的抑制作用,且在质量浓度为0.7 mg/mL时,黑果腺肋花楸多酚对α-淀粉酶的抑制活性(95%)强于阳性对照阿卡波糖(86%)。
3 结 论
红树莓果酒发酵过程中,乙醇体积分数的升高数据符合酵母菌发酵的代谢规律;活性成分均呈先上升后下降趋势,其中总酚、花色苷在发酵第1 天达到最大值,质量浓度分别为(153.32±2.26)、 (1 7 3.6 4±5.7 2) m g/L,最终分别稳定在(116.53±2.36)、(54.39±4.51) mg/L,黄酮在发酵第9天达到最大值,质量浓度为(67.03±0.30) mg/L,最终稳定在(54.22±0.17) mg/L,原花青素在发酵第5天达到最大值,质量浓度为(6.38±0.04) mg/L,最终稳定在(4.32±0.07) mg/L,黄酮类物质被很好地保留,花色苷损失最大。α-葡萄糖苷酶、α-淀粉酶抑制率呈先上升后下降的趋势,α-葡萄糖苷酶抑制率在发酵第5天达到最大值,为(90.18±0.77)%,α-淀粉酶抑制率在发酵第1天达到最大值,为(87.93±2.10)%,最终分别稳定在(79.20±0.72)%、(55.13±0.99)%。由此可见,红树莓果酒具有一定的降血糖功效,但体外降血糖实验说服力不强,今后可继续进行果酒体内降血糖功效研究。
红树莓果汁的主要香气物质为酮类,如α-紫罗酮、 β-紫罗酮;红树莓果酒的香气物质先上升后趋于平稳,在发酵第3天达到最大值,相对含量为98.59%,其主要香气物质为酯类,如辛酸乙酯、癸酸乙酯、月桂酸乙酯、甲酸异戊酯;有机酸含量逐渐降低,其中以柠檬酸、琥珀酸为主,L-苹果酸、乳酸次之,酒石酸、草酸微量,同时因发酵代谢积累了少量莽草酸和富马酸,其中果酒发酵期间β-苯乙醇、α-紫罗酮、β-紫罗酮、正癸酸、甲酸异戊酯、癸酸乙酯、辛酸乙酯等香气物质变化幅度较大,琥珀酸、乳酸、柠檬酸、苹果酸变化较明显。但是获得果酒酸度较高,仍需开展筛选降解柠檬酸的酵母菌进行发酵或在发酵前去除部分柠檬酸的研究。
