瑞士乳杆菌MB2-1源胞外多糖对10 种 益生菌生长特性的影响
2020-04-02张学亮周子文莫乔雅董明盛张秋勤陈晓红
黄 蓉,张学亮,韩 烁,周子文,莫乔雅,董明盛,芮 昕,张秋勤,陈晓红,李 伟
(南京农业大学食品科技学院,江苏 南京 210095)
益生菌指可改善宿主肠内微生态的平衡,并对宿主有正面效益的活性微生物,具有增强人体免疫力、降低血清胆固醇、帮助吸收营养成分等作用。乳酸菌是人体内重要的益生菌,是发酵糖类产物主要为乳酸的一类无芽孢[1]、格兰氏阳性细菌的总称,担负着人体多种重要生理功能的调节任务,能够调节机体胃肠道正常菌群,控制内毒素,抑制肠道内腐败菌生长繁殖和腐败产物的生成,具有维持人体微生态平衡的作用。乳酸菌要发挥其益生功能需定植于肠道中,其胞外多糖(exopolysaccharides,EPS)及短链脂肪酸(short-chain fatty acids,SCFA)等代谢产物可以帮助其发挥该功能。EPS是指明串珠菌属、双歧杆菌属、乳杆菌属、链球菌属等微生物在生长代谢过程中分泌到细胞壁外的黏液或荚膜多糖的总称[2-5],具有免疫调节、抗氧化、降血糖、改善人体胃肠道等多种功能特性[6-7]。SCFA具有较强的维护肠道功能和形态的作用,兼具治疗作用,可以缓解并治疗结肠炎等多种肠道外壳疾病[8-11]。
在前期研究中从新疆赛里木酸奶中筛选到一株产EPS的瑞士乳杆菌(Lactobacillus helveticus)MB2-1,它能水解乳蛋白产生很多种生物多肽,有些多肽具有抑制引起高血压的血管紧张素酶活性的作用而起到降血压 功效[12-19]。已有研究对其EPS进行了分离纯化[20]、结构鉴定以及体外抗氧化能力的测定[21]。L. helveticusMB2-1源EPS分离纯化后可得到3 种纯组分,分别为EPS-1、EPS-2、EPS-3,各纯组分结构已明确,且已知该EPS具有较强的超氧阴离子自由基清除活性,但目前瑞士乳杆菌MB2-1不同多糖组分对人体肠道菌群的调节作用及其益生机制尚不明确,因此本实验旨在通过研究源于瑞士乳杆菌MB2-1的总EPS和EPS-2对益生菌增殖过程中的生长密度、多糖消耗量和SCFA生成量的影响,评价 L. helveticus MB2-1源EPS的益生功能。
1 材料与方法
1.1 材料与试剂
瑞士乳杆菌(L. helveticus)MB2-1、德氏乳杆菌保加利亚亚种(L. delbrueckiissp.bulgaricus)WG-1、发酵乳杆菌(L. fermentum)z-15、植物乳杆菌 (L. plantarum)70810、屎肠球菌(Enterococcus faecium)MN-1、L. delbrueckiissp.bulgaricusSRFM-1、 乳酸乳球菌(Lactococcus lactis)LZ-R-12、副干酪乳杆菌(L. paracasei)S-NA、L. plantarumB1-6、L. plantarumM7-1、L. plantarum17-1、大肠杆菌(Escherichia coli)K12、E. coli O157均由南京农业大学食品科技学院微生物实验室分离纯化提供。
低蛋白乳清粉 荷兰DV营养公司;MD34透析袋(截留分子质量8 000~14 000 Da) 北京索莱宝科技有限公司;其他试剂均为国产分析纯。
80 g/L和120 g/L的低蛋白乳清培养基,108 ℃灭菌15 min。
MRS培养基:蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,葡萄糖20.0 g,吐温80 1.0 mL,无水乙酸钠5.0 g,柠檬酸三铵2.0 g,K2HPO42.0 g,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,蒸馏水1 000 mL,pH 6.2~6.6,121 ℃灭菌20 min。
测定微生物生长状况的培养基都是以源于 L. helveticus MB2-1的总EPS或EPS-2或葡萄糖为唯一碳源的MRS培养基。
1.2 仪器与设备
手提式压力蒸汽灭菌锅 上海三申医疗器械有限公司;AUY120分析天平 日本岛津公司;LRH系列生化培养箱 上海一恒科技有限公司;SL-N电子 天平 上海民桥精密科学仪器有限公司;Air Tech超净工作台 苏净集团安泰公司;Avanti J-E冷冻离心机 美国Bechkman Coulter公司;Hei-VAP Advantage(HL)旋转蒸发仪 德国Heidolph公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent科技股份有限公司。
1.3 方法
1.3.1 L. helveticus MB2-1源EPS的制备
1.3.1.1 菌种活化
活化:活化时采用质量浓度为120 g/L的乳清培养基,从甘油管中接种L. helveticus MB2-1进行活化,接种量为体积分数4%,活化2 次,37 ℃恒温培养,培养12 h。
发酵液制备:发酵时采用质量浓度为80 g/L的乳清培养基,接种量4%(V/V),培养24 h得到发酵液。
1.3.1.2 L. helveticus MB2-1源EPS的提取
将发酵液离心(15 min,12 000×g,4 ℃),除去菌体和杂质;上清液添加质量浓度为800 g/L的三氯乙酸至终质量浓度40 g/L,静置4~8 h,离心(15 min,12 000×g,4 ℃)除去沉淀蛋白;上清液中加入无水乙醇至终体积分数75%,4 ℃静置12 h,离心取沉淀,去离子水溶解,离心去沉淀;上清液去离子水透析3 d,每8~10 h换水一次,收集透析液。透析液冷冻干燥得到 L. helveticus MB2-1总EPS,储存备用。
1.3.1.3 L. helveticus MB2-1源EPS的纯化
将上述提取的总EPS溶解至质量浓度为10 g/L,使用DEAE-Cellulose 52进行分级纯化,洗脱液分别为纯水、0.10 mol/L NaCl、0.30 mol/L NaCl。收集洗脱液冷冻干燥并储存备用。
1.3.2 L. helveticus MB2-1总EPS和EPS-2体外纯培养 10 株益生菌及2 株有害菌1.3.2.1 培养基的配制
分别称取一定量的上述总EPS和EPS-2纯组分置于试管中,无菌水溶解,0.22 μm过滤;然后分别取代MRS培养基中的葡萄糖,作为唯一碳源添加到无菌培养基中,并使最终质量浓度为20 g/L。其他按正常配制,作为实验组。
1.3.2.2 菌种活化
将供试的10 株益生菌及2 株有害菌接种于MRS培养基中,于37 ℃恒温培养箱中培养48 h,采用多功能酶标仪准确测定细菌浓度。
1.3.2.3 10 株益生菌及两株有害菌生长情况的检测
将活化好的益生菌以2%(V/V)的接种量,分别添加到实验组的无菌培养基中,混匀后移入无菌96 孔板中,每孔300 μL,于37 ℃恒温培养箱中培养48 h。间隔一定时间,采用多功能酶标仪准确测定发酵液OD600nm值,连续测定48 h,每组3 个重复样本。最后以时间为横坐标,OD600nm为纵坐标,绘制微生物生长曲线,拟合曲线方程,计算各株菌的最大生长速率和延滞期。
1.3.3 多糖利用率测定
在以总EPS为唯一碳源的培养基中,以2%(V/V)的接种量接种上述微生物,分别取培养时间为6、12、24、48 h的培养液若干,用去离子水稀释10 倍,用HPLC分析发酵过程中多糖的利用情况。利用率计算公式如下:

式中:A为培养基中初始多糖含量;B为不同反应时间下培养基中多糖含量。
1.3.4 SCFA生成量测定
在以总EPS为唯一碳源的培养基中,以2%(V/V)的接种量接种上述微生物。分别取培养时间为6、12、24、48 h的培养液若干,用抽滤过的磷酸二氢钾稀释10 倍,用HPLC分析不同发酵时间SCFA的变化情况以分析发酵过程中SCFA生成量。
HPLC条件:色谱柱:ODS-AQ,温度22 ℃,波长217 nm,流动相为磷酸二氢钾,流速0.8 mL/min,停止时间20 min。洗脱程序为0~16 min,5%甲醇、95%磷酸二氢钾;16~20 min,50%甲醇、50%磷酸二氢钾。二极管阵列检测器,检测波长210 nm。
以乳酸、甲酸和乙酸为标准品,并绘制其标准曲线。
1.4 数据分析
应用Office Excel进行数据的初步整理和绘图,应用Origin软件求拟合方程,应用SPSS软件进行One-way ANOVA统计分析,P<0.05,差异显著。
2 结果与分析
2.1 L. helveticus MB2-1源EPS的制备
本实验采用三氯乙酸法对去除菌体后的发酵液进行脱蛋白处理,得到的多糖产量为789 mg/L。然后使用DEAE-Cellulose 52进行分级纯化,纯化后得到3 个组分,分别是去离子水洗脱的组分EPS-1、0.1 mol/L和0.3 mol/L NaCl溶液洗脱的组分EPS-2和EPS-3;总EPS的回收率为60.24%,其中EPS-1、EPS-2和EPS-3的占比分别为17.38%、77.95%和4.67%,EPS-2在总EPS中的比例远高于其他两种EPS组分,因此本实验选用总EPS和EPS-2进行后续实验。进一步对EPS组分结构进行鉴定,发现EPS-1、EPS-2、EPS-3分子质量相近,单糖组成相同但比例有所差别,且分支度较高,而且EPS-2中的甘露糖比例最高,远高于其他EPS纯组分[22]。
2.2 10 株益生菌及两株有害菌生长曲线
由图1可知,不同微生物在以总EPS为唯一碳源的培养基和以EPS-2为唯一碳源的培养基中均有不同程度的生长,经历了经典的延滞期、指数生长期以及稳定期。以总EPS和以EPS-2为唯一碳源的培养基中各微生物的生长情况不同;在以总EPS为唯一碳源的培养基中0~5 h的活菌数变化不显著,超过5 h活菌数显著提高,达到最大值后进入稳定期;在以EPS-2为唯一碳源的培养基中0~3 h的活菌数变化不显著,超过3 h活菌数显著提高。在两种培养基中菌体数提高最显著的均为E. faecium MN-1。总体而言,随着时间的延长,不同碳源培养基的菌体数变化趋势相似。10 株有益菌在以总EPS为唯一碳源的培养基中最大活菌数较高,2 株有害菌在以EPS-2为唯一碳源的培养基中最大活菌数较高。说明有益菌在总EPS中生长的效果更好,总EPS在培养过程中更易被有益菌利用[23],相较于EPS-2对两株有害菌的生长存在一定的抑制效果。可能的原因是总EPS中除含有EPS-2外,还含有10.47%的EPS-1。基于已有对EPS各组分结构的研究[22,24-25],发现EPS-1构型中β键较多,较有利于益生菌的利用。这就意味着,源于L. helveticus MB2-1的总EPS相较于EPS-2可以很好的被益生菌吸收利用且在一定程度上抑制了有害菌的生长,总EPS能够更好地对有益有害菌的生长进行调节,更好的发挥其免疫功能。

图 1 总EPS或EPS-2为唯一碳源对微生物生长的影响Fig. 1 Growth curves of different microorganisms with EPS and EPS-2 as sole carbon source
图2 是各微生物的生长曲线,表1是各微生物生长曲线拟合方程,表2和表3是由拟合方程计算出的各微生物在总EPS和EPS-2中的最大比生长速率和延滞期。最大比生长速率是指每小时单位质量的菌体所增加的菌体量,延滞期是指微生物处于一个新的基质环境, 菌体基本不生长,但体内合成代谢活跃,为微生物的大量生长和繁殖准备的时期[26]。计算方法是由表1中的拟合方程求二阶导数为0时的时间t,此时的t是达最大比生长速率的时间lag,再将t带入一阶导数方程,此时的函数值即为μmax。由表2可以看出,10 种益生菌在总EPS和EPS-2中μmax和lag是不同的,L. plantarumM7-1、L. delbrueckiissp.bulgaricusWG-1、L. plantarum70810和L. plantarum17-1五株菌,在EPS-2中的μmax较总EPS中大,且lag更小;L. fermentumz-15、L. lactisLZ-R-12、L. plantarumB1-6、L. paracaseiS-NA三株菌在总EPS中的μmax较EPS-2中大,但lag较EPS-2中大;L. delbrueckiissp.bulgaricusSRFM-1在EPS-2中μmax较大,但lag较总EPS中大;E. faeciumMN-1在总EPS中μmax较EPS-2中大,且lag较小。10 株益生菌中,除L. delbrueckiissp.bulgaricusSRFM-1和E. faeciumMN-1之外其余8 株益生菌在EPS-2中生长的延滞期都较在总EPS中生长的延滞期短,即在总EPS中微生物所需的适应时间和生长繁殖的准备时间更长。表3中2 株大肠杆菌在总EPS中的延滞期要明显高于EPS-2中,在总EPS及EPS-2的最大比生长速率也远低于在葡萄糖中的最大比生长速率。EPS的这种能被益生菌利用,并抑制有害菌生长的调节作用,证明EPS是一种潜在的益生元。
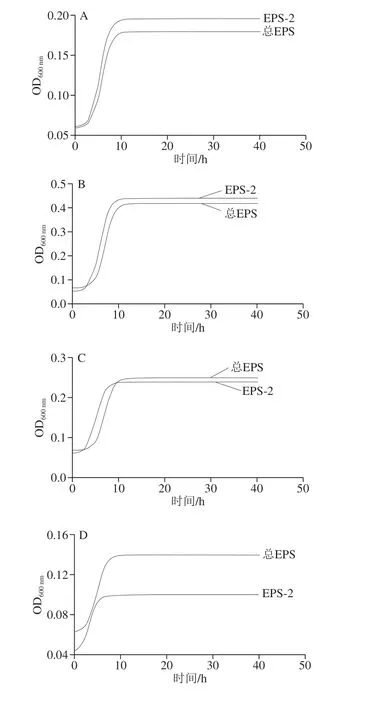
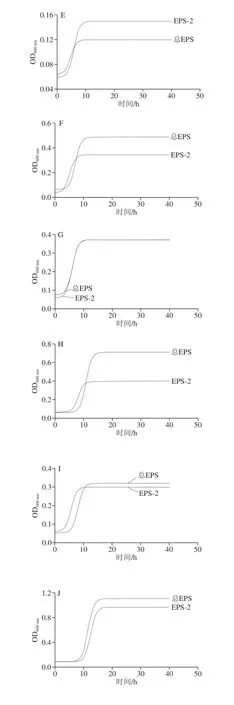
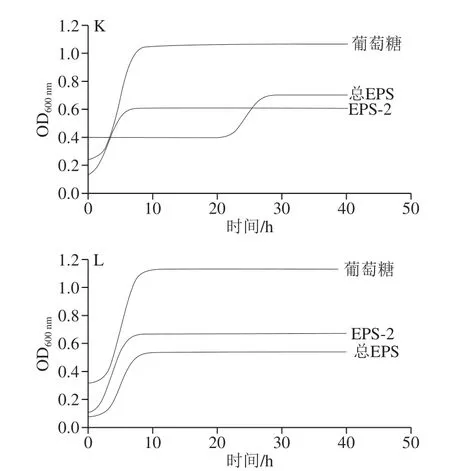
图 2 微生物在总EPS和EPS-2中的拟合生长曲线Fig. 2 Fitting growth curves of different microorganisms with EPS and EPS-2 as sole carbon source

表 1 EPS and EPS-2中各益生菌的拟合生长方程Table 1 Fitting growth kinetic equations of different microorganisms with EPS and EPS-2 as sole carbon source

表 2 葡萄糖中有害菌的拟合生长方程Table 2 Fitting growth kinetic equations of different microorganisms in normal glucose culture
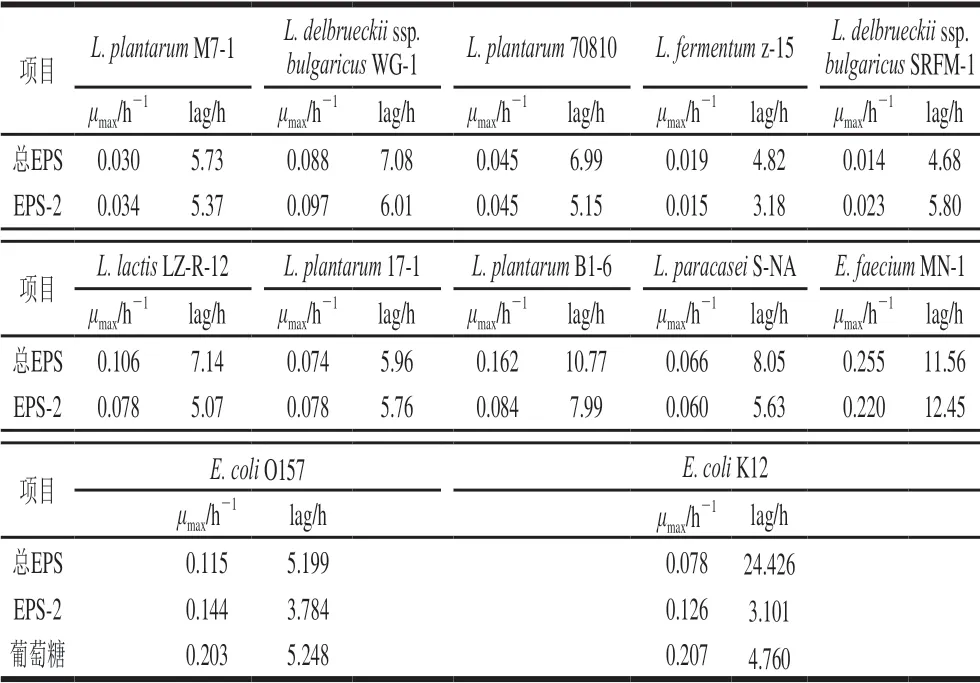
表 3 EPS和EPS-2中各益生菌生长曲线的μmax和lag值Table 3 μmax and lag of different grwoth kinetic equations
2.3 多糖利用情况
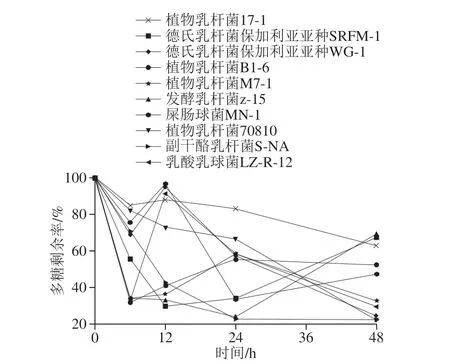
图 3 不同菌种对多糖利用情况的比较Fig. 3 Comparison of polysaccharide utilization among different strains
由图3可知,随着培养时间的延长,培养基中多糖含量明显降低,10 株益生菌对L. helveticus MB2-1源EPS的利用率不一,但总的变化趋势明显,即随培养时间的延长,多糖含量减少,多糖利用率增加。培养至第48小时多糖利用率最大的是L. paracasei S-NA,利用率达到77.74%,培养至第48小时多糖利用率最小的是L. plantarum 17-1,利用率达37.03%。说明EPS能够被各微生物充分利用,是各微生物生长过程中的良好碳源,但不同菌株对于 L. helveticus MB2-1源EPS的利用情况不一,这可能与不同菌株产生的分解胞外多糖化学键的酶种类和数量不同有关。
2.4 SCFA生成
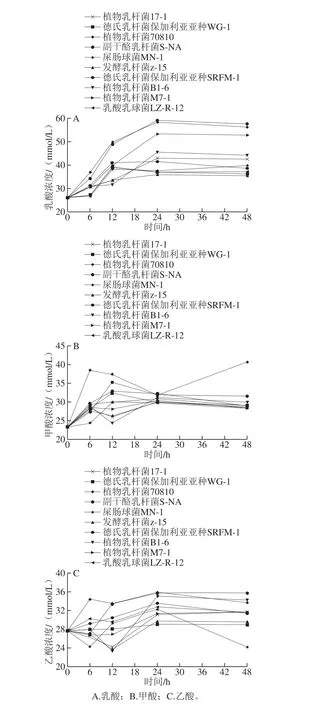
图 4 培养时间延长对SCFA产量的影响Fig. 4 Time courses of the production of short chain fatty acids by different microorganisms
由图4可知,随着培养时间的延长,不同微生物产生的SCFA量均有不同程度的提高[27]。含量提高最多、变化最明显的是乳酸,其原因是所研究的微生物都是乳酸菌,其发酵产物主要为乳酸。其中生成乳酸含量最高的是L. paracasei S-NA,在培养至第48小时乳酸浓度达到57.6 mmol/L,较发酵之初的26.1 mmol/L提高了121.70%,乳酸浓度提高最不明显的L. fermentum z-15也提高了35.60%,达到35.4 mmol/L。甲酸变化最明显的是 L. plantarum 70810,含量从23.4 mmol/L提高到40.8 mmol/L, 提高了74.40%。乙酸变化最明显的是L. paracasei S-NA,浓度从27.7 mmol/L提高到35.8 mmol/L,提高了29.20%。表明在以总EPS为唯一碳源的培养基中,10 株益生菌均具有良好的生成SCFA的性能。L. helveticus MB2-1源EPS与传统的益生元菊糖类似,经益生菌发酵能产生大量短链脂肪酸,短链脂肪酸能够降低肠道内环境的pH值,具有刺激肠道蠕动和较强的维护肠道功能、形态的作用,对大肠杆菌等致病菌的正常生长可以抑制,兼具治疗作用[28-30]。因此L. helveticus MB2-1源EPS通过促进乳酸菌SCFA的生成可以起到良好的益生功能。
3 结 论
L. helveticus MB2-1不同多糖组分对乳杆菌增殖过程中生长密度的变化、多糖的利用率和SCFA的生成量影响结果表明,总EPS和EPS-2能够被10 种益生菌利用,为其提供生长繁殖的物质基础,并相较于普通碳源培养基一定程度上抑制2 株有害菌的生长。在以总EPS为唯一碳源条件下,10 种益生菌能够生成以乳酸为主,包含甲酸和乙酸的SCFA。L. helveticus MB2-1源EPS具有良好的益生功能,且含总EPS的益生功能较EPS-2的益生功能更为显著,因此在生产应用中,未经过纯化分离的总EPS的应用范围比分离纯化后的纯组分更广,作用效果更好,同时有效地降低了成本。该研究为今后更深入地研究 L. helveticus MB2-1源EPS及其不同组分在人体内发挥益生作用的机制提供了参考,同时也为EPS作为一种既赋予发酵乳制品特有风味和质构又强化产品益生功能特性的食品添加剂奠定了基础。
