乳酸菌复配对红肠发酵中N-亚硝胺 生成的抑制作用
2020-04-02李秀明仇泓博吴晨燕熊凤娇刘静静马俪珍
李秀明,杨 华,王 洋,仇泓博,吴晨燕,熊凤娇,刘静静,马俪珍,
(1.天津农学院食品科学与生物工程学院,天津 300384;2.天津农学院动物科学与动物医学学院,天津 300384;3.天津农学院水产学院,天津 300384)
红肠是我国的传统肉制品,味道鲜嫩脆弹,色泽红艳,受人喜爱,在东北地区具有广阔的消费市场。在红肠加工过程中常添加亚硝酸盐,可起到发色、抑菌、抗氧化、提高风味的作用,但成品中残留的亚硝酸盐有时会超标(30 mg/kg),对人体造成危害[1]。亚硝酸根在酸性条件(如呈微酸性的食品或人体胃酸环境)会生成一些不稳定的氮氧化物[2],和二级胺类物质结合生成具有致癌、致畸和致突变性的N-亚硝胺[3]。此外,制作红肠的原料肉中富含蛋白质、各种氨基酸,经蛋白酶和氨基酸脱羧酶作用会生成某些胺类物质[4],亦为N-亚硝胺的形成提供了充足的前体物。因此在红肠制作过程中如何控制产品中N-亚硝胺生成量,对于食品安全和品质控制具有十分重要的意义。
目前对于如何阻断腌肉制品中N-亚硝胺的形成,主要从原料选择[5]、加工方式[6]、外源添加物(抗坏血酸钠、VE、茶多酚等)等方面进行控制[7-8]。近年来,对益生菌的研究相继成为关注焦点。有研究表明,微生物发酵如植物乳杆菌、副干酪乳杆菌、戊糖片球菌等[9-10]具有降低N-亚硝胺前体物亚硝酸盐的能力,部分乳酸菌如弯曲乳杆菌、戊糖乳杆菌等[11-13]可直接降解N-亚硝胺。因此利用微生物发酵技术(特别是益生菌发酵)降低肉制品中N-亚硝胺的形成是值得深入探究的课题。然而,目前发酵剂种类和不同的发酵时间对肉制品中N-亚硝胺的抑制效果方面的研究报道还较少。
本实验将发酵技术引入传统红肠的加工工艺中,在肉馅中分别接种4 种常应用于发酵肉制品的商业复合乳酸菌发酵剂和经筛选得到的3 株可降低发酵风干肠中N-亚硝胺的乳酸菌单菌,发酵不同的时间,经过熟制得到发酵红肠新产品。通过对产品的感官评定、pH值、乳酸菌数、亚硝酸盐、生物胺和N-亚硝胺等相关指标的测定,同时与空白对照组对比,分析乳酸菌发酵剂及发酵时间对发酵红肠安全品质的影响,也为乳酸菌发酵剂在食品中的应用提供了理论参考依据。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉、猪肥膘 天津市康宁肉制品有限公司; 淀粉、大蒜、鸡蛋 天津市红旗农贸市场;SHI-59(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、WBX-43(肉葡萄球菌+木糖葡萄球菌)、PRO-MIX5(木糖葡萄球菌+清酒乳杆菌+类植物乳杆菌)、VBM-60(木糖葡萄球菌+肉葡萄球菌+戊糖片球菌+乳酸片球菌) 意大利萨科公司;弯曲乳杆菌(Lactobacillus curvatus,Lc)、戊糖乳杆菌(L. pentosus,Lp)和清酒乳杆菌 (L. sake,Ls)由东北农业大学教育部乳品科学重点实验室提供。
MRS固体培养基 北京索莱宝科技有限公司;乙腈、二氯甲烷(色谱纯)、氯化钠、无水硫酸钠、硼酸 天津市风船化学试剂科技有限公司;高氯酸、丙酮、丹磺酰氯、硝酸钠和亚硝酸钠标品 国药集团化学试剂有限公司;8 种生物胺(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、精胺及亚精胺)标品、9 种N-亚硝胺标品: N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)、N-甲基乙基亚硝胺(N-nitrosomethylethylamine,NMEA)、N-二丁基亚硝胺(N-nitrosodibutylamide,NDBA)、N-二丙基亚硝胺(N-nitrosodipropylamine,NDPA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基吗啉(N-nitrosomorpholine,NMOR)、N-亚硝基二苯胺(N-nitrosodiphenylamine,NDPheA) 美国Sigma公司。
1.2 仪器与设备
7890A气相色谱仪(配备氮磷检测器)、1200高效液相色谱仪(配备紫外吸收检测器) 美国安捷伦公司;P/ACE MDQ毛细管电泳仪(配备紫外检测器) 美国贝克曼库尔勒公司;PB-10酸度计 德国赛多利斯科学仪器有限公司;BPX-82恒温恒湿培养箱 上海博讯仪器设备有限公司;BJRJ-82绞肉机、BVBJ-30F真空搅拌机、BYXX-50烟熏炉 浙江嘉兴艾博实业有限公司。
1.3 方法
1.3.1 发酵红肠的加工方法
各实验组红肠的工艺流程:原料选择→腌制→拌馅(接种)→灌肠→发酵→干燥→烟熏→蒸煮→烘烤→冷却→成品。
腌制:称取用绞肉机绞碎的猪后腿肉1 600 g,添加料酒40 g、食盐56 g、葡萄糖8 g、白糖8 g、复合磷酸盐8 g、抗坏血酸钠1.1 g、亚硝酸钠0.3 g、水80 mL,于4 ℃冰箱中腌制20 h。
拌馅灌肠:向腌好的肉中加入肥膘丁400 g、淀粉160 g、蒜泥40 g、白胡椒粉4.8 g、鸡蛋160 g、冰水320 g,在此步骤接种不同种类的乳酸菌发酵剂,再用真空搅拌机充分拌匀后灌肠。
发酵:于35 ℃,80%相对湿度条件下发酵。
熟制:将灌好的肠经温水漂洗、排气后于烟熏炉中熟制,熟制参数为:干燥70 ℃ 60 min、烟熏85 ℃ 60 min、蒸煮85 ℃ 60 min、烘烤75 ℃ 60 min。
1.3.2 实验设计方案
本实验设计共分为8 组:空白对照(control check,CK)组,不接种发酵剂。其余7 组分别接种4 种商业复合发酵剂(SHI-59组、WBX-43组、PRO-MIX5组和VBM-60组)和3 株单菌(Lc组、Lp组和Ls组)。
将以上不同菌株在拌馅时以107CFU/g添加量加入,分别发酵12、16、20、24 h,在不同的发酵时间点取样测定样品的乳酸菌数变化,并将发酵不同时间点的样品进行熟制,冷却后得到成品,取样进行感官评定、pH值、亚硝酸盐、硝酸盐、生物胺、N-亚硝胺的测定。CK组不接菌不发酵,仅测定熟制后成品的各项指标。
1.3.3 指标测定方法
1.3.3.1 感官评定方法

表 1 发酵红肠成品的感官评定标准Table 1 Criteria for sensory evaluation of fermented sausage products
选择10 位经培训合格的感官评定人员先对4 个不同发酵时间点的各组红肠进行初步筛选,排除口感上无法接受的组别,再对剩余各组发酵红肠成品按照表1标准进行感官评定。
1.3.3.2 乳酸菌数的测定
参照GB 4789.35—2016《食品微生物学检验 乳酸菌检验》方法。
1.3.3.3 pH值的测定
参照GB 5009.237—2016《食品pH值的测定》方法。
1.3.3.4 亚硝酸钠和硝酸钠的测定
使用毛细管电泳法[14]同时测定样品中硝酸盐和亚硝酸盐含量。
1.3.3.5 生物胺的测定
参照杜智慧[15]的方法测定样品中的8 种生物胺:色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、精胺及亚精胺。
1.3.3.6 N-亚硝胺的测定
参照GB 5009.26—2016《食品中N-亚硝胺类化合物的测定》测定样品中的9 种N-亚硝胺(NDMA、NDEA、NMEA、NDBA、NDPA、NPIP、NPYR、NMOR、NDPheA),同时用外标法分析定量。
1.3.4 数据分析
2 结果与分析
2.1 发酵12 h的7 组红肠成品与CK组感官评价结果
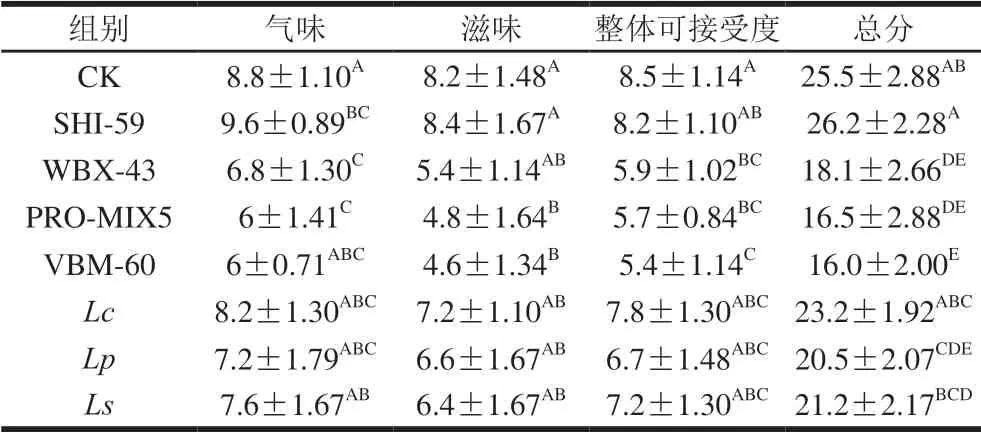
表 2 7 组发酵红肠和CK组的感官评价结果Table 2 Sensory evaluation results of control and experimental fermented sausages
发酵红肠加工中,经接种7 种发酵剂,并发酵不同时间,发现随着发酵时间的延长(12 h→24 h),发酵红肠的气味及滋味明显变差,发酵16 h及以上产生明显的酸味且不被感官评价者所接受,因此本研究仅对发酵至第12小时的不同发酵红肠产品进行感官评定。如表2所示, 8 组红肠产品感官评价由好到差依次为:SHI-59>CK> Lc>Ls>Lp>WBX-43>PRO-MIX5>VBM-60。其中SHI-59组发酵红肠感官更容易被人接受,该组发酵红肠口感微酸、有发酵香味、无异味、切片性良好、发色正常、滋味较好,接受度较高。VBM-60组则口感偏酸,发酵异味感较重,接受度较低。造成不同组口感区别的原因可能是由于不同乳酸菌发酵剂活力存在差异,虽在同一发酵时间,但不同组发酵程度不同;且发酵剂菌种组成不同,可能是由于发酵产生的代谢产物如香味、滋味等成分[16]存在较大差异。
2.2 不同乳酸菌复配组在发酵的不同时间点乳酸菌数动态变化
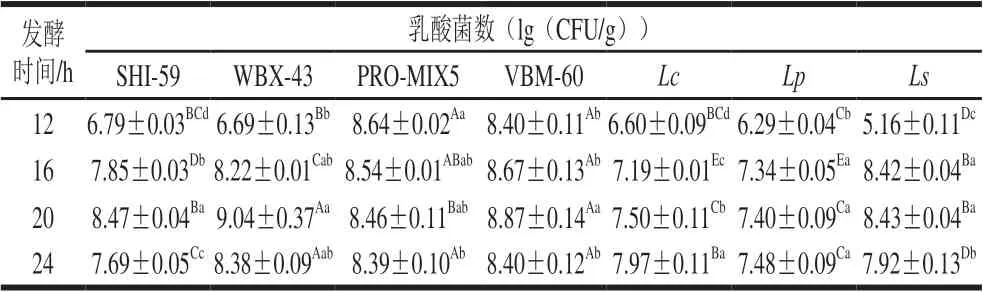
表 3 各组样品在不同发酵时间的乳酸菌数变化Table 3 Changes in lactic acid bacterial number with fermentation time
如表3所示,在发酵至第12小时,PRO-MIX5和VBM-60两组的乳酸菌总数分别达到8.64(lg(CFU/g)) 和8.40(lg(CFU/g)),菌活性较强,而其他各组乳酸菌数均在5.16~6.79(lg(CFU/g))范围。随着发酵时间延长,各组乳酸菌数整体呈上升趋势,但SHI-59组、VBM-60组、Ls组在发酵20 h后乳酸菌数有所下降,可能是由于在发酵后期,乳酸菌进入衰亡期。Lc和Lp组在发酵12~24 h期间乳酸菌数呈缓慢上升趋势,且均显著低于其他组(P<0.05),说明这两组发酵剂活力低或不适宜在这一体系中生长。不同乳酸菌发酵剂活力不同,进入衰亡期的时间以及最大菌活力也有所差异[17],如WBX-43组在发酵至第20小时乳酸菌数已达到9.04(lg(CFU/g)), 显著高于其他各组(P<0.05)。由此可见,不同的乳酸菌发酵剂具有不同的活力,其在不同发酵时间菌数的增长速度以及生长特性亦有较大差异,因此筛选在红肠肉馅体系中适宜生长的发酵剂显得尤为重要。
2.3 不同乳酸菌复配组红肠成品的pH值随不同发酵时间的变化
如图1所示,各组pH值均随着发酵时间的延长呈降低趋势,其中PRO-MIX5和VBM-60组的pH值显著低于其他5 组(P<0.05),在发酵至第12小时,pH值分别为5.24和5.34,与表3中乳酸菌数变化趋势一致,这是由于这两组乳酸菌数增长较快,生成的乳酸量大。本实验测得CK组pH值为6.4,WBX-43、SHI-59、Lc、Lp、Ls在发酵至第12小时pH值差异不显著,且均略低于CK组,当发酵至第16小时,5 组之间的pH值显示出显著差异 (P<0.05),这种趋势一直保持到发酵24 h,此时5 组pH值下降程度由大到小顺序依次为:WBX-43>Ls>SHI-59>Lc>Lp,这与乳酸菌发酵剂的产酸能力和活力有关[18]。

图 1 7 组发酵红肠的pH值随不同发酵时间的变化Fig. 1 Changes in pH during sausage fermentation
2.4 不同乳酸菌复配组红肠成品的硝酸钠和亚硝酸钠随不同发酵时间的变化
7 组发酵红肠的硝酸钠和亚硝酸钠随不同发酵时间的变化见图2。CK组亚硝酸钠含量为41.63 mg/kg, 从图2A可以看出,PRO-MIX5和VBM-60组在第12小时亚硝酸钠含量明显低于其他5 组,其含量分别为 7.58 mg/kg和11.01 mg/kg,且随发酵时间延长,亚硝酸钠残留量变化不显著(P>0.05),这是由于这两组发酵剂在发酵初期菌活力已呈较高状态,产生了大量乳酸和亚硝酸盐还原酶降解亚硝酸钠[19-20],而在发酵后期作用不显著;其他5 组亚硝酸钠残留量随发酵时间延长整体呈不同程度的下降趋势。张庆芳等[21]研究报道,当pH>4.5时,亚硝酸盐主要以酶降解为主,在整个发酵过程中,各组pH值均在4.5以上,说明各组在发酵过程中对亚硝酸盐的降解主要是亚硝酸盐还原酶的作用[22],且偏酸性的环境也为降解率做出了一定的贡献。
硝酸盐对人体无直接毒性,国标中规定西式火腿中硝酸盐和亚硝酸盐的最大使用量分别为0.5 g/kg和 0.15 g/kg,限定亚硝酸盐残留量分别为30 mg/kg和70 mg/kg, 但对硝酸盐残留量并未限定[23]。但其会在口腔或胃液中硝酸盐还原菌作用下转化为亚硝酸盐,表现为亚硝酸盐的作用毒性[24]。若产品中硝酸盐含量较多,在贮存期间一些腐败菌对硝酸盐还原,将会使肉制品存在潜在的安全隐患。本实验测得CK组中硝酸钠含量为161.00 mg/kg, 由图2B可以看出,随着发酵时间的延长,各组发酵红肠中硝酸盐含量呈降低趋势,说明接菌发酵后可降低发酵红肠中硝酸盐含量,但整体测得的含量相对较高,均在90 mg/kg以上。其中VBM-60组在发酵12 h即能够较好地降低硝酸盐含量,这可能是由于该组发酵菌活力相对较强,产生了一些可降解硝酸盐的还原酶,被菌体本身生长所利用,亦有可能被转化为含氮物质与胺类结合形成N-亚硝胺。
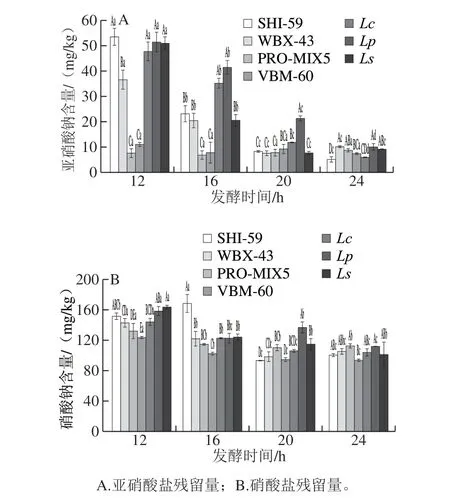
图 2 7 组发酵红肠发酵不同时间亚硝酸钠和硝酸钠含量的变化Fig. 2 Changes in sodium nitrite and sodium nitrate contents during sausage fermentation
2.5 不同乳酸菌复配组红肠成品的生物胺含量随不同发酵时间的变化
生物胺是一类脂肪族、芳香族或杂环类低分子含氮化合物,在发酵香肠中生物胺的含量与原料肉的品质、发酵剂种类、发酵温度、pH值、含盐量、生物胺氧化酶、添加剂等因素有关[25],它主要是由于微生物作用蛋白质使其降解为氨基酸,再由氨基酸脱羧反应生成,在调节核酸和蛋白质的合成、生物膜稳定性以及生长发育方面均有着重要作用[26],但过量摄入生物胺则对身体有极大危害。目前仅有部分国家对食品中生物胺制定了限量标准,如欧盟规定食品中组胺和酪胺含量分别不得超过100 mg/kg和100~800 mg/kg,国内仅在上海地方标准中规定发酵肉制品组胺不得超过100 mg/kg[27]。
由表4可以看出,随着发酵时间的延长,各组发酵红肠中8 种生物胺含量在逐渐增多,这是由于随着乳酸菌数增加,脱羧酶活性增强,使得蛋白质降解产生了生物胺;且生物胺作为细胞生长过程中重要的物质,总生物胺也会随乳酸菌数增长而增多。实验发现,各组发酵红肠在不同发酵时间均检测出腐胺和精胺,发酵12~20 h,各组红肠中所产生的腐胺和精胺含量呈缓慢增长趋势,而在20~24 h之间变化不显著(P>0.05)。在发酵至第12小时,Lc和Ls组两组除腐胺和精胺外,还检测出尸胺和酪胺,腐胺和尸胺作为一种二胺,能够和亚硝酸盐反应生成强致癌物N-亚硝胺,常见的生物胺中以组胺毒性最大,其次是酪胺[28],因此相比之下用Lc和Ls发酵的红肠产品安全品质相对较低。
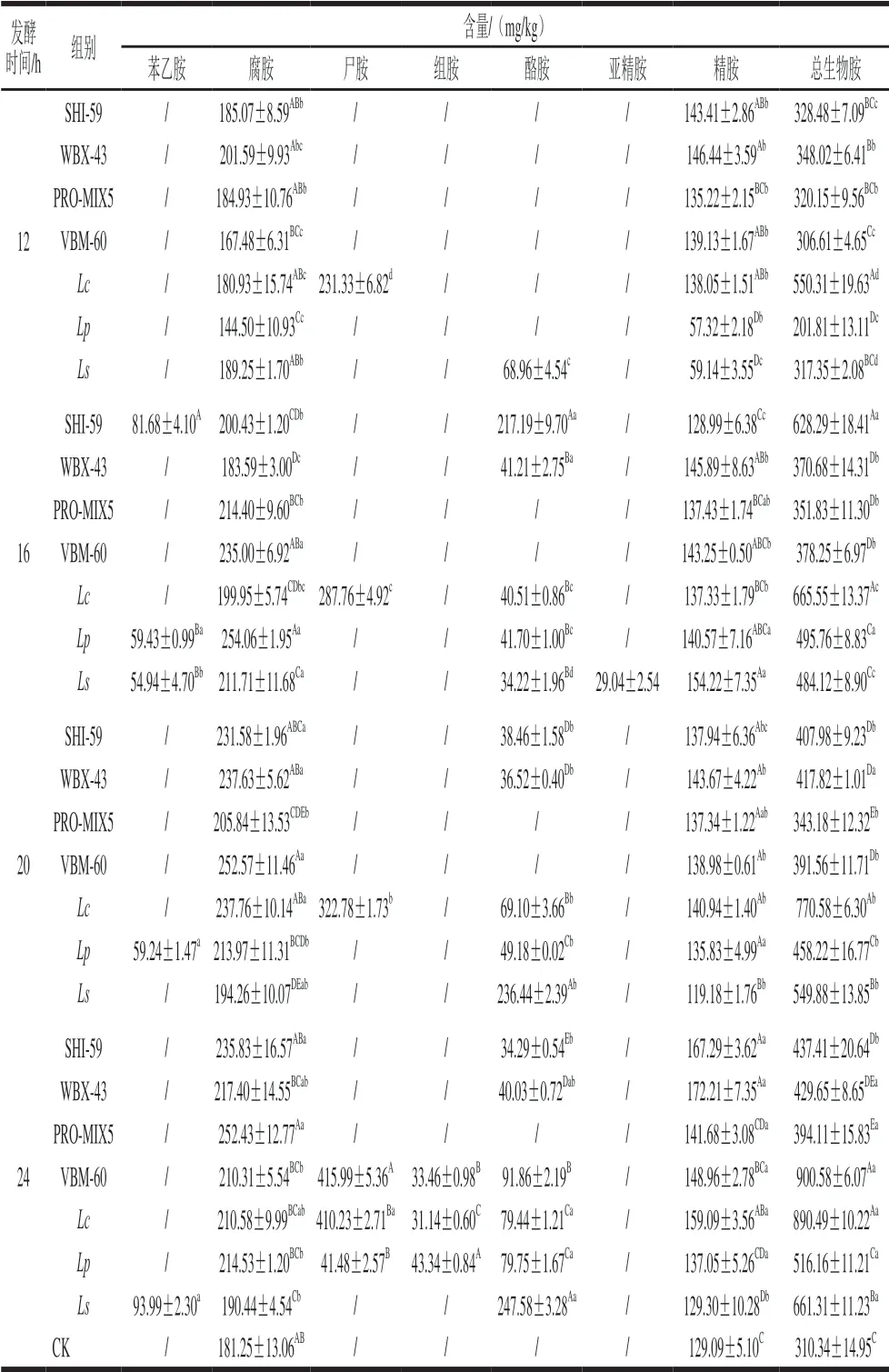
表 4 7 组发酵红肠的生物胺含量随不同发酵时间的变化Table 4 Changes in biogenic amines contents during sausage fermentation
随着发酵时间延长,脱羧酶活性不断增强,发酵红肠中生物胺种类逐渐增多,且含量明显增加,如苯乙胺、尸胺、酪胺。Lc组尸胺含量随着发酵时间的延长呈明显上升趋势,且由于各组乳酸菌发酵剂的特性不同,其他各组也在不同发酵时间产生了一定量的酪胺。值得注意的是在发酵至第24小时,VBM-60、Lc和Lp组中产生了组胺。虽然其含量并未超过一些标准规定,但是此时各组发酵红肠生物胺含量均较高。因此相比之下发酵时间以12 h为好,此时Lp组腐胺(144.50 mg/kg)和精胺含量(57.32 mg/kg)、Ls组精胺含量(59.14 mg/kg)显著低于CK组(腐胺:181.25 mg/kg;精胺:129.09 mg/kg) (P<0.05),其中Lp组总生物胺含量(201.81 mg/kg)显著低于其他各组(P<0.05),结合乳酸菌数变化,这可能是由于Lp和Ls菌活力弱,所产生的蛋白酶以及氨基酸脱羧酶活力低的缘故。相较于CK组,SHI-59、 PRO-MIX5、VBM-60、Ls组与CK组8 种生物胺的总含量之间差异不显著(P>0.05)。
2.6 不同乳酸菌复配组红肠成品的N-亚硝胺含量随不同发酵时间的变化
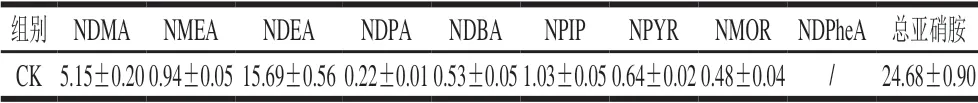
表 5 CK组红肠9 种N-亚硝胺含量Table 5 Contents of 9 N-nitrosamines in control group μg/kg
对照CK组红肠中9 种N-亚硝胺含量如表5所示,7 组发酵红肠中9 种N-亚硝胺总量随发酵时间的变化如表6所示。

表 6 7 组发酵红肠发酵不同时间9 种N-亚硝胺总量的变化Table 6 Changes in total amount of N-nitrosamines during sausage fermentation μg/kg
由表6可以看出,随着发酵时间延长,除PRO-MIX5和Lc组外,各组红肠所含N-亚硝胺总量呈逐渐降低趋势,这可能是由于在发酵过程中乳酸菌大量增长,产生一些可降解N-亚硝胺的酶系[29],或菌体本身对一些 N-亚硝胺具有吸附作用[30],降解或吸附了发酵前期产生的部分N-亚硝胺。发酵至第12小时,PRO-MIX5和Lc组中 N-亚硝胺总量显著低于CK组(表5),经短时间发酵即可起到降低产品中N-亚硝胺的作用。在随后发酵16~24 h范围时,除发酵至第16小时的SHI-59、PRO-MIX5、Lp组和发酵至第20小时的PRO-MIX5组外,其余各时间点的各组发酵红肠所含N-亚硝胺总量均显著低于CK组 (P<0.05);特别是当发酵至第24小时,各组N-亚硝胺总量均显著下降,抑制效果十分显著。
目前国标仅限量肉制品中NDMA含量为3 μg/kg[31],本实验中CK组中NDMA含量为5.15 μg/kg(表5),超过了国家限量标准。经接菌发酵后,部分乳酸菌发酵剂可抑制NDMA的形成,且发酵剂的组成不同,活性也有差异,因此在不同发酵时间NDMA含量动态变化趋势区别较大。由图3可以看出,WBX-43、Lp组中NDMA含量随着发酵时间的延长呈显著降低趋势,Ls组在发酵12~20 h,NDMA含量呈显著降低趋势,但在发酵后期至第24小时,NDMA含量有所升高,可能是由于在发酵后期NDMA蓄积;VBM-60组在发酵过程中NDMA含量相较于其他发酵组整体较低;Lc组则除发酵至第20小时有所升高,其他发酵时间点均较低,说明在应用该种发酵剂降解NDMA时,需控制一定的发酵时间才可达到较好的效果;SHI-59、PRO-MIX5两组中的NDMA则呈先增长后降低的趋势。因此对于抑制NDMA效果来看,PROMIX5、VBM-60和Lc组相对于其他各组可在较短发酵时间内降低NDMA形成,分别使NDMA含量降低至2.91、0.77 、1.08 μg/kg。
对于除NDMA以外的其他8 种N-亚硝胺,目前无国标规定限量。相比CK组,如图3B、C所示,除发酵至第12、16小时的VBM-60组和发酵至第16小时的SHI-59组外,各发酵组在各个发酵时间对NMEA均有抑制效果;对于NDEA,除发酵至第12小时的SHI-59和Ls组,其余各发酵时间的各组均能显著降低NDEA含量。如图3E所示,在发酵至第24小时,7 种乳酸菌发酵剂发酵的红肠中NDBA均显著低于CK组,这说明长时间的发酵可降低NDBA的含量;如图3F所示,对于NPIP,SHI-59组对其抑制呈现较强规律性,随发酵时间的延长,在16~24 h,逐渐降低了该组发酵红肠中的NPIP含量;而对于NPYR(图3G)和NDPheA(图3I),各个发酵组在不同发酵时间的含量并未呈现较强规律性。相反,如图3D、H所示,接种乳酸菌发酵后对NDPA、NMOR的生成并未起到抑制效果,反而具有一定的促进作用。
结合以上分析结果,虽然整体呈现发酵时间越长,N-亚硝胺含量越低的趋势,其中PRO-MIX5和Lc两种发酵剂在短时间内即可起到显著降低9 种N-亚硝胺总量的效果;对于国标中有限定标准的NDMA,PRO-MIX5、Lc和Lp三种发酵剂在发酵至第12小时已达到较好的抑制效果,应用效果好。
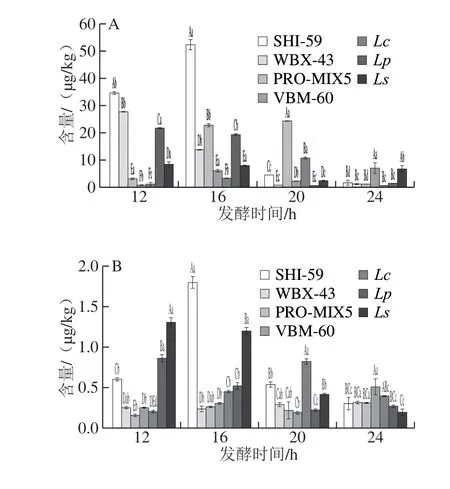
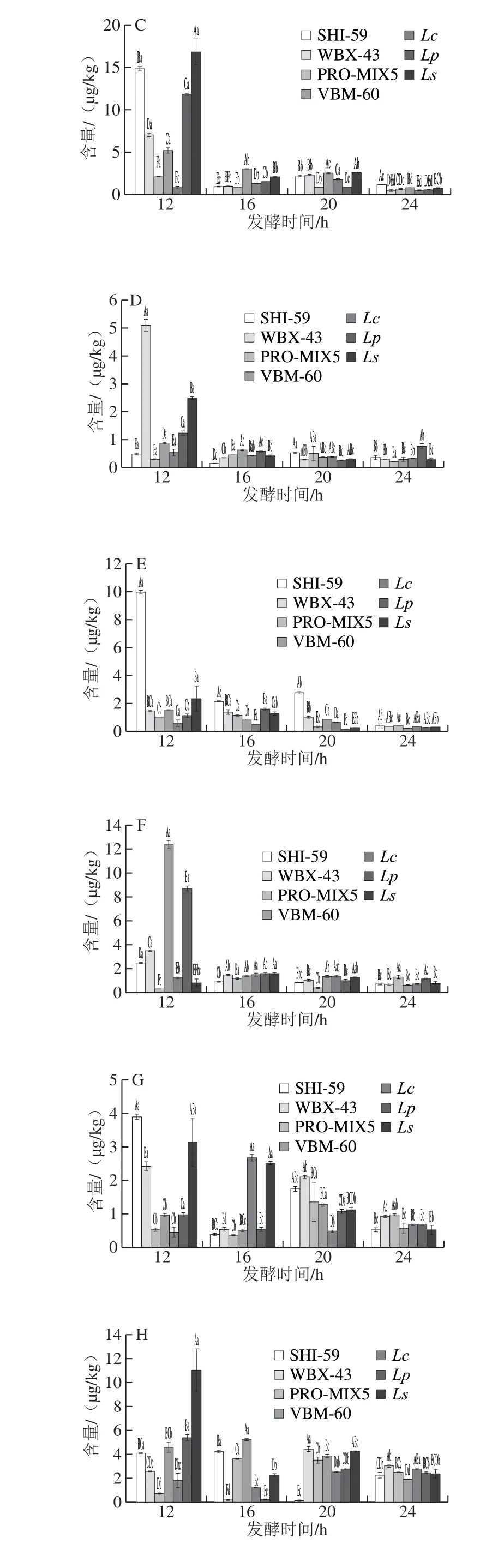
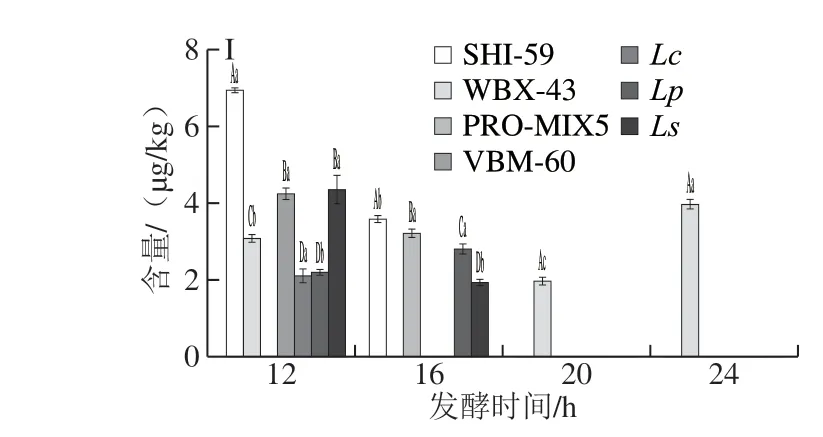
图 3 7 组发酵红肠发酵不同时间9 种N-亚硝胺含量的变化Fig. 3 Changes in contents of nine N-nitrosamines during sausage fermentation
3 讨 论
根据以上各项指标结果进行综合分析,随着发酵时间的延长,各组乳酸菌数以不同速度增长,8 种生物胺含量逐渐升高,pH值、亚硝酸盐和硝酸盐残留量则呈降低趋势,其中硝酸盐残留量整体在90~169 mg/kg之间,硝酸盐主要表现为亚硝酸盐毒性,但会受到口腔中的硝酸盐还原酶和病理状态下胃液中的硝酸盐还原菌作用转化为亚硝酸盐[32],本研究经乳酸菌发酵后,硝酸盐残留量适度下降,一定程度地提高了产品安全性。但有所不同的是,有研究表明,亚硝酸根离子在酸性环境中更容易产生一些N2O3等氮氧化物和胺类物质结合生成N-亚 硝胺[33-34],而本研究发现各发酵组红肠中9 种N-亚硝胺含量随着发酵时间延长均呈降低趋势,这可能是由于乳酸菌能够产生一些抑制N-亚硝胺形成的物质,如 肖亚庆等[35]发现戊糖乳杆菌中位于细胞壁最外层的表层蛋白具有降解NDMA和NDEA的效果,随着乳酸菌数增长,这些可抑制N-亚硝胺的物质不断蓄积,从而使得所得发酵红肠产品中N-亚硝胺含量降低。但发酵时间越长,会使得一些生物胺含量增加,过量时会导致呕吐、呼吸困难等症状[36];且对于本无发酵工艺的红肠来说,长时间的发酵对风味破坏严重,口感偏酸,不能够被品评者接受,因此选择适度发酵12 h为佳。
本研究所筛选的7 种乳酸菌发酵剂中,其中 PRO-MIX5和VBM-60两种乳酸菌活力最强,产酸能力、亚硝酸盐的降解速度均显著优于其他各组,两种发酵剂在适度发酵至第12小时即可显著降低9 种N-亚硝胺含量,且PRO-MIX5组中8 种生物胺总量与CK组差异不显著。综合来看,PRO-MIX5提高红肠产品安全品质应用效果较好。对于增加发酵技术的红肠的口感,还需进行一定的消费引导,或在后期进一步深入研究,提取乳酸菌增长所产生的能够抑制N-亚硝胺的物质,直接添加至肉馅中,以达到既提高产品品质又不影响产品风味的效果,甚至可应用于其他肉制品中,将会有更实际的应用价值。
4 结 论
本研究结果表明,使用PRO-MIX5乳酸菌发酵剂接种至红肠肉馅中,经发酵12 h,乳酸菌数达到 8.64(lg(CFU/g)),可显著降低9 种N-亚硝胺总量至8.68 μg/kg,降低NDMA至3.07 μg/kg;红肠pH值为5.24;显著降低亚硝酸盐残留量至7.58 mg/kg,硝酸盐含量为141.84 mg/kg;8 种生物胺总量为320.15 mg/kg,且与CK组差异不显著。该种发酵剂相比其他6 种能够显著提高发酵红肠的安全品质,也为制作新型发酵红肠提供了理论指导。
