新疆喀什地区维吾尔族婴幼儿肠道双歧杆菌 遗传差异及益生特性分析
2020-04-02魏小晶周桓丞靳亚梅蔡静静倪永清
魏小晶,周桓丞,靳亚梅,蔡静静,倪永清,张 艳
(石河子大学食品学院,新疆 石河子 832003)
婴幼儿期是肠道菌群定植的关键时期,婴幼儿肠道微生物群的发育和成熟是一个动态的、非随机的过程[1],此过程中肠道菌群的建立影响着婴幼儿免疫系统的构建及未来成长过程中疾病发生的风险,在母乳喂养儿肠道内大量存在的双歧杆菌(Bifidobacterium)为婴幼儿胃肠道健康提供独特的保护作用[2]。双歧杆菌是存在于人体和动物胃肠道的一种革兰氏阳性、专性厌氧、呈多形态的杆菌[3]。最初于1899年被Tissier从母乳喂养儿的粪便中分离而来,进一步研究发现该双歧杆菌具有治疗婴幼儿肠道腹泻、促进健康的作用[4]。后来有研究显示双歧杆菌是人体与微生物相互作用中的关键共生体,其在维持人体胃肠道健康方面扮演着至关重要的角色[5]。定植于人体肠道中的双歧杆菌具有抑制病原微生物增殖、抗过敏、抗肿瘤、治疗乳糖不耐症、调节肠道黏膜屏障功能、免疫功能及控制内毒血症等作用[6-8]。
近年来,国内外学者一致认可双歧杆菌对人体的益生作用[9],其作为益生菌筛选的首要菌种,必须具备一定的特性,如能够对胃酸、胆盐有抗性,能在肠道中定植以及对宿主具有安全性[10]。Delcaru等[11]研究证实双歧杆菌对大肠埃希菌、李斯特菌和芽孢杆菌等有拮抗作用;也有研究表明婴儿双歧杆菌抑制病原菌的生长可能是产生的非有机酸类的广谱抑菌物质发挥作用[12];1984年Anand等[13]首次发现由两歧双歧杆菌NCDC 1452产生的拮抗性物质双歧菌素;随后Cheikhyoussef等[14]分别从婴儿双歧杆菌BCRC 14602分离得到双歧菌素,从长双歧杆菌DJO10A中分离得到羊毛硫细菌素。随着对双歧杆菌益生性能更进一步的探究,有研究发现在婴幼儿配方食品中添加益生双歧杆菌对于辅助治疗儿童性过敏、腹泻等疾病具有很大的潜力[15];Arboleya等[16]通过一系列体外实验证实部分双歧杆菌可作为益生菌添加于新生儿配方奶粉中,人源双歧杆菌益生特性研究的主要目的在于为益生双歧杆菌功能性食品的研发提供优良菌株,然而目前针对我国少数民族群体中益生双歧杆菌的开发研究相对较少,尤其是产细菌素双歧杆菌鲜见报道[17],有待后期进行更深入的研究。
喀什地区位于我国西北部,新疆维吾尔自治区的西南部,长年干冷水分蒸发强,昼夜温差大,地域性分明,世代生活在当地的少数民族众多且各自有不同的饮食习惯,进而直接影响少数民族群体的肠道微生物菌群。双歧杆菌作为一种重要的肠道有益微生物,对婴幼儿的健康发挥着重要的作用,因此分离得到可以在肠道内定植的益生双歧杆菌具有非常重要的应用价值和现实意义。本研究旨在从喀什地区婴幼儿肠道粪便中分离鉴定双歧杆菌,对其遗传差异进行分析,并从中分离筛选具有潜在益生特性的双歧杆菌菌株,以期为开发适应人体肠道的高活性益生双歧杆菌及为其他益生菌产品的研发奠定相关理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
26 份婴幼儿粪便样品采集自新疆喀什市不同乡镇(伽师县、夏阿瓦提乡及克孜勒苏乡)母乳喂养的不同月份健康婴儿,婴幼儿皆为顺产且无其他病史。采集每一位婴幼儿的新鲜粪便样品适量,放入已灭菌的采样管中,并立即加入适量的保护剂(粪便-保护剂体积比为1∶2),作好标记,将采样管口密封后置于-4 ℃车载冰箱中保存,迅速运回实验室进行分离。
1.1.2 指示菌
抑菌实验采用的致病菌分别为致泻大肠埃希氏菌Escherichia coliO127:K63(CICC 10411)、出血性大肠埃希氏菌E. coliO157:H7(CICC 21530)、单核细胞性李斯特菌Listeria monocytogenes(CGMCC 1.9136)、无害李斯特菌L. innocua(CGMCC 1.2990)、鼠伤寒血清型肠沙门氏菌肠亚种Salmonella entericasubsp.enterica serovar typhimurium(CICC 10420)及血清型肠炎沙门氏菌肠亚种S. entericasubsp.enterica(CGMCC 1.10754),购自中国工业微生物菌种保存管理中心。
1.1.3 培养基与试剂
聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、ddH2O 北京康为世纪生物科技有限公司; Marker 北京天根生化科技有限公司;PCR引物 上海 捷瑞生物工程有限公司;0.22 μm微孔滤膜 上海兴亚净化材料厂;Wilkins-Chalgren厌氧琼脂培养基 山东拓普生物工程有限公司;改良MRS(de Man, Rogosa, Sharpe)培养基、LB(Luria-Bertani)培养基、胨酵母浸膏葡萄糖(peptone yeast extract glucose,PYG)培养基、胰胨大豆琼脂(trypcasein soy agar,TSA)斜面培 养基 北京博奥拓达科技有限公司;14 种碳源及牛胆盐 北京索莱宝科技有限公司;抗生素药片 江西盈科科技有限公司。
1.2 仪器与设备
DG520厌氧培养箱 英国DWS公司;5810R高速冷冻离心机 德国Eppendorf公司;UVmini-1240紫外分光光度计 日本岛津公司;TC-512 PCR仪 英国Techne公司;PowerPac Universal水平电泳仪、Gel DOC XR凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 双歧杆菌的分离纯化
将1 g新鲜粪便样品用添加有0.5% L-半胱氨酸的生理盐水梯度稀释至10-2、10-3、10-4,分别吸取100 μL进行平板涂布,于厌氧箱中37 ℃培养48 h,使用相差显微镜对单菌落进行镜检,将V形、分枝或分叉形、棍棒状或匙形的杆状菌株转接划线培养3 次,挑选纯化后的单菌落于添加了0.5% L-半胱氨酸的改良MRS液体培养基中厌氧富集,通过革兰氏染色及接触酶实验初步筛选疑似双歧杆菌,将纯培养物5 000 r/min离心10 min,弃上清液后重悬于50%的甘油中保藏,置于-80 ℃冷冻冰箱。
1.3.2 双歧杆菌属间鉴定、16S rRNA基因扩增及系统发育分析
菌株DNA的提取依据苯酚-氯仿-玻璃珠击打的方法进行[18]。经PCR指纹去重、双歧杆菌属间鉴定后挑选代表性菌株进行16S rRNA基因测序分析。采用通用引物27f(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492r(5’-CTACGGCTACCTTGTTACGA-3’),95 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸4 min,35 个循环;最后72 ℃延伸10 min。PCR产物经2.0 g/100 mL琼脂糖凝胶电泳检测后,送往北京天一辉远生物科技有限公司进行测序,测序结果提交至GenBank数据库中进行序列同源性比对(BLAST),采用CLUSTAL X1.83软件排列对齐序列[19],并用MAGE 7.0软件构建系统发育树。
1.3.3 基因外重复回文序列聚合酶链式反应(repetitive extragenic palindromic elements-polymerase chain reaction,rep-PCR)指纹图谱分析
采用引物(GTG)5和BOXAIR对分离菌株的DNA进行PCR扩增,扩增条件见表1。所有反应在25 μL体系中进行,其中:PCR Master Mix 12.5 μL,引物(GTG)5或BOXAIR(10 μmol/L)1 μL,DNA模板2 μL,ddH2O 9.5 μL。PCR扩增产物经2.0 g/100 mL的琼脂糖凝胶在0.5×TAE Buffer中,80 V电泳5 h后,在紫外凝胶成像仪下拍照保存,采用软件Gel Compar II对基因指纹图谱进行聚类分析。
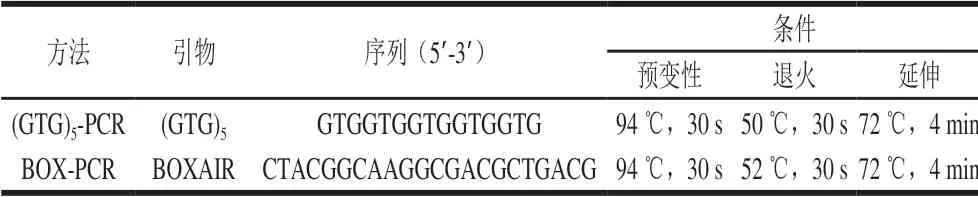
表 1 rep-PCR引物和PCR条件Table 1 Sequences of primers and PCR conditions used for rep-PCR
1.3.4 双歧杆菌益生特性分析
1.3.4.1 抑菌实验
将分离得到的双歧杆菌按2%的接种量接种于添加0.5% L-半胱氨酸的改良MRS液体培养基中,37 ℃厌氧培养48 h后将菌株发酵液离心(12 000×g,10 min,4 ℃),通过0.22 μm微孔滤膜过滤得到无细胞发酵上清液(cell-free supernatant,CFS),4 ℃保存备用。
将指示菌株致泻大肠埃希氏菌CICC 10411、出血性大肠埃希氏菌CICC 21530接种于LB液体培养基,单核细胞性李斯特菌CGMCC 1.9136、无害李斯特菌CGMCC 1.2990接种于PYG液体培养基,鼠伤寒血清型肠沙门氏菌肠亚种CICC 10420、血清型肠炎沙门氏菌肠亚种CGMCC 1.10754分别接种于TSA液体培养基,37 ℃培养18 h,取1 mL指示菌悬液于无菌生理盐水中梯度稀释至浓度约为106~107CFU/mL。吸取100 μL稀释后的菌悬液均匀涂布于每种指示菌相对应的固体培养基表面,随后将牛津杯轻轻按压其上,再向杯中加入200 μL CFS,同时以不加菌的MRS培养基为空白对照。在4 ℃冰箱预扩散6 h后,37 ℃恒温培养24 h,测定抑菌圈直径大小,确定抑菌能力,每个实验做3 个平行,取平均值。
1.3.4.2 抑菌双歧杆菌糖发酵实验
根据Dong Xiuzhu等[20]描述的方法进行糖发酵实验,实验重复3 次并做空白对照,所用碳源包括葡萄糖、木糖、核糖、甘露糖、果糖、半乳糖、阿拉伯糖、蔗糖、麦芽糖、纤维二糖、乳糖、棉子糖、甘露醇、山梨糖醇。
1.3.4.3 耐酸、耐胆盐实验
菌株耐酸性实验依据Owusu-Kwarteng等[21]改良方法进行。将活化后的双歧杆菌按2%接种量接种于添加0.5% L-半胱氨酸的MRS液体培养基中,37 ℃厌氧培养36 h,无菌条件下离心(10 000×g,5 min,4 ℃)弃上清液,用pH 7.2磷酸缓冲盐溶液(phosphate buffer saline,PBS)将菌体洗涤2 次后,重悬于不同pH值(3.0、4.0、5.0、6.0)处理后PBS中,37 ℃厌氧培养4 h后取样涂平板,24 h后进行活菌计数,每个样品做3 个平行;相同的方法将菌体重悬于不同胆盐质量分数(0.3%、0.5%、1%)处理后的PBS中,取样涂平板进行活菌计数,每个样品做3 个平行;将菌悬液加入到未经任何处理的PBS中作为空白对照,涂板后置于37 ℃厌氧条件下培养24 h后进行活菌计数,进行3 次平行实验。统计结果,按下式计算存活率:
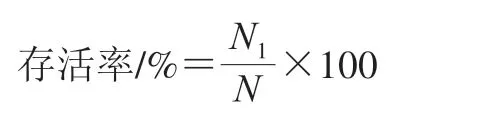
式中:N1为不同pH值或胆盐质量分数处理后平板上的活菌数/(CFU/mL);N为对照样品中的活 菌数/(CFU/mL)。
1.3.5 药敏实验
根据美国临床实验室标准化委员会标准C L S I(2012)[22],抗生素药敏实验采用纸片琼脂扩散法(K-B法)进行。吸取100 μL活化后浓度在107~108CFU/mL的双歧杆菌菌悬液,使用无菌棉签将其均匀涂布于MRS琼脂平板表面,将药片轻轻贴于其上,37 ℃倒置厌氧培养36 h,检测抑菌圈直径,每种抗生素做3 个平行。10 种常用抗生素药敏纸片(OXOID)中抗生素的含量分别为:青霉素(10 μg/片)、氨苄西林(10 μg/片)、苯唑西林(1 μg/片)、头孢噻肟(30 μg/片)、利福平 (5 μg/片)、庆大霉素(120 μg/片)、阿米卡星 (3 0 μ g/片)、四环素(3 0 μ g/片)、米洛环素 (30 μg/片)、万古霉素(30 μg/片)。
1.4 数据处理与分析
采用Gel Compar II凝胶分析软件进行指纹图谱聚类分析,采用NTSYS-pc 2.01软件对糖发酵代谢情况进行系统聚类分析,热图的绘制采用Heml 1.0软件。
2 结果与分析
2.1 双歧杆菌的分离与鉴定
从不同来源的26 份婴幼儿粪便中共分离得到180 株纯培养物,经镜检菌落形态、革兰氏染色及过氧化氢酶实验初步确定疑似双歧杆菌。通过双歧杆菌属间鉴定,进一步对其进行16S rRNA基因测序。测序所得序列经BLAST同源性比对后最终确定有75 株为双歧杆菌。其中长双歧杆菌婴儿亚种(B. longum subsp. infantis)33 株,长双歧杆菌猪亚种(B. longum subsp. suis) 8 株,两歧双歧杆菌(B. bifidum)19 株,假小链双歧杆菌(B. pseudocatenulatum)10 株,青春双歧杆菌 (B. adolescentis)5 株。
2.2 双歧杆菌遗传差异性分析
根据rep-PCR指纹分型技术,从同种指纹带型相同的菌株中挑选2~4 个典型菌株,共得到27 株代表性双歧杆菌,采用Gel Compar II软件将两种不同引物对应的指纹图谱进行聚类。由BOXAIR-PCR和(GTG)5-PCR指纹聚类图(图1)可以清晰看出,27 株双歧杆菌的指纹图谱带型较丰富,能够反映菌株在种水平上的遗传差异。
BOXAIR-PCR扩增产物的大小在300~5 000 bp之间,包括3~8 个明显的亮带,并有一些弱带;(GTG)5-PCR指纹图谱也在300~5 000 bp范围内并有1~10 个相对明显的条带,大多数产物的条带数在5 条以上。由图1可知,27 株代表性双歧杆菌根据指纹相似性被聚为4 群,Cluster I由3 株B. longumsubsp.suis和11 株B. longumsubsp.infantis组成,在3 株B. longumsubsp. suis中菌株f65-5和f65-1带型相似,而菌株f65-6的带型与它们相差较大,其中11 株B. longumsubsp. infantis有4 种带型;Cluster II由6 株B. bifidum构成,菌株f107-11、f107-7和f105-15带型相似,但明显不同于其他3 个菌株,存在2 种带型;Cluster III由5 株B. pseudocatenulatum组成,其中菌株f115-8和f40-16带型相似,菌株f40-15的带型与它们相差较大,尤其是BOXAIR-PCR扩增的指纹图谱条带更为明显;Cluster IV由2 株带型相似B. adolescentis组成。27 株双歧杆菌种间具有明显差异,遗传多样性较丰富。

图 1 基于rep-PCR扩增的27 株代表性双歧杆菌的聚类图Fig. 1 Dendrogram depicting 27 representative Bifidobacterium strains according to the genetic profiles obtained by rep-PCR
2.3 益生特性分析
2.3.1 抑菌活性分析
采用牛津杯法检测27 株双歧杆菌对常见致病菌的抑菌活性,结果见表2。实验菌株中有16 株双歧杆菌发酵上清液具有较好的抑菌性能,均可以抑制致泻大肠埃希氏菌CICC 10411、出血性大肠埃希氏菌CICC 21530、鼠伤寒血清型肠沙门氏菌肠亚种CICC 10420和血清型肠炎沙门氏菌肠亚种CGMCC 1.10754;其中B. longumsubsp.infantis中菌株f65-26、f115-9、f107-6、f77-16和f77-11的抑菌性能较好;在B. longumsubsp.suis中菌株f65-5、f65-1的抑菌能力较强,具有广谱抑菌性;在B. bifidum中菌株f107-7和f105-15可以抑制本实验中所有的肠道致病菌;相对而言,B. adolescentis菌株抑菌能力很弱。
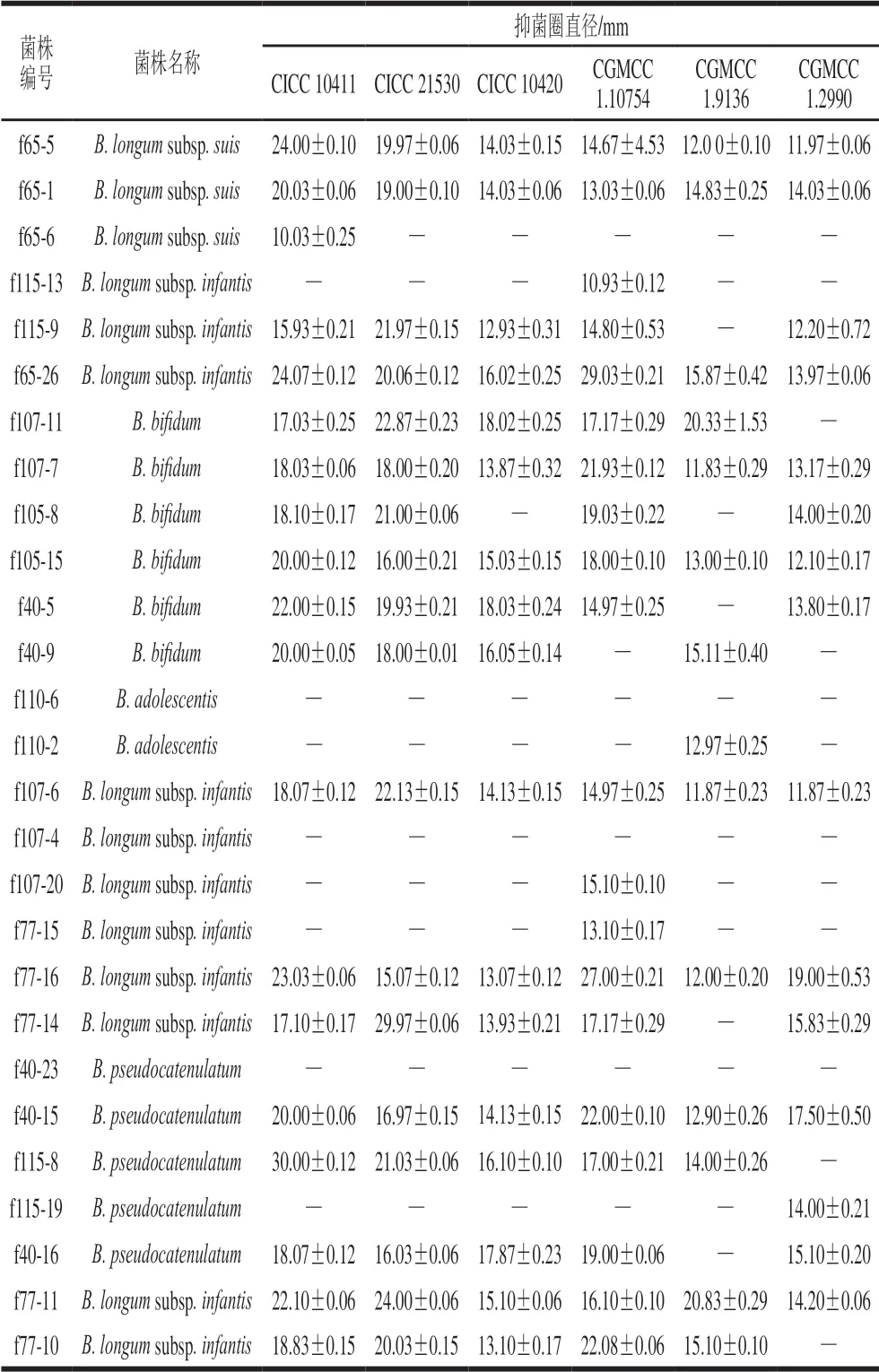
表 2 双歧杆菌菌株的抑菌活性分析Table 2 Bacteriostatic activities of Bifidobacteria strains
2.3.2 抑菌双歧杆菌菌株系统发育树分析
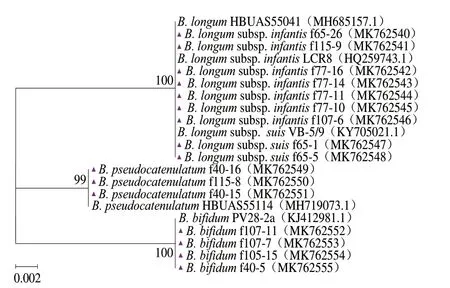
图 2 基于16S rRNA序列抑菌双歧杆菌的系统发育树Fig. 2 Phylogenetic tree of Bifidobacterium with bacteriostatic activity based on 16S rRNA sequences
将具有较好抑菌活性的16 株双歧杆菌的部分16S rRNA基因序列与GenBank数据库中已知的16S rRNA基因序列进行同源性比对,选取序列相似度高的菌株构建系统发育树见图2,由系统发育树可知,16 株双歧杆菌被划分为3 个分支。其中B. longumsubsp.infantis和B. longumsubsp.suis亲缘关系较近,分布在同一个大分支上;B. pseudocatenulatum和B. bifidum各自构成一个独立的大分支,相似度分别达到99%和100%。
2.3.3 抑菌双歧杆菌的碳源代谢分析
根据Dong Xiuzhu等[20]的方法对16 株双歧杆菌进行14 种糖发酵实验,碳源代谢结果使用NTSYS-pc 2.01软件进行系统聚类(图3)。根据糖发酵代谢情况,在70%相似性水平可以将双歧杆菌菌株聚为3 类,其中菌株f65-5和f65-1聚在一起,碳源代谢情况相似;在4 株B. bifidum中菌株f40-5的碳水化合物利用能力与菌株f107-11、f107-7、 f105-5存在明显差异,这与图1中菌株指纹差异相对应,对于基因型相同的菌株,碳源代谢能力基本相同;B. longumsubsp.infantis中菌株f115-9和f65-26的碳源利用情况存在明显差异,且菌株f115-9可以代谢9 种碳源,碳源利用率较高,尤其菌株f107-6和f77-11可以利用10 种碳源;B. pseudocatenulatum中菌株f115-8和f40-16碳源利用情况相同。16 株双歧杆菌均可以代谢葡萄糖、乳糖、蔗糖和半乳糖。
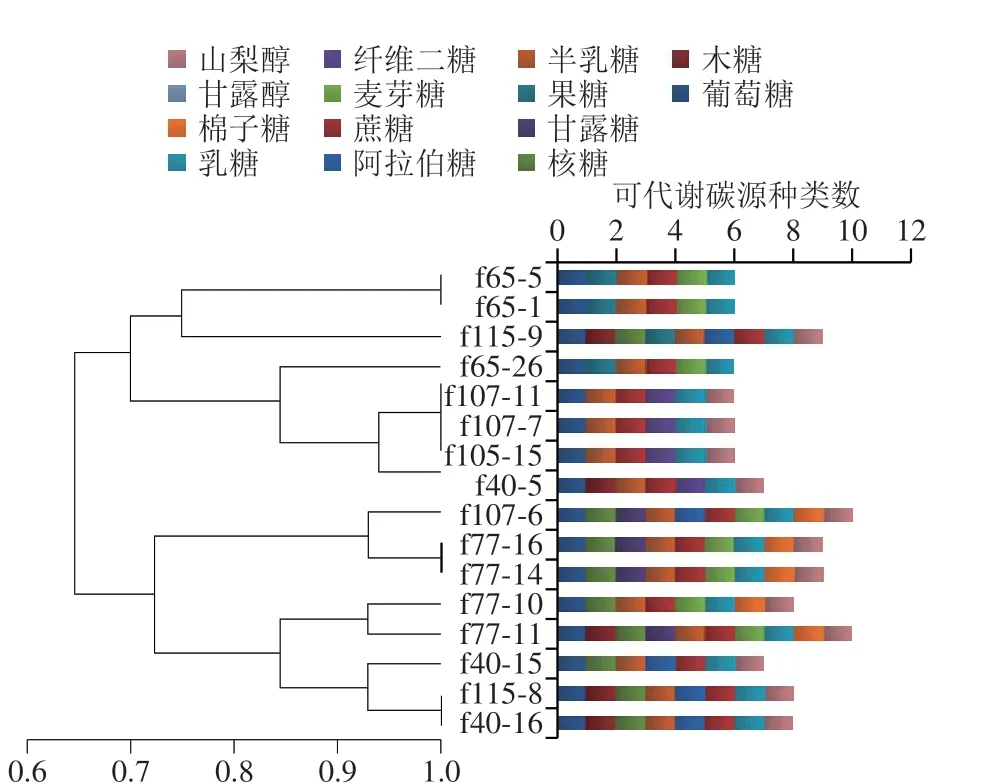
图 3 双歧杆菌糖发酵代谢谱及聚类图Fig. 3 Sugar metabolism spectrum and clustering map of Bifidobacterium
2.3.4 抑菌双歧杆菌菌株对酸及胆盐的耐受性
如表3所示,所有菌株在pH 4.0、5.0、6.0的PBS中均能存活,而在pH 3.0的PBS中仅有菌株f65-26、f40-15和f115-8能够存活,其具有较强的耐酸能力。实验中多数菌株能够在0.3%的胆盐中存活,当胆盐质量分数为0.5%时,仅有菌株f65-26和f115-8存活率分别达到24.11%和27.06%,当胆盐质量分数为1.0%时,几乎所有菌株存活率低于0.000 1%,相对而言,菌株f40-15在pH 3.0的PBS中存活率较好,而在0.5%的胆盐中几乎不能存活。根据菌株耐酸耐胆盐的整体结果来看,菌株f65-26和菌株f115-8为耐受性最优菌株。
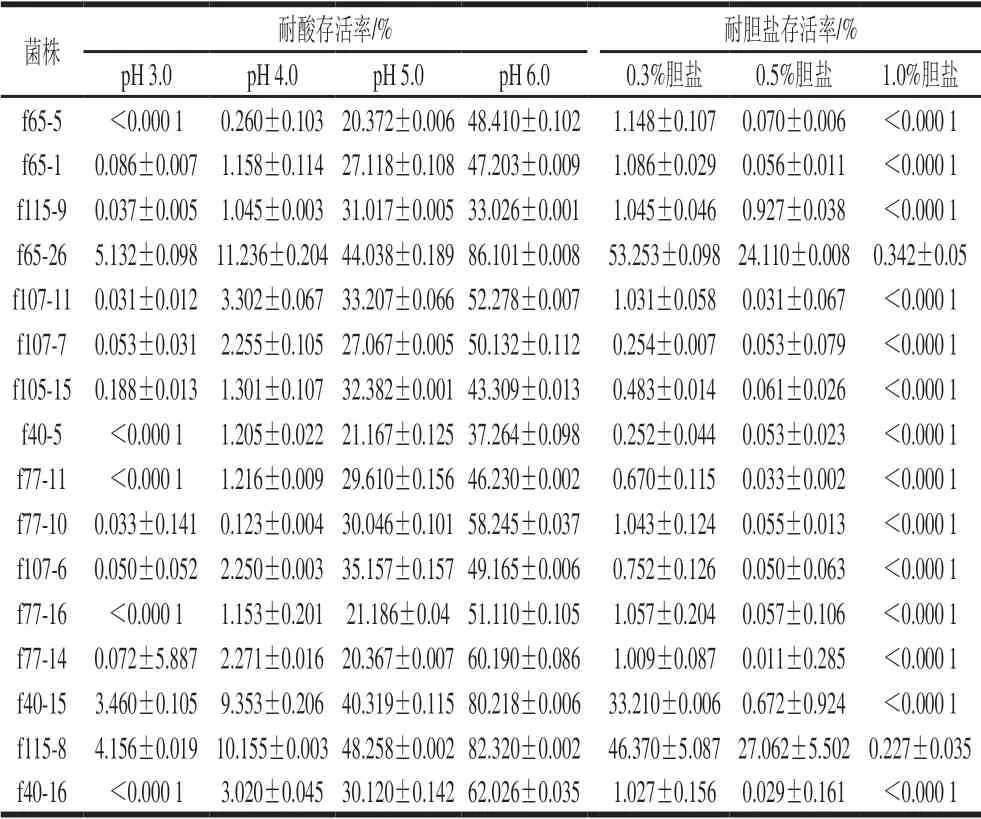
表 3 抑菌双歧杆菌菌株的耐酸、耐胆盐结果分析Table 3 Acid and bile tolerance of Bifidobacterium with bacteriostatic activity
2.4 抗生素耐药性分析

图 4 基于抑菌圈直径对16 株具有抑菌特性双歧杆菌的抗生素抗性的热图分析Fig. 4 Heat map analysis of antibiotic resistance of 16 strains of bacteriostatic Bifidobacteriums based on the diameter of inhibition zone
根据纸片琼脂扩散法对抑菌双歧杆菌菌株进行10 种抗生素抗性分析,通过颜色梯度直观反映16 株抑菌双歧杆菌产生的抗生素抑菌圈的直径大小,表明双歧杆菌的抗生素耐药情况。从图4可知,16 株抑菌双歧杆菌对大多数抗生素表现敏感,而深绿色区域主要集中在阿米卡星和万古霉素,由美国临床实验室标准化委员会标准CLSI判断表明,除菌株f107-6和f65-26分别对万古霉素和阿米卡星表现敏感外,其余所有实验菌株对这两种抗生素表现耐药;其中部分菌株对庆大霉素也表现耐药;在青霉素类抗生素中,所有双歧菌株对青霉素和氨苄西林敏感,相对苯唑西林而言,除菌株f77-16对苯唑西林表现敏感外,所有菌株对其表现中敏或耐药,可见同种抗生素耐药情况也不相同。
3 讨 论
双歧杆菌作为新生儿肠道早期定植的细菌群之一,被认为在调节宿主黏膜生理和先天免疫方面发挥着关键作用[23]。婴幼儿期肠道菌群中双歧杆菌的建立与婴幼儿未来健康成长之间的关系早已成为研究者关注的热点,为快速分析和鉴别婴幼儿肠道中的双歧杆菌,传统的表型方法在菌株的鉴别能力和准确性方面都受到限制,因此菌株区分需要基于相应的DNA技术,rep-PCR指纹技术基于快速、易于操作和可重复性等性能,具备高的分辨能力,可用于区分在种、亚种及菌株水平上的多种 菌株[24-25]。本实验结合分子生物学及传统菌株的分离鉴定方法,从26 份新疆维吾尔族婴幼儿粪便中共分离得到75 株双歧杆菌,其中B. longum subsp. infantis33 株,B. longumsubsp.suis8 株,B. bifidum19 株,B. pseudocatenulatum10 株,B. adolescentis5 株。为准确反映双歧杆菌菌株间的遗传多样性,本研究采用(GTG)5和BOXAIR两种不同引物的rep-PCR指纹图谱技术对筛选到的双歧杆菌进行遗传差异性分析,发现这些菌株种间具有明显的差异,种内带型多样,存在极高的遗传多态性,与Jarocki等[26]的研究结果一致。有文献报道B. longum subsp. suis仅在猪仔粪便中被发现[27],而本研究从喀什地区婴幼儿粪便中也分离得到了该菌株,后续将对该菌株进行更深入的研究。
双歧杆菌具有潜在益生和促进健康的特性,如免疫调节、产生细菌素和抑制病原体等,有研究发现,肠道菌群与肥胖、糖尿病、炎症性肠炎和胃肠道癌症等疾病具有一定的相关性,存在于人体肠道中的条件致病菌数量占比虽较少,但在一定条件下能够导致人体疾病的发生,根据Eshaghi等[28]报道,部分婴幼儿肠道双歧杆菌可以抑制志贺氏痢疾杆菌和致泻大肠埃希氏菌,从而有效预防婴幼儿肠道腹泻;赵志霞等[29]从新疆喀什地区维吾尔族母乳中分离到双歧杆菌对表皮葡萄球菌、蜡状芽孢杆菌、粪肠球菌等条件致病菌有明显的抑菌效果。本实验采用牛津杯法对从新疆喀什地区维吾尔族婴幼儿肠道中分离得到的双歧杆菌菌株进行抑菌活性检测,发现有16 株双歧杆菌对6 种肠道致病菌具有明显的抑菌活性,从系统发育来看,其中7 株属于B. longumsubsp.infantis、4 株属于B. bifidum、3 株属于B. pseudocatenulatum、2 株属于B. longumsubsp.suis。这些具有良好抑菌性能的双歧杆菌在人体发挥益生特性必须要具备一定的耐受能力,根据Awasti等[30]从成人及婴儿粪便中分离到双歧杆菌的耐受性研究发现,1 株B. breve在低pH值和较高胆盐质量分数的培养液中的存活率分别可达87%和63%,本实验对抑菌性能较好的菌株进行耐酸耐胆盐实验发现B. longumsubsp. infantisf65-26和B. pseudocatenulatumf115-8分别在pH 3.0和胆盐质量分数为0.5%的培养液中存活率较高,具有较好的耐受性,后期对这些潜在益生性菌株进行体内实验是非常关键和必要的。
随着双歧杆菌活菌制剂及益生菌产品需求量的扩大,有关双歧杆菌耐药安全性问题的研究逐渐引起了广大学者的重视。Matteuzzi等[31]对人体粪便中分离得到的459 株双歧杆菌进行15 种抗生素药敏实验发现短型双歧杆菌B. breve和猪双歧杆菌B. suis对卡那霉素的耐药性最强;石晶红[32]对10 株双歧杆菌进行12 种抗生素敏感性实验发现,10 株双歧杆菌对链霉素、庆大霉素、阿米卡星和甲硝唑表现很强的耐性,而对四环素、氯霉素和红霉素均敏感。本研究采用纸片扩散法对16 株具有抑菌活性的双歧杆菌进行10 种抗生素敏感性测定,结果发现实验菌株除对阿米卡星及万古霉素表现耐药外,对其他抗生素均表现敏感或中度敏感,这些婴幼儿肠道中双歧杆菌抗生素耐药问题可能是双歧杆菌本身具有耐药基因存在于其染色体上,也可能是婴幼儿及母亲在饮食或生活环境中接触了相关抗菌药物。因此在今后实验中将探明其耐药机理及耐药基因的转移问题,为进一步选育安全的益生双歧杆菌菌株提供一定参考研究基础。
4 结 论
本研究从新疆喀什地区维吾尔族婴幼儿肠道中分离筛选得到75 株可培养的双歧杆菌菌株,并通过rep-PCR指纹分型技术对菌株遗传结构差异进行分析。此外,对代表性双歧杆菌菌株进行抑菌、耐酸耐胆盐及抗生素耐药性实验发现,有16 株双歧杆菌菌株具有良好的抑菌性能并对多数抗生素表现敏感,尤其是B. longumsubsp.infantisf65-26和B. pseudocatenulatumf115-8为耐受性最优菌株,具有潜在的开发利用价值。
