阴离子交换树脂对碳酸盐水体中铀酰离子的吸附研究
2020-04-01陆玲玉
摘 要:近些年来,随着核工业的发展和核能的大规模利用,自然环境面临放射性污染的风险与日俱增。根据文献,目前世界上多个国家已经发现采集的地下水水样中铀的含量过高[1-4],严重超出了各国关于饮用水中铀含量的相关标准。铀具备放射性与重金属毒性,能够使生物蛋白质发生变质。相关研究表明长期摄入含铀的地下水,会对人体的肾脏造成不可逆损害,严重时致人死亡[5]。世界卫生组织则推荐饮用水中铀的质量浓度不得超过30 g/L[6]。因此有必要关注和探索自然环境水样中铀酰离子的存在形态和去除手段。
关键词:铀酰离子,碳酸盐,阴离子交换树脂IRA900,吸附效率
1. 引言
铀在自然环境中一般呈现正六价,也就是UO22+。然而UO22+容易与水中的CO32-络合,生成不同形态的碳酸铀酰络合物,如UO2(CO3)34-,UO2(CO3)34-和UO2CO3。在某些金属离子如Ca2+、Mg2+存在条件下,这些碳酸铀酰络合物又容易转化为更复杂的铀酰络合物,如Ca2UO2(CO3)3或者MgUO2(CO3)32-等,从而形成一个复杂的含铀水体系[7, 8]。强碱性阴离子交换树脂由于其简单方便并且高效从而被广泛用于水处理领域,本文探究了阴离子交换树脂IRA900在碳酸盐水体系下对铀酰离子的吸附行为,并且用数学软件计算了其在实验条件下的离子形态分布。本研究将为阴离子交换树脂应用于含铀污水的处理提供一定的理论指导。
2. 实验分析
2.1 实验材料与试剂
本文采用的阴离子交换树脂为陶氏化学公司生产的IRA900型强碱性阴离子交换树脂。树脂使用之前先以1 mol/l的NaOH溶液和1 mol/l 的HCl溶液洗去树脂中残留的杂质,然后以大量的超纯水将树脂洗涤至中性为止,此时IRA900转为氯型。最后将树脂置于真空干燥箱中于40℃干燥48 h待用。本研究中所用的UO2(NO3)2·6H2O、NaOH和无水NaHCO3等试剂均为分析纯。硝酸质量分数为65%~68%。所有的溶液均以超纯水制备。
2.2 实验方法
2.2.1 首先配置 1 mg/l的铀和3 mmol/l 碳酸氢钠混合溶液。随后取7个干净烧杯,每个烧杯内分别倒入35 mL左右该混合溶液。 以1mol/l 的硝酸溶液和 1 mol/l 的氢氧化钠溶液对烧杯内的溶液进行pH调节,分别调整至4、5、6、7、8、9和10并做好标记。另取多个规格为40 mL的小玻璃瓶,每个玻璃瓶称取0.05 g树脂放入。将上述溶液跟玻璃瓶内的树脂混合并且盖紧瓶盖,然后置于空气震荡摇床中于室温震荡3 小时, 震荡频率为120 rpm。待吸附完成后,以0.45 um的针筒过滤器实现固液分离。将过滤后的水样稀释后以微量鈾分析仪测定浓度。其中铀的吸附效率用以下公式计算:
其中A(%)表示IRA900树脂在实验条件下对铀的吸附效率,C0 (μg/l) 和 Ce (μg/l) 分别表示铀的初始和平衡浓度。
2.2.2 铀在实验条件下的离子形态计算铀的离子形态计算依靠化学计算软件PHREEQC完成。该软件由美国地质调查局开发,包含了大量关于铀的热力学数据。计算过程中采用的数据库为wateq4f.dat。
3. 实验结果
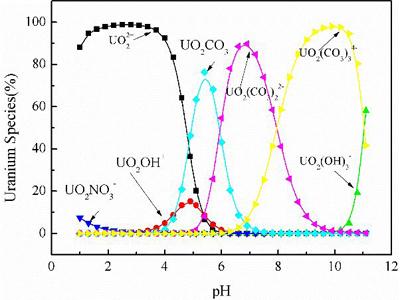
3.1 铀在不同pH条件下的离子形态分布
计算过程中输入的铀的质量浓度为1 mg/l, 碳酸氢钠浓度为 3 mmol/l,这些参数与实验条件一致。计算结果如图1所示,铀在碳酸盐水体系中的离子形态占比会随着pH值变化。其中在pH<4时,铀主要是以UO22+存在; 当5
图1 铀在不同pH条件下的离子形态分布([U]= 1mg/l,[NaHCO3] = 3 mmol/l)
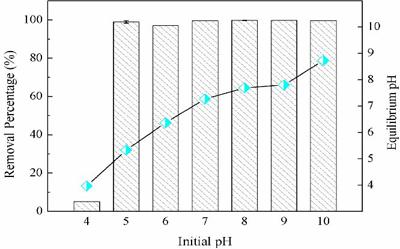
3.2 pH值对IRA900吸附铀的影响
由于pH值对碳酸盐水体系中铀的形态分布会产生较大影响,因此研究考察了IRA900在不同pH条件下对铀的吸附行为,并且测定了吸附前后的pH变化。如图2所示,在初始pH为4的条件下,IRA900对铀的吸附效率较低,约为6%左右。这是因为在这种酸性条件下,溶液中存在的碳酸氢根离子已经基本转化为二氧化碳进入空气中,导致溶液中没有足够的碳酸根离子与铀酰离子配位进而无法形成碳酸铀酰络阴离子。而当pHμ5时,IRA900对铀的吸附效率接近100%, 并且基本不随pH值变化。此外,当pHμ8时,平衡pH值均高于初始pH值并且十分接近。然而,后续随着初始pH值的增加,平衡pH值相对初始pH值均有一定程度下降。
图2 IRA900在不同pH条件下对铀的去除效率及前后pH变化([U]= 1mg/l,[NaHCO3] = 3 mmol/l)
4. 总结
本文探究了强碱性阴离子交换树脂对碳酸盐水体中U(Ⅵ)的吸附行为。通过理论计算发现,铀在不同pH条件下的离子形态分布差异较大。其中在pH<4时,铀主要是以UO22+存在; 当5
参考文献:
[1] Nriagu J, Nam D H, Ayanwola T A, et al. High levels of uranium in groundwater of Ulaanbaatar, Mongolia[J]. Sci Total Environ, 2012, 414: 722-726.
[2] Katsoyiannis I A, Zouboulis A I. Removal of uranium from contaminated drinking water: a mini review of available treatment methods[J]. Desalination and Water Treatment, 2013, 51(13-15): 2915-2925.
[3] Shin W, Oh J, Choung S, et al. Distribution and potential health risk of groundwater uranium in Korea[J]. Chemosphere, 2016, 163: 108-115.
[4] Daulta R, Singh B, Kataria N, et al. Assessment of uranium concentration in the drinking water and associated health risks in Eastern Haryana, India[J]. Human and Ecological Risk Assessment: An International Journal, 2018, 24(4): 1115-1126.
[5] Domingo J L. Reproductive and developmental toxicity of natural and depleted uranium: a review[J]. Reproductive Toxicology, 2001, 15(6): 603-609.
[6] Organization W H. Uranium in drinking-water: Background document for development of WHO Guidelines for Drinking-water Quality[J]. 2004.
[7] Dong W, Brooks S C. Determination of the Formation Constants of Ternary Complexes of Uranyl and Carbonate with Alkaline Earth Metals (Mg2+, Ca2+, Sr2+, and Ba2+) Using Anion Exchange Method[J]. Environmental Science & Technology, 2006, 40(15): 4689-4695.
[8] Camacho L M, Deng S, Parra R R. Uranium removal from groundwater by natural clinoptilolite zeolite: effects of pH and initial feed concentration[J]. J Hazard Mater, 2010, 175(1-3): 393-398.
作者簡介:
陆玲玉,女,广西来宾人,本科,广西壮族自治区辐射环境监督管理站助理工程师,从事放射化学分析测试工作。
