QuEChERS-HPLC-MS/MS法在咖啡因中毒案例中的应用研究
2020-04-01
(陕西津实司法鉴定中心, 西安 710075;2.山西警察学院,太原 030401;3.内蒙古医科大学,呼和浩特 010110)
1 前言
咖啡因(Caffeine)是从茶叶、咖啡果中提炼出来的一种生物碱,纯咖啡因最初于1819年从咖啡植物中分离得到[1]。当咖啡因在人血液中浓度超过80μg/mL时就会导致死亡[2、3]。因此,在法医工作中准确快速测定咖啡因在人体液中的浓度就成为十分重要的工作。测定血液和尿液中咖啡因浓度的常规方法有气相色谱-质谱法(GC-MS)[4],高效液相色谱法(HPLC)[5、6]、液相色谱-串联质谱法(LC-MS/MS)[7]等,但以上方法中均存在前期处理复杂,分析时间长等缺点。
QuEChERS(SPE)法具有快速、简单、廉价、有效、可靠和安全等特点,因此在农兽药残留检测中应用非常广泛[8],但在临床毒物和法庭毒物学领域生物检材中应用较少。在测定咖啡因中毒者血液与尿液中的咖啡因浓度时,采用QuEChERS-LC-MS/MS法可以快速、准确地得到测定结果。本研究通过对1例服用咖啡因中毒死亡的典型案例,利用QuEChERS前处理结合液相色谱-串联质谱法建立一种快速、准确测定咖啡因中毒者血液和尿液中的咖啡因浓度的方法。
2015年初,作者对1例被发现死在家中的60岁女性尸体进行了尸检。据警方介绍,死者有5年以上的肝硬化病史,经勘察发现案发现场有感冒药以及装咖啡因片剂空瓶,推断死亡时间在1d以内。尸体在2~4℃冷藏柜中保存1d以后,送检。
右手和左膝盖部有轻微的皮下出血。眼睑结膜、口唇粘膜、头皮下、心脏表面有多数出血点。左心室内膜有出血,心脏肥大,肺部淤血水肿,肝硬变。心脏重量为422g;胸腔内积液右侧为33mL,左侧为7mL;肺重量,右肺为601g,左肺为517g。
采用气相色谱用氢火焰离子检测器(GC-FID)检测死者血液中乙醇结果显示阴性。采用免疫滥用药物检测板(Triage Drugs of Abuse Panel Plus TCA)对尿液进行检测结果显示阴性(该检测板不具有咖啡因检测属性)。采用GC-MS(血液中常见药毒物NAGINATA筛选法[9])分析股静脉血,除检出咖啡因外未检出其他常见药毒物,遂建立死者血液和尿液中咖啡因快速测定方法。
2 实验部分
2.1 仪器与试剂
1200系列快速分离液相色谱仪(美国 Agilent公司);6460 三重串联四级杆质谱仪(美国 Agilent 公司),配有电喷雾离子源(ESI)。
标准品咖啡因(Product Number:C0750;CAS Number:58-8-2;Purity(HPLC):≥99%;Water(by Karl Fischer):≤0.5%)、内标物己可碱(Pentifylline)(CAS No: 1028-33-7;Concentration:100%)与乙腈(色谱级)购于和光纯药工业株式会社。QuEChERS分散固相萃取柱(2mL,内含25mg PSA、25mg C18EC、150mg MgSO4)和Captiva ND Lipids净化管(3mL)购于安捷伦公司。
2.2 材料
检材:死者股静脉全血、尿液各采集10mL,-80℃超低温冰箱保存。
2.3 色谱条件
实验采用Agilent1200系列快速分离液相色谱系统和Agilent6460三重串联四极杆仪。色谱柱:TSKgel Amide-80(2.0mm×25cm,粒径3μm);流动相A:0.1% TFA 超纯水溶液:乙腈=5∶95(v∶v)溶液;流动相B:超纯水溶液:乙腈=50∶50(v∶v)溶液;梯度洗脱:0~10min,0%B~60%B,平衡时间10 min,流速为0.25mL/min;柱温:25℃;进样量:3.5μL;
2.4质谱条件
离子源:电喷雾离子源(ESI);喷雾电压:500V,离子传输管温度: 320℃。定性和定量均采用选择性离子监测(SRM)模式;咖啡因:m/z195→138、m/z195→110;己可碱:m/z265→138;碎裂电压和碰撞能量;咖啡因:120和21V,己可碱:120和13V。
2.5 检材前处理
采用1.5mL塑料离心管,加入0.1mL血液或尿液,加入内标液(己可碱的乙腈溶液1mg/mL)10μL,再加入0.9mL乙腈溶液,涡旋10 s,离心 2min(20000r/min),移取上清液至QuEChERS分散固相萃取(SPE)柱涡旋1min,离心 2min(20000 r/min),移取上清液用Captiva NDLipids净化管过滤至进样瓶中,进行HPLC-MS/MS测定。
2.6 标准加入法
标准加入法是指将已知量的标准试样加入到待测试样中,测得试样量和标准试样的总响应值后,对试样进行定量分析的方法,相比标准曲线法可以消除或减少基质效应的影响。标准加入法经常用于原子吸收光谱分析[10]以及人体体液检材和固体组织检材中毒(药)物定量分析研究中[11]。
实验具体步骤:配制咖啡因标准液浓度为0、0.1、0.2、0.4、0.8、1.0、10μg/mL。取死者股静脉全血和尿液各0.1mL7份置于1.5 mL离心管中,分别加入上述7个不同浓度的咖啡因标准液和10μg/mL的内标溶液各10μL,按照“2.5”项前处理后进样3.5μL,得7个点系列浓度。记录咖啡因和内标峰面积,以Y为样品中咖啡因和内标丰面积比值对添加的浓度X进行线性回归,得到线性方程(Y等于0时X为样品中咖啡因浓度的负值)。
2.7 基质效应和提取回收率
本研究参考心脏肌肉和脂肪组织为基质考察了基质效应和提取回收率[12]中采用的方法应用到股静脉血液、尿液的基质效应和提取回收率。具体方法为:取0.1mL死者股静脉全血和尿液样品按“2.5”项前处理后用标准加入法[11]进行分析,得到股静脉全血和尿液中的咖啡因浓度。准备咖啡因标准液两种,其浓度分别为1/10样品浓度和10倍的样品浓度,然后取0.1mL股静脉全血和尿液样本按“2.5”项前处理后得到萃取液,取上述两种萃取液各0.5mL加入5μL对应的 10倍样品浓度的咖啡因标准液,涡旋,然后HPLC -MS/MS进样3.5μL分析得到的峰面积为“A”,不加入标准液得到的萃取液进行HPLC-MS/MS进样3.5μL分析得到的峰面积为“B”,对应的1/10样品浓度的咖啡因标准液 HPLC-MS/MS进样3.5μL分析得到的峰面积为“C”,基质效应(%)等于[(A-B)/C]×100,提取回收率(%)等于[B/(A-B)]×100。
3 实验结果
3.1 LC-MS/MS定性分析
图1所示为标准品咖啡因乙腈溶液、死者股静脉全血以及尿液萃取液的质谱图,结果显示两种萃取液的质谱图和标准物一致,无杂峰,确认物质为咖啡因。
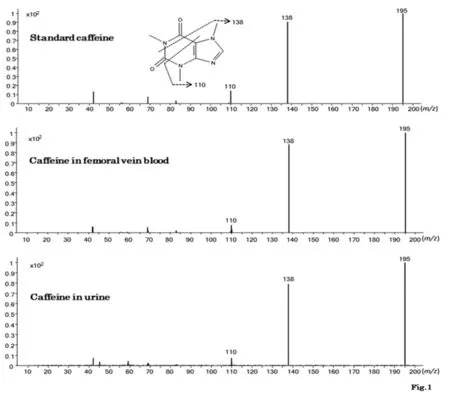
图1 标本提取物的质谱图与标准咖啡因质谱图
图2所示为咖啡因乙腈溶液、死者股静脉全血和尿液萃取液、股静脉萃取液添加和无添加内标己可碱的选择反应监测色谱图。结果表明咖啡因的保留时间为2.56min,内标己可碱的保留时间为1.88min,无添加内标的股静脉全血在相应时间无干扰峰。

图2 LC-MS/MS选择反应监测色谱图
3.2 线性关系、检测限
对案例血液和尿液中加入浓度为10~1000μg/mL 范围的咖啡因时线性关系大于0.999,线性关系良好,如表 1所示。

表1 股静脉全血和尿液中咖啡因标准加入法测定工作曲线
如果y=0,先前存在的浓度(x)可以以负值计算
空白血液和尿液中咖啡因在信噪比S/N=3的条件下检出限(LOD)为10ng/mL,在信噪比S/N=10的条件下定量限(LOQ)为50ng/mL。
3.3 基质效应、加标回收、精密度测定结果
由于正常人体血液和尿液中本身就含有咖啡因,因此无法做空白添加实验,本次实验使用标准添加法对死者血液、尿样中咖啡因进行了定性和定量分析。取死者股静脉全血和尿液各0.1mL置于1.5mL离心管中,按“2.7”项下方法计算基质效应和提取回收率。结果显示,基质效应:股静脉血液46.9%;尿液48.2%;提取回收率:股静脉血液87.3%;尿液65.1%(n=5)。分别于当日和连续5日每天测定,计算日内和日间精密度均小于15%。结果见表 2。

表2 股静脉全血和尿液中咖啡因精密度测定结果
以平均标准偏差给出数据;RSD:相对标准偏差
3.4 定量结果
对死者的股静脉全血和尿液进行了按“2.5”项前处理后用标准加入法[11]进行分析,结果显示股静脉全血样品中咖啡因浓度为137μg/mL,尿液中咖啡因浓度为80.3μg/mL。
4 讨论
已报道的全血和尿液中的咖啡因浓度分析方法, HPLC法[5、6]虽然成本低,但存在分析时间长、灵敏度低等缺点,不适合于全血和尿液中的咖啡因的快速测定。GC-MS[13、14]法存在预处理复杂,样品需要气化,检测时间较长的不足,也不适合咖啡因中毒案例当中的快速测定。文献[7]采用LC-MS/MS测定显示咖啡因的出峰时间超过5min,而且预处理简单没有净化管净化,容易污染色谱柱。本实验采用的QuEChERS 预处理法结合HPLC-MS/MS法分析血液和尿液中的咖啡因,全程分析在10min内完成,具有灵敏度高、样品处理简单、快速的优点。本研究另一优势在于试验中使用标准加入法对被测的血液、尿液试样中直接加入标准咖啡因液以及内标液进行定量分析,无需空白样品添加实验,从而消除基质效应、保证结果的准确性。
本方法分析经匀浆处理的固体组织检材,如脑、心脏、肝脏以及肌肉等组织中咖啡因,同样取得了较高的提取回收率,证明该方法也适用于无体液材料的咖啡因中毒案例中咖啡因的定量分析。随着QuEChERS 预处理技术发展,在临床毒物和法庭毒物学领域生物检材中有广泛的应用空间。
