肉桂醛对芒果胶孢炭疽病的抑制作用及其涂膜应用
2020-04-01,*
,*
(1.江南大学食品学院/食品科学与技术国家重点实验室,江苏无锡 214122 2.苏州工业园区新国大研究院,江苏苏州 215123)
炭疽病作为芒果最严重的,也是热带水果和蔬菜中最具破坏性的疾病之一,包括芒果、木瓜、香蕉、葡萄等的炭疽病,由真菌芒果胶孢炭疽菌(ColletotrichumgloeosporioidesPenz,C.gloeosporioides)引起[1]。在国内外芒果产区、不同芒果品种间普遍发生。接近成熟或成熟果实感病,初期形成黑褐色圆形病斑,扩大后呈圆形或不规则形,黑色,中间凹陷,在储存,运输和销售过程中会对果实造成损害[2]。
长期以来,芒果炭疽病的在我国的防治以化学药剂为主,农户使用合成杀菌剂如苯菌灵,代森锰锌等,或结合多菌灵,可以减少收获后疾病的潜在感染[3]。可是杀菌剂在水果上的残留物对人体健康和环境有害[4],甚至致癌[5]。所以一些国家限制使用化学杀菌剂来控制采后腐烂,在美国、以色列和南非等国,有少量使用热处理保鲜的报道[6],但是单一的热处理会加速果实的后熟和果皮失水皱缩,在我国冷链系统尚不健全的情况下,难以应用。因此,研究和开发新型环保型防腐保鲜产品,对于生产安全食品具有重要的现实意义[7]。近年研究表明,植物精油抑菌是一种有效控制采后果实病害的无毒或低毒方法,Gong等[8]发现丁香酚与β环糊精结合成可食用涂膜可以有效控制荔枝采后的霜疫病;将丁香酚或百里香酚加入气调包装中,制得的活性包装用以储存葡萄,葡萄的储存保鲜期可达56 d[9];杨波[10]发现用β环糊精包埋丁香、肉桂精油制成的抗菌小袋能有效控制芒果果实硬度和VC含量的下降及总糖含量的变化,延缓果实后熟衰老进程;Liu等[11]的研究表明,用2~4 mg/L浓度的麝香草酚对杏和李子进行熏蒸处理可显著降低烂果率,而且对水果组织不产生任何影响。植物精油表现出的优良抑菌活性和广谱性,将有助于人们找到更为理想的天然防腐剂,这也符合人们追求“绿色健康”理念的需要。
目前,部分学者对测试精油用于控制芒果果实中的胶孢炭疽菌的筛选有所研究,但针对精油对于芒果炭疽菌作用机理和将精油实际应用于芒果保鲜的研究较为空缺。本研究的目的是通过测试和比较肉桂醛、丁香酚、己醛、香芹酮、香叶醇、柠檬醛在体外抑制芒果胶孢炭疽菌生长的效果,以半数抑制浓度(EC50)和最小抑菌浓度(MIC)等为指标筛选出抑菌效果出色的天然植物精油种类,并对腐败菌接触精油后细胞的形态学,细胞内物质泄露,细胞外pH、电导率、丙二醛(Malondialdehyde,MDA)和麦角甾醇等进行测定,探究肉桂醛的抑菌机理;根据失重率、腐败率、可溶性固形物和可滴定酸含量等,综合评价含肉桂醛的可食用成膜剂的抑菌保鲜效果,为开发绿色农药寻找理论和应用依据。
1 材料与方法
1.1 材料与仪器
芒果胶孢炭疽菌(ACCC36431) 由中国农业科学院蔬菜花卉研究所分离,中国农业微生物菌种保藏管理中心(ACCC)保藏并提供;芒果 品种为台芒1号,于2019年3月采摘于海南三亚梅山;肉桂醛 中国双香助剂厂;丁香酚、柠檬醛、己醛、香芹酮、香叶醇、碘化丙啶(Propidium Iodide,PI) 北京百灵威科技有限公司;PDA培养基、PDB培养基、酵母浸膏 青岛高科园海博生物技术有限公司;果蜡 东莞市博诚化工有限公司;Bradford蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;微生物丙二醛(MDA)ELISA试剂盒、微生物麦角固醇ELISA试剂盒 上海通蔚生物科技有限公司。
M5全自动酶标分析仪 美国Molecular Devices公司;UV-1800紫外可见分光光度计 日本岛津公司;Axio Vert.A1倒置式材料金相显微镜 德国Carl Zeiss股份公司;ST-40R冷冻离心机 德国Thermo Fisher Scientific公司;IRH-150F生化培养箱 中国上海一恒科学仪器有限公司;HYL-A全温摇瓶柜 中国太仓市强乐实验设备有限公司;DELTA 320 pH计 德国梅特勒-托利多有限公司;ST3100C电导率测试仪 中国奥豪斯仪器(常州)有限公司;GY-B型硬度计 中国徐州淮博仪器设备有限公司。
1.2 实验方法
1.2.1 不同精油处理 对C.gloeosporioides菌丝生长的MIC、抑制率和EC50的测定采用菌丝生长速率法[12]测定不同精油对C.gloeosporioides菌丝生长的抑制作用[13]。将C.gloeosporioides接种在改良PDA培养基上[14],于 26 ℃培养72 h,用打孔器将其打成直径约为 5 mm 的菌饼,接种于含不同梯度浓度精油的培养基平板中间,精油使用等体积乙醇溶液溶解[15],每组设置3次重复,设含等量乙醇的空白培养基平板做对照。分别于26 ℃下黑暗培养,3 d之后开始每天观察记录菌丝生长情况。各精油做相同重复试验。用十字交叉法测量菌落直径,取其平均值。取与原接种菌饼相比,菌丝恰不生长的浓度为MIC。按以下公式计算不同精油对病菌菌丝生长的抑制率[16]。
菌丝生长抑制率(%)
将菌丝生长抑制率换算成抑制率值(Y),药剂浓度换算成浓度对数(X),求出回归方程 Y=aX+b[17],计算出相关系数(R2)和EC50。
1.2.2 不同浓度肉桂醛处理C.gloeosporioides的生理生化指标测定
1.2.2.1C.gloeosporioides菌液制备 在改进PDA液体培养基中培养C.gloeosporioides孢子,26 ℃,125 r/min摇床培养72 h,真空过滤收集菌丝体,使用生理盐水抽洗3次洗去培养基,在每100 mL生理盐水中加入0.5 g菌丝体,摇荡使其悬浮。
1.2.2.2 肉桂醛对C.gloeosporioides细胞膜完整性的影响 使用荧光染色对菌丝细胞膜完整性进行评价[18]:在1.2.2.1所述菌液中分别加入浓度为CK、EC50、1MIC和2MIC的肉桂醛,于26 ℃,125 r/min摇床培养培养2 h后吸出3 mL菌丝和培养液,4 ℃,5400 r/min离心10 min,弃上层培养基收集菌丝,再用生理盐水洗两次去除残余培养基,每次洗3 min,后用20 μL PBS缓冲液重悬,加入预先混合好的碘化丙啶(PI)染色试剂,30 ℃下染色5 min。4 ℃,5400 r/min条件下再次离心5 min并用生理盐水冲洗一次,吸取一滴菌液滴加在干净载玻片上,盖上盖玻片于荧光显微镜下观察。
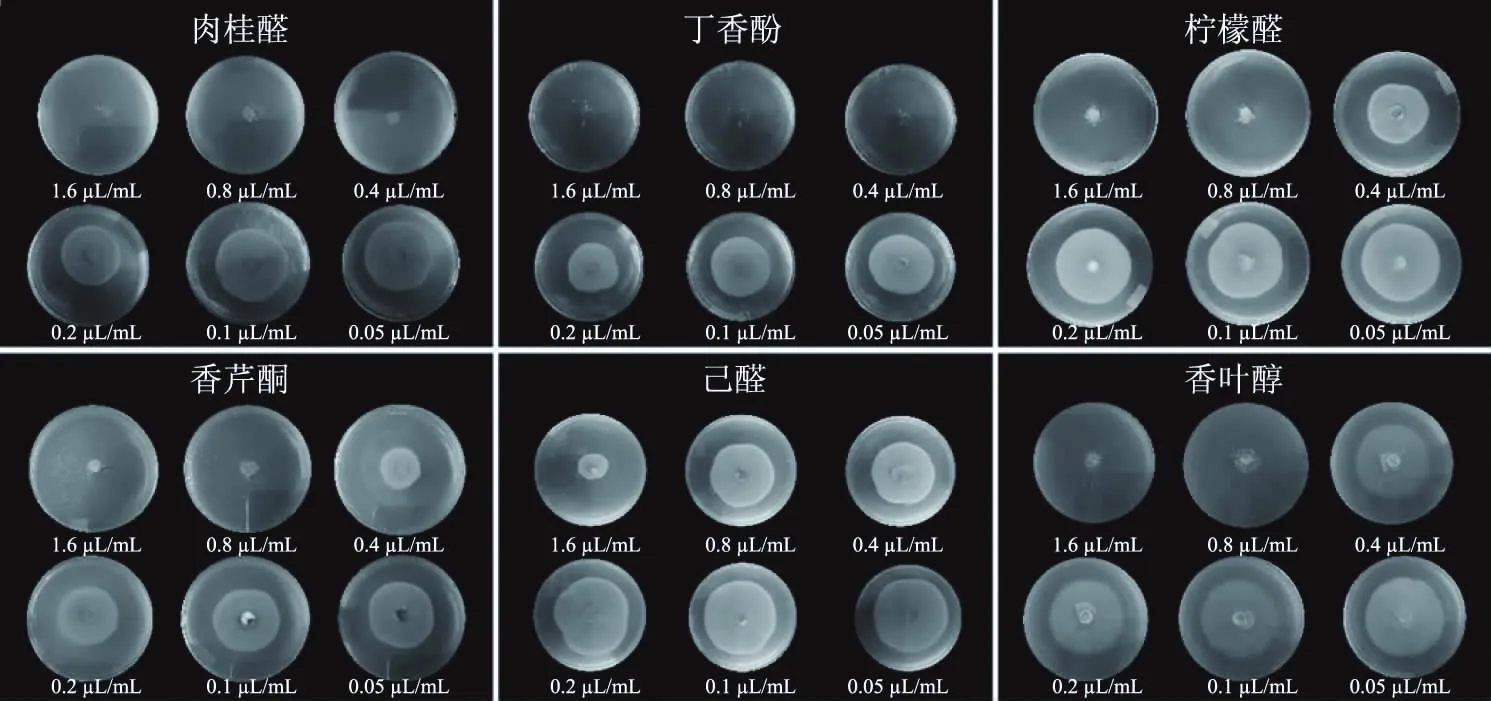
图1 不同精油对C. gloeosporioides的抑制效果(6 d)Fig.1 Inhibitory effect of different essential oils on growth of C. gloeosporioides(6 d)
1.2.2.3 核酸释放量的测定 在1.2.2.1所述的菌液中分别加入浓度为CK、EC50和MIC的肉桂醛,以等体积无水乙醇助溶,26 ℃,125 r/min培养 0.0、15.0、30.0、60.0、90.0 min后取样,12000 r/min离心2 min[19],取上清液于260 nm处测定吸光度为核酸释放量。
1.2.2.4 细胞外电导率和pH测定 在1.2.2.1所述菌液中分别加入浓度为CK、EC50和MIC的肉桂醛,以等体积无水乙醇助溶,26 ℃,125 r/min培养 0.0、15.0、30.0、60.0、90.0 min后取样,使用pH计和电导率测定仪[19]测定细胞外pH和电导率。
1.2.2.5 麦角固醇和MDA的测定 在1.2.2.1所述的菌液中分别加入浓度为CK、EC50和MIC的肉桂醛,以等体积无水乙醇助溶,26 ℃,125 r/min培养0.0、15.0、30.0、60.0、90.0 min后取样,12000 r/min离心2 min[19],严格按照试剂盒说明,采用ELISA法测定上清液中麦角固醇和MDA的含量。
1.2.3 肉桂醛与果蜡复合溶液涂膜对芒果保鲜效果的测定 在采购的芒果中挑选成熟度一致的个体,通过浸入1%次氯酸钠溶液(V/V)中2 min对新鲜水果进行表面灭菌[20],然后用蒸馏水洗涤。风干后用枪头刺破芒果赤道处表皮,接种含C.gloeosporioides孢子为105个/mL的生理盐水10 μL后再次风干,在溶有0 MIC、1 MIC或10 MIC肉桂醛的果蜡中浸润后,取出风干成膜,每袋3枚芒果,设置无果蜡处理的空白对照,每两天测定果实的可溶性固形物、可滴定酸、硬度、病情指数和腐败率。
1.2.3.1 果实可溶性固形物测定 参照NY/T 2637-2014中对折射仪测定水果中可溶性固形物含量的方法[21],采用手持糖度计测定,数值表示为20 ℃的质量分数(%)。
1.2.3.2 果实可滴定酸测定 参照GB/T 12456-2008中对水果总可滴定酸测定方法的描述[22],取20.0 g芒果果肉和10 mL蒸馏水置于组织捣碎机中捣碎,13000 r/min离心15 min取上清液30 mL,加入3滴酚酞,用0.1 mol/L NaOH滴定至微红,30 s不褪色,取3次平均值。
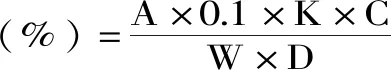
式中:A:消耗NaOH量(mL);C:稀释总量100 mL;W:样品重量20 g;D:测定取样量30 mL;K:苹果酸换算系数为0.067。
1.2.3.3 果实硬度的测定 参照NY/T 2009-2011中对水果硬度的测定要求[23],削去芒果果实赤道处的果皮,用GY-3硬度计测定其硬度,单位为0.1 MPa,每枚测定3 次取平均值。
1.2.3.4 人工接菌后果实病情指数和腐烂率统计 果实病情按果实表面的病斑大小分级,其中0级:表面无病斑;1级:表面可见针头大小的病斑;2级:病斑面积不超过表面积的1/5;3级:病斑面积占表面积的1/5~1/2;4级:病斑面积超过表面积的1/2[24]。以没有商品价值的2~4级果的百分率为果实腐烂率。
病情指数(%)=[∑(病级果数×该级代表数值)]/(调查总果数×最高级代表数值)×100
1.3 数据处理
所有测试都设计三次独立实验,所有参数均表示为平均值±标准偏差。使用单因素方差分析和Duncan检验进行方差分析,使用SPSS(23版)统计软件包分析平均值之间差异的显著性。图表由Origin Pro 8.0处理。
2 结果与分析
2.1 不同精油的抑菌效果测定
6种精油对C.gloeosporioides菌丝生长的抑制效果结果如图1所示,随着浓度的增加,各精油的抑制效果均有所增加,且同一浓度的不同精油抑制效果明显不同,说明不同精油对C.gloeosporioides的抑制效果显示较大差异。
测定其MIC,结果如表1所示。从表1中可看出,6种精油对C.gloeosporioides的菌丝生长都表现出了一定的抑制作用,其中以肉桂醛和丁香酚的效果最好,MIC均低至0.4 μL/mL;其次柠檬醛的MIC为0.8 μL/mL,也表现出了较强的抑制效果;香芹酮和香叶醇的抑制效果相较于前三者来言较差,MIC高达1.6 μL/mL;抑制效果最差的精油为己醛,在实验所设置的浓度梯度下未测得MIC。
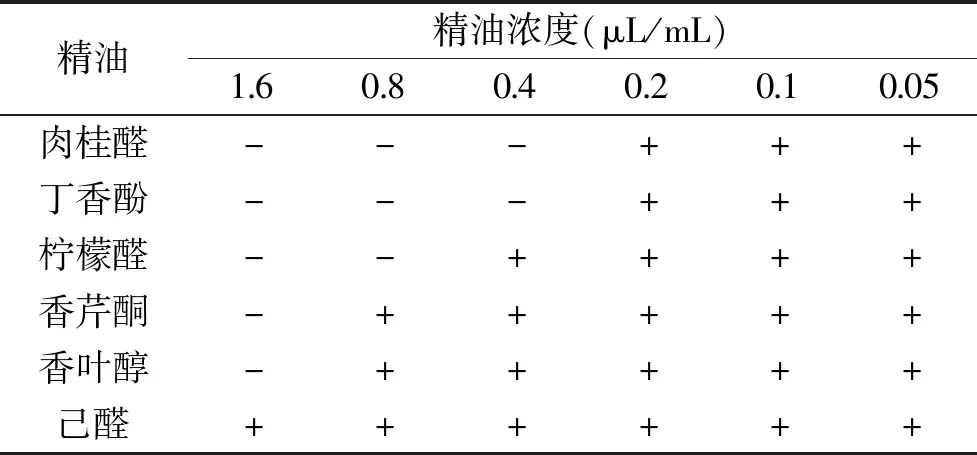
表1 不同精油对C. gloeosporioides的MICTable 1 MIC of different essential oils against C. gloeosporioides
注:香叶醇浓度为6、3、1.5、0.75、0.375、0.1875 μL/mL,大于1.5 μL/mL的浓度为阴性,为作图方便近似取1.6 μL/mL。
以MIC筛选出肉桂醛、丁香酚、柠檬醛、香芹酮对C.gloeosporioides抑制效果比较理想,因此,进一步测定了第6 d时不同质量浓度下上述几种精油对C.gloeosporioides的抑菌活性,结果见图2,并建立其毒力回归方程,计算EC50,结果见表2。
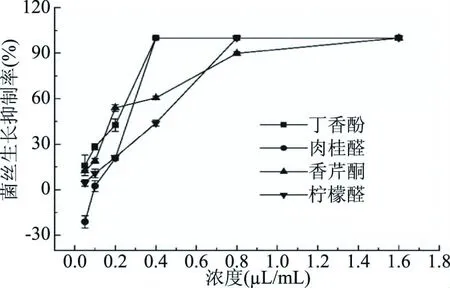
图2 不同精油对C. gloeosporioides的抑制率(6 d)Fig.2 Inhibition rate of different essential oils against C. gloeosporioides(6 d)
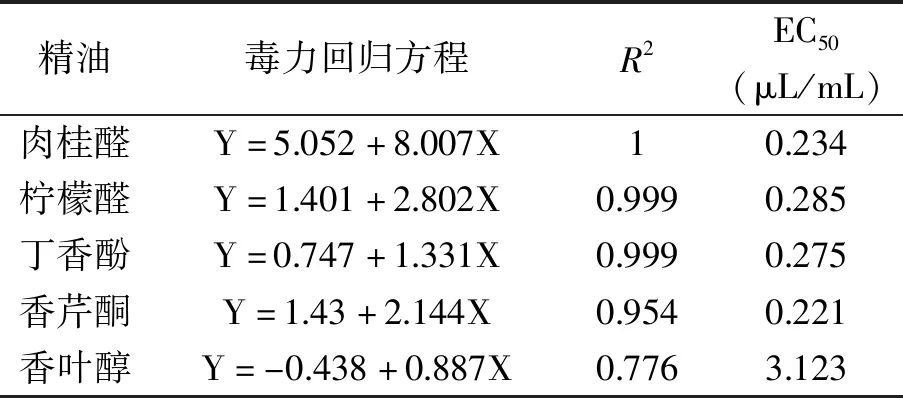
表2 不同精油对C.gloeosporioides的毒力回归方程及EC50Table 2 Virulence regression equation and EC50 of different essential oils against C.gloeosporioides
由表2所展示的EC50可知,对C.gloeosporioides抑制效果最强的为香芹酮,肉桂醛、丁香酚、柠檬醛和香叶醇次之。毒力回归方程斜率的大小往往说明目标菌对供试精油敏感性的分布,即在EC50值相似情况下,若斜率不同,即在高或低剂量时,抑制率会出现较大差异的现象[25]。因此,虽然4种精油的EC50相差不大,但是肉桂醛所展示出了较高的浓度敏感性和较低的MIC,可以认为肉桂醛是6种供试精油中效果最好、最安全且最有可能广泛应用的精油品种。本研究中肉桂醛的EC50和MIC分别为0.234和0.4 μL/mL。这些结果与柳凤等[26]、何衍彪等[27]描述肉桂醛抗菌活性的研究结果一致[25]。同时结合GB 2760-2014[28]中对肉桂醛使用量的要求,说明肉桂醛是一种有前景的植物源杀真菌剂。
2.2 肉桂醛的抗真菌机理
2.2.1 肉桂醛对C.gloeosporioides细胞膜完整性的影响 如图3所示,图片清楚显示,不同处理方式在C.gloeosporioides菌丝之间造成了明显差异。经PI染色后,对照菌丝几乎不发出红色荧光,而经2 MIC肉桂醛处理后的C.gloeosporioides菌丝则呈现高强度的红色荧光,这说明肉桂醛处理后的C.gloeosporioides菌丝细胞膜的通透性明显提高,表现出细胞死亡现象,且表现出一定的浓度依赖性。证明较高浓度的肉桂醛可以明显造成菌丝细胞膜的通透性的变化,继而实现PI对核酸的结合。我们的结果与先前肉桂醛对黄曲霉菌的抑制机理的报道结果类似[29]。由此我们推测肉桂醛抑制C.gloeosporioides的潜在作用机制可能是通过改变其细胞膜的通透性造成细胞的死亡。

图3 芒果炭疽菌PI菌丝染色Fig.3 PI hyphae staining of C. Gloeosporioides
2.2.2 肉桂醛对核酸释放量的影响 菌丝在接触肉桂醛后,细胞内核酸的释放明显增加。在处理15 min后,EC50组的OD260值为0.369,显著高于对照组(P<0.05),但显著低于MIC组(P<0.05),这说明随着肉桂醛浓度的升高,膜的破坏作用越明显。用肉桂醛MIC和EC50处理的C.gloeosporioides悬浮液的OD260值在暴露15 min后保持平滑的上升趋势,但在60 min后略有下降,推测是长时间处理使细胞某些酶泄露使核酸降解。
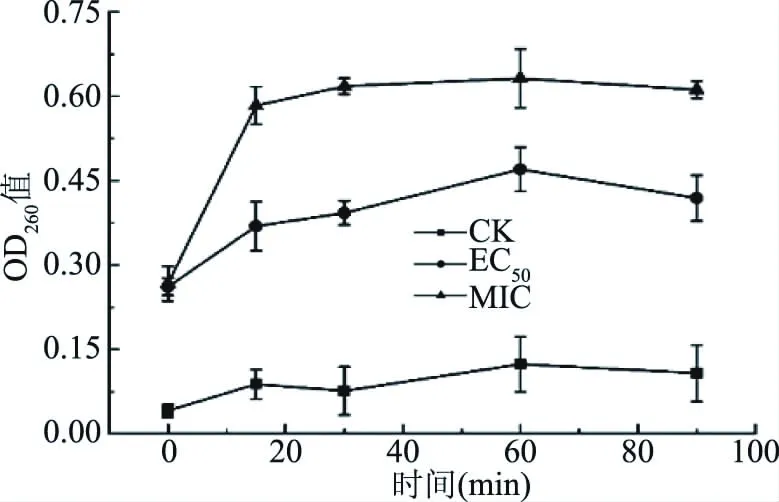
图4 不同浓度肉桂醛对C. gloeosporioides培养液中OD260值的影响Fig.4 Effects of different concentrations of cinnamaldehyde on the absorbance at 260 nm culture solution of C. gloeosporioides
2.2.3 肉桂醛对细胞外电导率的影响 如图5所示电导率随着接触时间的增加而增加。在接触30 min时,EC50组的电导率为172.90 μS/cm,显著高于对照组(P<0.05),但显著低于MIC组(P<0.05)。肉桂醛MIC和EC50处理的C.gloeosporioides悬浮液的电导率值在暴露15 min后保持平滑的上升趋势,并在60 min时达到顶峰,EC50和MIC组的电导率分别为189.80和193.27 μS/cm,但在60 min后略有下降,这与OD260的测定结果相似,推测是长时间处理使细胞某些脂类物质泄漏,与液体中的部分离子结合,造成电导率的下降。
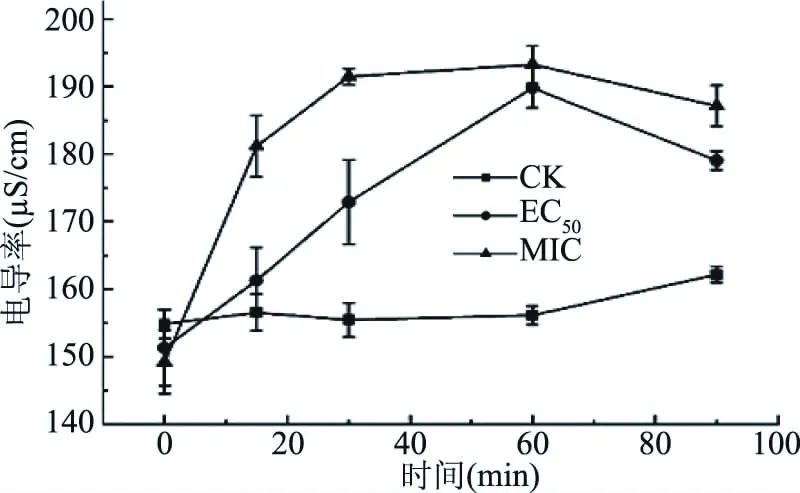
图5 不同浓度肉桂醛对C. gloeosporioides培养液中电导率的影响Fig.5 Effects of different concentrations of cinnamaldehyde on the conductivity of culture solution of C. gloeosporioides
2.2.4 肉桂醛对细胞外pH的影响 加入肉桂醛后,细胞外pH急剧下降。这可能是由于肉桂醛较活泼,易在实验时被空气氧化为肉桂酸,故而引起细胞外pH的明显下降,显著低于对照组(P<0.05)。在15~30 min后,肉桂醛溶解和氧化已达到平衡,此后阶段pH的上升,反映的是胞内碱性物质外漏导致的pH上升,所以肉桂醛处理菌丝体后,导致细胞内碱性物质的外漏使得胞外pH呈现明显的上升趋势,虽然对照组的细胞外pH也呈现一定的上升情况,但MIC组的斜率明显高于对照组。

图6 不同浓度肉桂醛对C.gloeosporioides培养液中pH的影响Fig.6 Effects of different concentrations of cinnamaldehyde on the pH of culture solution of C.gloeosporioides
2.2.5 肉桂醛对麦角甾醇含量的影响 细胞膜的主要成分为脂质,细胞外脂质含量的增高通常表明膜稳定性降低,麦角甾醇作为真菌特有的主要甾醇成分,负责维持细胞的功能和完整性。由图7可知,经过肉桂醛处理后,培养液中的麦角甾醇含量明显持续增加,在0~90 min持续增加,而未经处理的细胞含量虽有小幅波动,但总体保持稳定。在处理15 min后,EC50组(221.56 ng/L)和MIC(235.61 ng/L)培养液中的麦角甾醇含量显著高于对照(170.94 ng/L)(P<0.05),随着暴露时间的增加,差距一直显著(P<0.05)。说明细胞膜上的甾醇很可能被反应而解离,由此造成细胞膜通透性的增强;且麦角甾醇含量上升斜率随时间有减小的趋势,说明肉桂醛和某些破坏正常甾醇生物合成途径的杀菌剂,例如抑霉唑、噻苯达唑、嘧霉胺等可能有同样的作用途径[19]。但是EC50组和MIC组的麦角甾醇含量没有显著差异(P>0.05),没有表现出浓度依赖性,推测是因为EC50和MIC的浓度差距不显著导致。
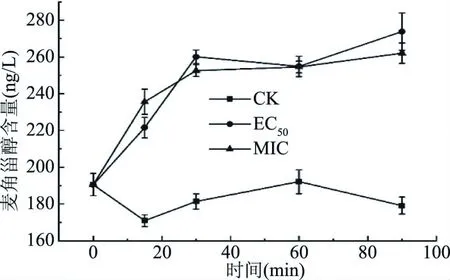
图7 不同浓度肉桂醛对C. gloeosporioides培养液中麦角甾醇含量的影响Fig.7 Effects of different concentrations of cinnamaldehyde on the ergosterol content of culture solution of C. gloeosporioides
2.2.6 肉桂醛对MDA含量的影响 MDA作为一种脂质氧化产物,其含量往往可以反映生物脂质过氧化的程度,间接反映出细胞膜损伤的程度。由图8可知,经过肉桂醛处理后,培养液中的MDA含量显著增加(P<0.05),在0~90 min呈现一定的上升趋势,而在对照组中呈现总体保持稳定和小幅下降趋势。在处理15 min时,EC50(4.29 nmol/L)组和MIC(4.34 nmol/L)培养液中的MDA含量显著高于对照(3.07 nmol/L)(P<0.05),随着暴露时间的增加,差异一直显著(P<0.05)。表明在细胞膜上发生了脂质的过氧化的反应。结合先前发现培养液中麦角甾醇含量的上升,说明肉桂醛与细胞膜的作用机理可能是引发膜上脂质的过氧化反应而导致膜损伤。但是EC50组和MIC组的MDA含量没有显著差异(P>0.05),没有表现出浓度依赖性,与麦角甾醇情况类似,推测是因为EC50和MIC的浓度差距不显著导致。
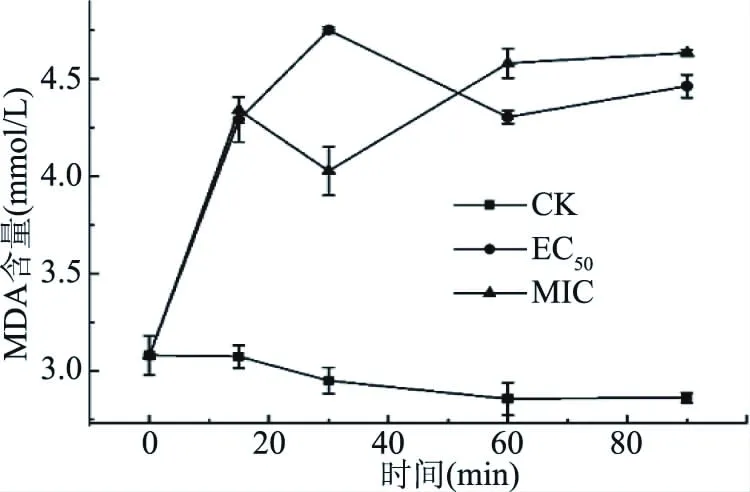
图8 不同浓度肉桂醛对C. gloeosporioides培养液中MDA含量的影响Fig.8 Effects of different concentrations of cinnamaldehyde on the MDA content of culture solution of C. gloeosporioides
2.3 肉桂醛-果蜡复合涂膜对芒果果实保鲜效果的影响
2.3.1 对芒果可溶性固形物的影响 不同浓度肉桂醛-果蜡复合涂膜对芒果果实的可溶性固形物的影响如图9所示,3个实验处理组和空白对照组的可溶性固形物含量呈波动下降趋势。在实验前期(0~6 d),4组芒果可溶性固形物含量均呈下降趋势;第6 d之后,CK和1 MIC组可溶性固形物含量有所上升,且差异不显著(P>0.05)。可能是芒果贮藏期内其果实的淀粉等多糖类物质在代谢过程中转化为可溶性低聚糖,原果胶转化为可溶性果胶,从而使可溶性固形物含量升高;而在实验后期,1 MIC和10 MIC组可溶性固形物含量有所上升,差异同样不显著(P>0.05)。实验结束时CK、0 MIC、1 MIC和10 MIC组的可溶性固形物含量分别为11.7%、11.67%、12.93%和12.23%,且各组间均差异不显著(P>0.05)。表明芒果贮藏过程中肉桂醛和果蜡处理的浓度对可溶性固形物含量影响不大,保持了芒果正常的甜度变化。
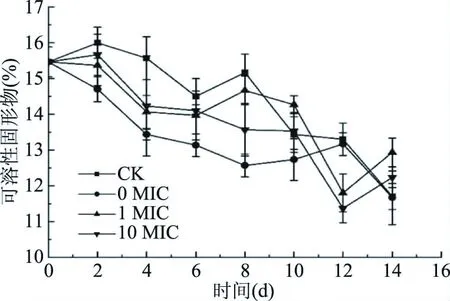
图9 不同处理对芒果可溶性固形物含量的影响Fig.9 Total soluble solid content of mango inoculated with C. Gloeosporioides under different treatment
2.3.2 对芒果可滴定酸的影响 从图10可知,芒果中可滴定酸随时间先下降后轻微上升,其中10 MIC和1 MIC相较于0 MIC和对照组先开始上升。在第4 d后,对照组可滴定酸含量和涂膜组实在保持较显著差异(P<0.05)。在第10 d后,10 MIC组的可滴定酸含量还维持在0.2%以上的水平,且与其余实验组有显著性差异(P<0.05)。
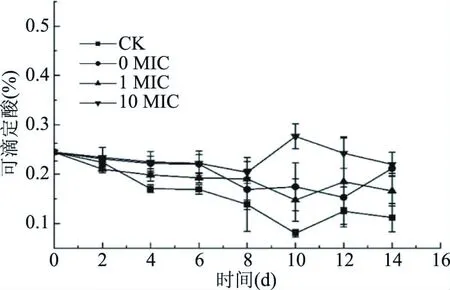
图10 不同处理对芒果可滴定酸的影响Fig.10 Titratable acid content of mangoes under different treatment
2.3.3 对芒果硬度的影响 由图11可知,芒果硬度随贮藏时间的变化呈现先下降后上升,最后趋于平稳的趋势。对照组在贮藏第6 d时,与其余实验组相比,硬度下降的程度达到了显著差异水平(P<0.05),即0.609 kg/cm2;而实验组间在前6 d时硬度下降没有显著差异。从整个贮藏阶段来看,3个涂膜组的硬度总体比对照组的要大,尤其是10 MIC组,其变化情况比其他组较平缓,并在12 d后,与其他实验组相比仍保持较高硬度(P<0.05)。结合上节对可滴定酸的测定,10 MIC处理组与对照组相比,可以保持芒果较高的硬度和酸度(P<0.05),同时实验组间表现出来一定的浓度依赖性。
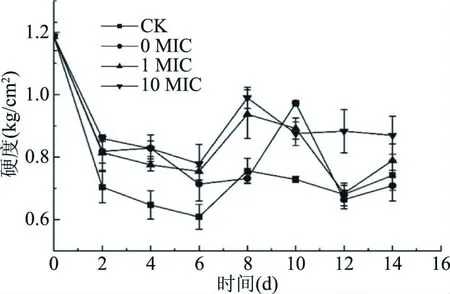
图11 不同处理对芒果硬度的影响Fig.11 Hardness of mangoes under different treatment
2.3.4 对芒果病情指数的影响 由病情指数评价芒果病变情况,由图12可知,实验组一定程度上延缓了病情指数的上升,对照组和0 MIC组贮藏6 d病变指数为50,而添加肉桂醛的1 MIC和10 MIC均保持较低水平(P<0.05)。第6 d后,对照组的的病情指数保持平稳,而3组涂膜处理的芒果均产生明显上升,在第12 d后,0 MIC和1 MIC组的病情指数达到66.7和50,10 MIC组也在第14 d达到66.7。
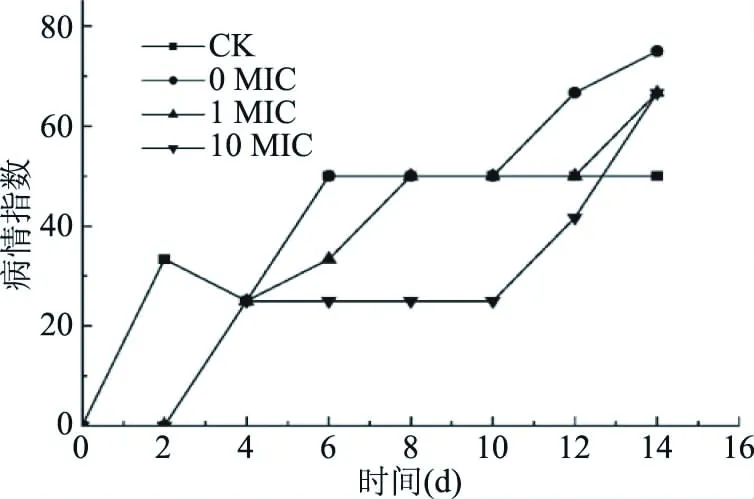
图12 不同处理对芒果病情指数的影响Fig.12 Condition index of mangoes under different treatment
2.3.5 对芒果腐败率的影响 由图13可知,对比空白对照组,处理组的芒果有效延缓腐败。在第4 d时,空白组有33.3%的芒果发生腐败,而涂膜处理的芒果仍保持较高的品质(P<0.05);在第6 d时,对照组芒果全部腐败,而涂膜处理组仍保持较低腐败率(P<0.05);第8 d后,0、1、10 MIC的腐败情况出现肉桂醛浓度依赖现象,1 MIC组的腐败率为66.67%,显著低于10 MIC组(0%)且显著高于0 MIC组(P<0.05)。最后所有实验组芒果在第14 d腐败完全,失去可食用性,如图14所示,且相比空白组在第6 d已经失去可食用性,10 MIC处理组将果实货架期显著延长一倍以上。

图13 不同处理对腐败率的影响Fig.13 Rate of corruption of mangoes under different treatment
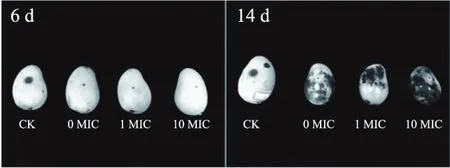
图14 不同处理对芒果腐败的抑制情况Fig.14 Corruption inhibition of mangoes under different treatment
但是另外重要的一点是,由图14可以看出,在前期(6 d左右)肉桂醛的确可以抑制C.gloeosporioides在芒果表面的生长从而抑制腐败,可是在贮藏后期,肉桂醛和果蜡处理组的芒果表面出现大量的黑斑,但是所接种的C.gloeosporioides并没有生长,而空白组并没有出现类似的黑斑。推测可能是由于涂层对于芒果表面呼吸和水分散失的阻碍,导致芒果内部代谢的有毒物质积累,造成芒果外部感官品质的下降,阻碍了更长货架期的实现[30]。以上结果证明虽然肉桂醛对C.gloeosporioides的抑制效果明显,但是具体的应用方式还需更细致的实验确定。
3 结论
在供试的几种精油中,肉桂醛对芒果胶孢炭疽菌表现出了最强烈的抗菌活性,EC50和MIC值分别为0.234和0.4 μL/mL,其抗菌活性可以归因于造成细胞膜上脂类物质的氧化,导致膜完整性和膜渗透性的破坏,继而引发细胞破裂和死亡。将肉桂醛与果蜡复合处理可以显著降低芒果常温贮藏时的腐败率,同时对果实品质影响较小,甚至可能诱导了芒果的某些防御反应,增强其抑菌防腐性能。肉桂醛作为植物的天然代谢产物,其具有对真菌的良好的抑制特性和对人体无毒或低毒的特点,有着良好的应用前景。
