灰飞虱中IKK相关基因的鉴定及其在水稻条纹病毒侵染中的功能
2020-03-31鲁燕华亓玉华叶庄新李俊敏陈剑平
鲁燕华, 卢 刚, 亓玉华, 叶庄新, 李俊敏, 陈剑平,*
(1. 浙江农林大学农业与食品科学学院, 浙江临安 311300; 2. 宁波大学植物病毒学研究所, 浙江宁波 315211)
灰飞虱Laodelphaxstriatellus属半翅目(Hemiptera)飞虱科(Delphacidae),是稻飞虱的一种,主要为害禾本科植物(蔡邦华等, 1964)。灰飞虱广泛分布于东亚、东南亚、欧洲、北非等地,中国各省均有发生,以长江中下游和华北稻区发生较多、危害最为严重。除直接取食汁液危害作物之外,灰飞虱还是多种植物病毒的传播媒介,如水稻条纹病毒(rice stripe virus, RSV)和水稻黑条矮缩病毒(rice black-streaked dwarf virus, RBSDV)等,严重影响我国粮食生产安全(浦茂华, 1963)。灰飞虱的生命周期分为卵、若虫、成虫3个阶段。在解剖镜下观察发现,灰飞虱的卵呈香蕉形,并且以卵块或单位卵的形式产在水稻植株下部的叶鞘内或叶片组织中,抽穗后产卵于穗颈部内,卵期约7~11 d。灰飞虱产卵量大,每头雌成虫产卵可达100~300余粒,产卵期可持续数天。初产颜色为乳白色,后期淡黄色(王柳风等, 2013)。灰飞虱取食危害时分泌的“蜜露”,富含多种糖类和氨基酸,覆盖在植株上,会引起真菌的滋生,导致稻穗发黑及霉变,严重影响水稻品质和产量(刘向东等, 2006)。近年来,灰飞虱传播的水稻病毒病逐年加重,加上农药滥用引起的灰飞虱抗药性问题愈发突出,因此研究灰飞虱体内抗病毒过程中的相关基因功能,可为防控水稻病毒病提供科学依据。
在动物抗病反应中,核转录因子(nuclear factor kappa B, NF-κB)和干扰素(interferon, IFN)控制重要的信号级联,介导了许多促炎细胞因子的转录表达,如炎细胞因子、粘附分子、生长因子及抗凋亡存活蛋白等(Mercurioetal., 1997; Rothwarfetal.,1998)。IκB激酶(IKK)及相关激酶是这些抗病通路的调节因子(DiDonatoetal., 1997; Pham and Tenoever, 2010)。在未受外界刺激的正常细胞中,NF-κB与其抑制因子IκB结合,细胞处于静息状态,被隔离在细胞质中。而当细胞受细胞因子或病原物刺激时,信号便通过细胞表面受体将信号转化到IKK复合物上,IKK被激活导致 IκB磷酸化并通过泛素化酶识别使其降解(Karin and Ben, 2000),与其结合的NF-κB被释放出来,并从细胞质中易位至细胞核激活靶基因的表达,产生应激及免疫反应。IKK复合物是丝氨酸/苏氨酸蛋白激酶家族成员,一般认为由IKKα, IKKβ及NEMO(IKKγ)3个亚基组成。IKKα和IKKβ具有较高的序列同源性和相似的结构,N末端均含有蛋白激酶区,因此具有丝氨酸蛋白激酶活性,可催化底物IκB发生磷酸化(Rothwarf and Karin, 1999)。近几年,另外两种与IKKα和IKKβ序列相似的IKK相关激酶也已被鉴定出,即IKKE(或称为IKK-i)和TBK1(TANK-binding kinase 1)[或称为NF-κB activated kinase (NAK)或TRAF2-associated kinase (T2K)](Tojimaetal., 2000)。IKKE和TBK1在NF-κB信号通路活化过程中与经典的IKK(IKKα和IKKβ)一样都具有磷酸化靶点的作用,因此多把IKKE和TBK1称为NF-κB的额外活化激酶,或者叫非经典IKKs(Kimetal., 2013)。两者均具有保守的蛋白结构域,都包含一个N端激酶区域,一个羧基端亮氨酸拉链结构和一个螺旋-环-螺旋结构及一个C末端的NEMO结合域(Nakatsuetal., 2014)。TBK1作为通路的重要分子,在机体抗病毒、抗菌免疫以及信号传导调控等方面均发挥着重要作用。敲除小鼠的TBK1基因,可导致小鼠的肝细胞凋亡,引起胚胎死亡(Bonnardetal., 2000)。而在细胞水平TBK1的过表达能够引起经典的IKKβ以及NF-κB的激活(Kumaretal., 2011)。
目前关于IKK基因的相关研究主要集中在哺乳动物及模式昆虫(如黑腹果蝇Drosophilamelanogaster, 埃及伊蚊Aedesaegypti)中,而在灰飞虱等植物病毒传毒介体中还未见任何报道。本研究以灰飞虱为研究对象,从其基因组中筛选鉴定了灰飞虱的IKKα和TBK1,明确了其在灰飞虱不同发育阶段及组织中的表达,并初步研究了其在RSV侵染过程中的功能,这些结果为进一步深入研究NF-κB免疫通路在植物病毒传毒介体中的功能提供了丰富信息。
1 材料与方法
1.1 材料
1.1.1植物材料:所用的水稻品种为武育粳3号,将水稻种子置于塑料筐并用自来水冲洗数次后浸泡,放置于30℃人工气候培养箱浸种24 h;催芽1~2 d,每天及时更换浸种用水。待种子发芽后播种于透明玻璃烧杯中,盖上透气纱网培养。
1.1.2供试虫源:本研究中所使用的灰飞虱有两个种群,分别为无毒(RSV-free)及RSV侵染(RSV-infected)的灰飞虱,均为江苏省农业科学院周益军实验室惠赠。带毒灰飞虱种群的带毒率利用RSV外壳蛋白(coat protein, CP)进行检测,引物序列见表1。实验室带毒灰飞虱种群经多代纯化筛选,带毒率稳定在80%~90%。同时每个月在无毒灰飞虱种群中随机抽取50头灰飞虱进行病毒检测,保证种群未受RSV污染。灰飞虱种群维持在常规粳稻(武育粳3号)上,于人工气候室饲养。灰飞虱种群的饲养条件为: 26±1℃,光周期16L∶8D,相对湿度75%。每隔7 d更换一次水稻苗。
1.1.3试剂: DNA Marker, RNA Free H2O和TAE缓冲液等购自上海生工生物公司;琼脂糖购自翊圣生物公司;KOD FX Neo高保真扩增酶购自TOYOBO公司;Trizol试剂盒购于赛默飞生物公司;氯仿购于上海凌风化学试剂有限公司;cDNA逆转录试剂盒购自天根生物公司;T7 RiboMAXTMExpress RNAi System试剂盒购于西格玛奥德里奇(上海)贸易有限公司;qRT-PCR试剂ChamQ SYBR® qPCR Master Mix购于诺唯赞生物公司;酒精等其他试剂均为国药集团化学试剂有限公司产品。
1.2 灰飞虱IKK相关基因的鉴定及生物信息学分析
利用其他昆虫的IKK相关基因,包括黑腹果蝇D.melanogaster的IKKβ(GenBank登录号: NM_080012.4),IKKγ(GenBank登录号: NM_001259574.2, NM_079132.4),IKKE(GenBank登录号: NM_165337.2, NM_136204.3), 白蚁Cryptotermessecundus的IKKα(GenBank登录号: XP_023711368.1)和烟粉虱Bemisiatabaci的TBK1(GenBank登录号: XM_019046304.1)为诱饵序列,与新建立的灰飞虱基因组本地库(Zhuetal., 2017)进行Blast同源比对(设置e值<10-5),鉴定并明确灰飞虱中IKK相关基因的核苷酸ORF序列及对应的氨基酸序列。进一步利用NCBI保守结构域数据库预测IKK相关基因ORF中的保守结构域;在NCBI中寻找相应基因的同源序列,利用BioEdit软件(版本: 7.0.9.0)进行同源序列比对;最后利用MEGA 7.0中邻接法(neighbor-joining method)构建系统发生树(bootstrap值为1 000次)。

表1 本研究所用引物信息Table 1 Information of primers used in this study
1.3 灰飞虱样品收集、RNA提取及cDNA合成
以无毒及RSV带毒灰飞虱为材料, 收集卵、 低龄若虫(1-3龄)、高龄若虫(4-5龄)、雄成虫和雌成虫不同发育阶段样本。其中,卵的收集是将处于产卵期的雌成虫转移至健康水稻苗上,2~3 d后,将水稻取出转移至解剖镜下收集产在茎基部的虫卵。收集灰飞虱成虫肠道、唾液腺、卵巢(雌成虫)、血淋巴、脂肪体和精巢(雄成虫)等不同组织。不同发育阶段及组织的灰飞虱样品均设3个生物学重复,每个生物学重复取10头灰飞虱个体。
收集的新鲜样品立即放入液氮冷冻,按Trizol试剂盒说明提取样品总RNA,并利用RNA电泳和蛋白核酸定量分析仪检测其质量。以上述提取的RNA为模板参照诺唯赞公司反转录试剂盒HiScript II Q Select RT SuperMix for qPCR说明书,用两步法反转录获得cDNA第1链。
1.4 RT-PCR检测IKK相关基因在无毒灰飞虱中的表达
根据1.2节得到的灰飞虱IKK相关基因的核苷酸序列设计引物,IKKα和TBK1的引物序列见表1。以灰飞虱的18S rRNA(GenBank登录号: JF773149.1)序列作为阳性对照,18S rRNA的引物序列见表1。以ddH2O作为阴性对照(CK)。用1.3节合成的无毒灰飞虱cDNA第1链为模板进行RT-PCR,明确IKKα和TBK1基因在灰飞虱不同发育阶段及各个组织中是否表达。PCR反应体系(10 μL): 2×HieffTMPCR Master Mix (with Dye) 5 μL, 上下游引物(0.2 μmol/L)各0.3 μL, cDNA模板1 μL, ddH2O 3.4 μL。反应程序: 94℃预变性3 min; 94℃ 30 s, 60℃ 30 s, 72℃ 2 min 40 s, 35个循环; 72℃ 10 min。用4 μL的2K Plus DNA Marker,取5~7 μL PCR产物经1%(m/v)的琼脂糖凝胶电泳检测。将含有目的条带大小的回收产物送往擎科(杭州)生物公司进行DNA测序,测序正确后于-80℃保存或用于下一步dsRNA合成。
1.5 qRT-PCR检测IKK相关基因在RSV带毒和无毒灰飞虱中的表达
设计IKKα和TBK1基因的定量PCR引物,IKKα的引物序列见表1,引物扩增效率为98.3%。TBK1的引物序列见表1,引物扩增效率为90.5%。以灰飞虱actin(GenBank登录号: AY192151.1)为内参基因,引物序列见表1。以1.3节合成的无毒和带毒灰飞虱不同发育阶段及成虫各个组织cDNA第1链为模板,使用SYBR® Green Real-time PCR Master Mix进行qRT-PCR。反应体系(10 μL): 上下游引物(0.2 μmol/L)各0.3 μL, cDNA模板0.4 μL, ddH2O 4.0 μL。反应条件: 94℃ 4 min; 94℃ 15 s, 60℃ 15 s, 72℃ 20 s, 40个循环,用溶解曲线来确定扩增片段的特异性。
1.6 RNAi干扰RSV侵染后的灰飞虱中的IKK相关基因
通过PCR在目的基因序列两端添加T7启动子,dsGFP作为对照基因,按照T7 RiboMAX Express RNAi System(Promega, 美国)试剂盒说明书合成dsRNA; dsGFP, dsIKKα和dsTBK1的引物序列见表1。分别取 5~7 μL合成后的 dsRNA进行1%的琼脂糖凝胶电泳检测,检测其条带大小。确认dsRNA完整度和大小无误后,使用紫外分光光度计测定dsRNA浓度和纯度待用。取龄期一致的RSV带毒灰飞虱3龄若虫,用CO2麻醉后,选用显微注射仪对若虫第2和第3腹节之间进行注射(每头注射约100 ng dsRNA),每次至少重复20头灰飞虱。将注射dsRNA的灰飞虱若虫置于25℃室温饲养4 d后单头取样,按照1.3节方法提取RNA,反转成cDNA,-80℃保存用于后续qRT-PCR。
1.7 qRT-PCR检测RSV侵染后的灰飞虱中IKK相关基因的RNAi干扰效率及RSV病毒含量
取1.6节中RNAi处理4 d后的灰飞虱样品,利用qRT-PCR分别检测IKKα和TBK1的表达量以及带毒灰飞虱中RSV外壳蛋白的表达量变化,方法同1.5节。其中,IKKα,TBK1和RSV-CP的qRT-PCR引物序列见表1,RSV-CP的引物扩增效率为95.7%。
1.8 数据分析
实验数据使用Excel 2007和GraphPad Prism 6进行分析、处理和绘图,数据统计使用Student氏t检验方法进行分析,P<0.05表示样本间存在显著差异,P<0.01表示样本间存在极显著差异。
2 结果
2.1 灰飞虱IKK相关基因的克隆及序列分析
利用同源比对方法从灰飞虱基因组中鉴定和克隆了灰飞虱的两个IKK相关基因的ORF,经NCBI 蛋白数据库BlastX比对分析表明这两个基因为IKKα(GenBank登录号: MK903504)和TANK结合激酶1(TANK-binding kinase 1)基因TBK1(GenBank登录号: MN124506)。NCBI同源比对结果表明,与灰飞虱IKKα同源性最高的为褐飞虱NilaparvatalugensIKKα(GenBank登录号: XP_022189635.1),氨基酸序列一致性为92%;其次为堆砂白蚁CryptotermessecundusIKKα(GenBank登录号: XP_023711368.1)和西花蓟马FrankliniellaoccidentalisIKKα(GenBank登录号: XP_026290137.1),氨基酸序列一致性分别为38%和44%。与灰飞虱TBK1同源性最高的为褐飞虱TBK1(GenBank登录号: XP_022189807.1),氨基酸序列一致性为97%;其次为烟粉虱BemisiatabaciTBK1(GenBank登录号: XP_018901849.1)和茶翅蝽HalyomorphahalysTBK1(GenBank登录号: XP_014288800.1),氨基酸序列一致性分别为75%和75%。IKKαORF全长2 379 bp,编码792个氨基酸;TBK1 ORF全长1 551 bp,编码516个氨基酸(图1)。保守结构域分析结果表明,和已报道的其他动物中的IKK结构类似,灰飞虱IKKα和TBK1均具有1个保守的丝氨酸/苏氨酸激酶结构域和1个泛素折叠区域(图1),这两个功能结构域对NF-κB免疫信号通路的活化过程中具有关键作用(赵运旺, 2016)。

图1 灰飞虱IKKα和TBK1基因ORF结构示意图Fig. 1 Schematic diagram of the structures of IKKɑ and TBK1 ORFs in Laodelphax striatellus
2.2 灰飞虱IKKα 和TBK1的系统进化分析
利用NCBI中的同源序列,对不同物种IKKα和TBK1的氨基酸序列进行多重序列比对分析,并进一步构建两个蛋白的系统发生树。系统进化分析表明,IKK及其相关蛋白的系统进化树主要为两个大分支,第1个分支为IKKα,第2个分支包括IKKE和TBK1(图2)。灰飞虱的IKKα和TBK1在系统分类树中有明确的分支定位,进一步明确了灰飞虱中这两个IKK相关基因的具体分类。灰飞虱的IKKα和西花蓟马、堆砂白蚁和湿木白蚁Zootermopsisnevadensis这3种昆虫的相应基因聚类较近,而灰飞虱TBK1则与茶翅蝽、烟粉虱、柑桔木虱Diaphorinaciti具有较高的亲缘关系(图2)。

图2 灰飞虱及其他物种基于IKK相关蛋白氨基酸序列的系统进化分析Fig. 2 Phylogenetic analysis of Laodelphax striatellus and other species based on the amino acid sequences of the IKK related proteins 灰飞虱的IKKɑ和TBK1以三角符标记;分支上的数字表示1 000次重复抽样符合聚类的百分数;标尺表示每单位长度位点替代率。IKKɑ and TBK1 of L. striatellus are marked with a triangle symbol. The numbers on the branches represent the percentages of times that the species are grouped together in the bootstrap analysis for 1 000 replicates. The scale bar indicates the number of substitutions per site for a unit of branch length.
2.3 IKKɑ和TBK1在无RSV的灰飞虱不同龄期、成虫不同组织中的表达
为全面了解IKKɑ和TBK1在灰飞虱中的表达,我们利用RT-PCR方法对这两个基因在无毒灰飞虱不同发育阶段(卵期、1-5龄若虫、雄成虫和雌成虫)及成虫各个组织(肠道、唾液腺、血淋巴、脂肪体、卵巢和精巢)中的表达量进行了检测。检测结果如图3所示,在灰飞虱各个龄期及成虫组织中均能稳定扩增出IKKɑ和TBK1,表明这两个基因在灰飞虱所有龄期及成虫组织中均广泛存在并持续表达。

图3 IKKɑ (A)和TBK1(B)在灰飞虱不同龄期和成虫不同组织中的表达量Fig. 3 Relative expression levels of IKKɑ (A) and TBK1 (B) in different developmental stages and adult tissues of Laodelphax striatellusM: 2K Plus DNA Marker; E: 卵Egg; L1-5: 分别为1-5龄若虫1st-5th instar nymph, respectively; MA: 雄成虫Male adult; FA: 雌成虫Female adult; G: 肠道Gut; Sg: 唾液腺Salivary gland; Hm: 血淋巴Hemolympph; Fb: 脂肪体Fat body; Ov: 卵巢Ovary; Te: 精巢Testis; 18S: 18S rRNA, 阳性对照18S rRNA as the positive control; CK: 空白对照Blank control.

图4 RSV侵染后灰飞虱不同龄期IKKα(A)和TBK1(B)的相对表达水平Fig. 4 Relative expression levels of IKKα (A) and TBK1 (B) in different developmental stages of Laodelphax striatellus in response to RSV infectionRSV: RSV侵染 RSV-infected; RF: RSV未侵染RSV-free. E: 卵Egg; L1-5: 分别为1-5龄若虫1st-5th instar nymph, respectively; MA: 雄成虫Male adult; FA: 雌成虫Female adult. 柱上单星号和双星号分别表示同一个基因相对表达量在RF与RSV间存在显著(P<0.05)和极显著(P<0.01)差异(Student氏t检验)。Single asterisk and double asterisk above bars indicate significant (P<0.05) and extremely significant (P<0.01) difference in the gene expression level between RF and RSV, respectively, by Student’s t-test. 图5同The same for Fig. 5.
2.4 RSV侵染对IKKα和TBK1在灰飞虱不同龄期、成虫不同组织中转录水平的影响
qRT-PCR结果表明,IKKα在无毒灰飞虱各个龄期表达相对稳定,TBK1在无RSV侵染的2龄若虫中的表达量最低。带毒虫中,随着发育龄期的增加,IKKα的表达量不断升高(2龄若虫除外),IKKα和TBK1在不同龄期的表达峰值均出现在灰飞虱的雌成虫中(图4)。RSV侵染后,IKKɑ在1龄、3-5龄若虫及雌雄成虫中的表达量均较无毒虫的显著增加(P<0.05)(图4: A);而TBK1在病毒侵染后的1-2龄、4龄若虫及雌雄成虫中表达量均较无毒虫的显著上调(P<0.05)(图4: B)。两个基因在带毒雌成虫中的表达量均比无毒虫中的上调4倍以上(图4)。
对于成虫不同组织,无毒灰飞虱中IKKɑ在脂肪体和卵巢中高表达,带毒虫中除这两个组织外,IKKɑ在唾液腺也具有很高的表达量。RSV侵染后,IKKɑ的表达量在带毒虫的唾液腺、血淋巴及精巢中相对于无毒虫的相应组织中均极显著上调(P<0.01)(图5: A)。TBK1在无毒虫中仅在卵巢中高表达,而带毒虫中TBK1在唾液腺、脂肪体和卵巢相对于其他组织均为高表达。 相对于无毒虫,RSV侵染后,TBK1在唾液腺和脂肪体中均极显著上调(P<0.01)(图5: B)。 这些结果表明病毒侵染灰飞虱后期阶段IKKɑ和TBK1在昆虫的不同发育龄期及成虫不同组织中存在不同的响应模式。比较有意思的是,TBK1仅在带毒虫血淋巴中较无毒虫出现了极显著下调(P<0.01),同时病毒侵染并未对这两个基因在卵巢中的表达量产生显著影响(P>0.05)(图5: A, B)。
2.5 RNAi干扰灰飞虱IKKα和TBK1对RSV侵染的影响
为进一步研究IKKα和TBK1在病毒侵染中的作用,利用dsRNA注射方法分别对带毒灰飞虱3龄若虫中的IKKɑ和TBK1进行干扰(dsGFP作为对照)。实验结果表明,注射后4 d处理组灰飞虱中的IKKɑ和TBK1相对对照组(dsGFP)均极显著下调(P<0.01),抑制率达到近70%(图6)。同时,qRT-PCR检测对照及干扰相应基因后带毒灰飞虱中的RSV外壳蛋白的积累量(CP基因的表达量),结果表明IKKɑ被干扰后的灰飞虱及TBK1被干扰后的灰飞虱体内RSV CP积累量比对照分别极显著上调了6倍和2倍(P<0.01)(图7),表明IKKɑ和TBK1在灰飞虱NF-κB抗病毒免疫信号通路的活化过程中很可能具有重要作用。

图5 RSV侵染后灰飞虱成虫不同组织中IKKα(A)和TBK1(B)的相对表达水平Fig. 5 Relative expression levels of IKKα (A) and TBK1 (B) in different adult tissues of Laodelphax striatellus in response to RSV infectionRSV: RSV侵染 RSV-infected; RF: RSV未侵染RSV-free. G: 肠道Gut; Sg: 唾液腺Salivary gland; Hm: 血淋巴Hemolympph; Fb: 脂肪体Fat body; Ov: 卵巢Ovary; Te: 精巢Testis.

图6 分别注射IKKα(A)和TBK1(B) dsRNA后4 d带毒灰飞虱3龄若虫中靶基因的抑制效率Fig. 6 RNA interference efficiency of target genes in the 3rd instar nymphs of RSV-infected Laodelphax striatellus post injection of IKKα (A) and TBK1 (B) dsRNA, respectively, for 4 dActin为内参基因。柱上双星号表示与对照组(dsGFP注射组)比较具有极显著差异(P<0.01, Student氏t检验)。Actin is used as an internal reference gene. Double asterisk above bars indicates extremely significant difference (P<0.01, Student’s t-test) from the control group (dsGFP injection group). 图7同The same for Fig. 7.
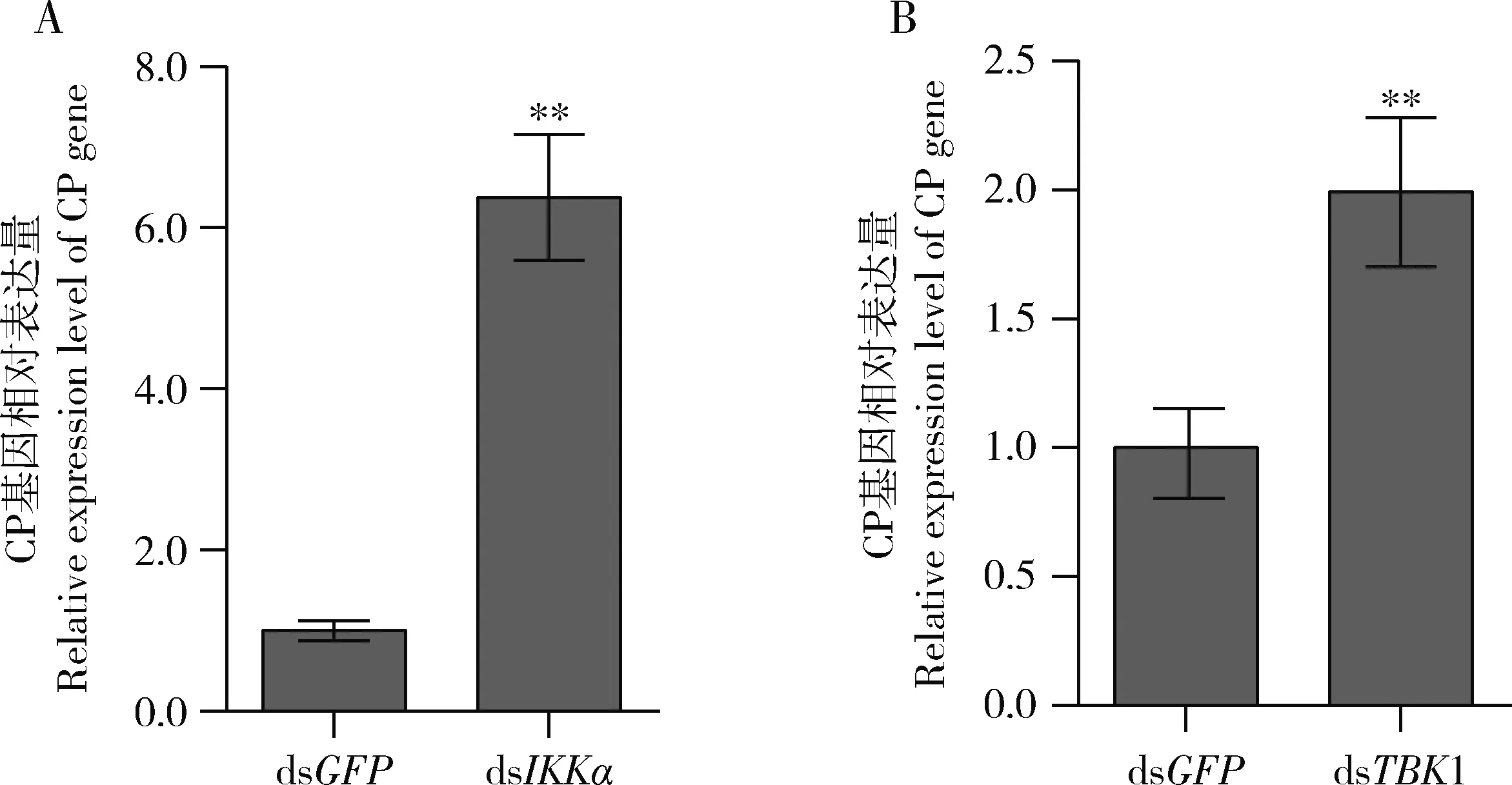
图7 分别注射IKKα(A)和TBK1(B) dsRNA后4 d带毒灰飞虱3龄若虫中RSV积累量Fig. 7 Accumulation level of RSV in the 3rd instar nymphs of RSV-infected Laodelphax striatellus post injection of IKKα (A) and TBK1 (B) dsRNA, resepectively, for 4 dRSV积累量以RSV外壳蛋白(CP)基因的表达量表示。The accumulation level of RSV is expressed as the expression level of coat protein (CP) gene of RSV.
3 讨论
脊椎动物免疫系统可分为先天免疫及获得性免疫,在脊椎动物中,病毒、细菌、真菌等病原物入侵细胞,细胞中相关蛋白受体识别病原物并激活机体先天免疫系统抵御病原物的入侵(Janeway and Medzhitov, 1998)。目前一般认为无脊椎动物体内无获得性免疫,其抵御外源病原物入侵主要依赖先天免疫系统(Wangetal., 2014)。IKK介导的NF-κB免疫信号通路的活化在无脊椎动物先天免疫中具有重要作用,NF-κB信号通路调节失控和炎症、肿瘤、发育失调等多种病症有直接关系(Liuetal., 2012)。目前,IKK及其相关基因在节肢动物中报道较少,在植物病毒传毒介体昆虫中还未见报道。
本研究从灰飞虱基因组中鉴定得到了两个IKK相关基因同源物,同源比对及系统进化分析表明这两个基因为IKKα和TBK1。虽然我们利用模式昆虫中所有已知的IKK(IKKα,IKKβ及IKKγ)及其相关基因(IKKE和TBK1)作为种子序列挖掘灰飞虱中的IKK,但在灰飞虱中并未发现IKKβ,IKKγ及IKKE这3个基因。先前果蝇中的研究表明,果蝇的IKK复合物只包含IKKβ和IKKγ,但没有IKKα(Ferrandonetal., 2007)。类似地,最新的研究表明甲壳动物泥蟹Scyllaparamamosain也只鉴定到了IKKβ和两种不同的剪切形式的IKKE(Jiangetal., 2018)。因此灰飞虱中只鉴定到IKKα和TBK1,可能是由于灰飞虱中确实不存在另外几种IKK相关基因。另外一种可能是由于目前灰飞虱的基因组还只是草图,序列信息还不够完善,还有部分基因未被充分挖掘。灰飞虱IKKα和TBK1均含有1个保守的丝氨酸/苏氨酸激酶结构域和1个泛素折叠区域,同时两个基因在灰飞虱不同发育阶段和成虫的不同组织中均广泛表达,表明在进化过程中IKK及其相关基因的功能可能较保守。
NF-κB信号通路主要由Toll和IMD两条通路组成,先前大量实验表明其能被病原菌(细菌、真菌和病毒)侵染所激活,并在昆虫体液免疫中具有重要作用(卢新民和叶恭银, 2006)。水疱性口炎病毒(vesicular stomatitis virus, VSV)侵染胚胎纤维细胞可顺利激活IκB激酶基因IKKβ的表达,进而诱导下游免疫反应,而IKKβ缺陷型细胞系则无法顺利激活NF-κB信号通路,表明IKKβ在免疫抗病毒中有重要作用(Chuetal., 1999)。后续研究表明,新发现的IKK相关基因IKKE和TBK1在病毒侵染后同样能激活NF-κB先天免疫反应,产生干扰素,抵御病毒入侵(Fitzgeraldetal., 2003)。本研究结果表明,RSV侵染灰飞虱后,IKKα和TBK1在特定龄期及组织中被激活,两个基因均在带毒灰飞虱雌成虫中上调最明显(图4),同时在成虫唾液腺、血淋巴、精巢(IKKα)或唾液腺、脂肪体(TBK1)等组织中显著上调(图5),结合RSV在灰飞虱中的卵传特点及这些组织在植物病毒顺利入侵介体昆虫及循环复制中的重要作用(刘海建等, 2007),推测IKKα和TBK1可能和灰飞虱中NF-κB介导的先天免疫抗病毒通路相关。随后的RNAi干扰实验也表明IKKα和TBK1在RSV侵染灰飞虱过程中确实发挥了重要作用。
果蝇中的最新研究结果表明,果蝇C病毒(Drosophila C virus, DCV)侵染干扰果蝇的IKKβ细胞系后,DCV的丰度相对于对照显著上调,进一步的实验表明IKKβ对调控果蝇细胞系中依赖于STING和NF-κB的抗病毒免疫通路具有重要作用;但果蝇IMD通路中的IKKγ在DCV侵染时则无此调控作用(Gotoetal., 2018)。另外,对虾白斑综合症病毒(white spot syndrome virus, WSSV)和黄头病毒(yellow head disease, YHV)侵染斑节对虾Penaeusmonodon,对虾中的IKKE1和IKKE2在侵染后6和24 h相对对照显著上调,但IKKβ在两种病毒侵染后表达量则无显著改变(Nhnhkornetal., 2019)。这些研究结果表明同一物种中不同的IKK相关基因在应对病毒侵染过程中具有不同作用。因此,本研究IKKE和TBK1在病毒侵染后灰飞虱不同组织中呈现不同的表达模式,表明NF-κB免疫通路的IKK相关基因在抗病毒免疫反应中可能具有不同的功能,且可能具有组织特异性。本研究结果为深入研究介体昆虫中NF-κB免疫通路提供了丰富信息,同时也提出了很多需要进一步研究的问题。如病毒侵染灰飞虱不同阶段各个组织中IKK相关基因的表达模式,NF-κB免疫通路下游相关基因对RSV的响应,最后是否产生抗菌肽,产生何种抗菌肽应对RSV的侵染等,这些问题的明确有助于我们进一步深入理解介体昆虫应对植物病毒的先天免疫机制。
