斑衣蜡蝉若虫寄生蜂地理种群遗传差异及早期快速检测
2020-03-30AtifMANZOOR曹亮明王小艺
辛 蓓, Atif MANZOOR, 曹亮明, 王小艺
(中国林业科学研究院森林生态环境与保护研究所, 国家林业和草原局森林保护学重点实验室, 北京 100091)
斑衣蜡蝉Lycormadelicatula分布于中国、日本、越南、韩国和美国,可危害柿属Diospyrosspp.、葡萄属Vitisspp.、猕猴桃Actinidiachinensis、香椿Toonasinensis、臭椿Ailanthusaltissima等70余种寄主植物(Barringeretal., 2015)。斑衣蜡蝉不仅直接吸食寄主植物汁液,造成寄主植物衰弱,还是柿属植物柿疯病的传播媒介(俎显诗, 1992; 宗学普和黎彦, 2005)。此外,其排泄的蜜露还可以引起煤污病影响寄主植物光合作用(Barringeretal., 2015)。近年来该害虫对我国葡萄、猕猴桃等产业造成较大损失(Wangetal., 2018),还对园林绿化产生不良影响(EPPO, 2017)。斑衣蜡蝉原产于中国、日本、越南等东南亚国家,2004年入侵韩国,现已扩散至韩国全境(Kimetal., 2011);2014年传入美国,并迅速蔓延,目前已在美国4个州发现且对当地生态环境产生了严重威胁(Leeetal., 2019)。欧洲和地中海植物保护组织(EPPO)于2017年对斑衣蜡蝉进行了风险评估,认为该害虫对欧洲具有中等入侵风险,一旦传入将对欧洲的葡萄产业造成严重经济损失(EPPO, 2017)。斑衣蜡蝉在世界范围内的扩散蔓延不仅增加了我国货物出口的贸易壁垒,同时也增加了检疫成本。
目前斑衣蜡蝉以化学防治为主,不利于保护生物多样性和自然环境(Leachetal., 2019)。利用天敌进行生物防治是控制斑衣蜡蝉种群密度,阻止柿疯病进一步传播的重要途径之一(李令军, 2014)。斑衣蜡蝉天敌已报道4种寄生蜂和2种病原微生物(周尧, 1946; 闫家河等, 2008; Yangetal., 2015; Liu and Mottern, 2017; Cliftonetal., 2019)。目前报道的若虫期天敌为螯蜂属Dryinus的布氏螯蜂D.browni,对斑衣蜡蝉具有捕食和寄生双重控制作用,分布区为北京、山东商河、河南驻马店(杨集昆, 1994; 闫家河等, 2008; Xuetal., 2013),而野外调查时发现陕西延安、江苏南京和山东泰安等地也有寄生斑衣蜡蝉若虫的螯蜂属天敌,但尚未确定其种名。目前我国对斑衣蜡蝉若虫期螯蜂属天敌的研究集中于生物学特性及人工繁殖方法等方面,评估其对斑衣蜡蝉若虫寄生率的方法有直接观察法和饲养观察法,即通过观察斑衣蜡蝉翅芽下方是否存在螯蜂卵或幼虫囊包(图1: A, B, C),或者将野外采集到的斑衣蜡蝉在实验室内进行人工饲养至天敌羽化统计寄生率(董景芳, 1987; 闫家河等, 2008)。但在寄生早期肉眼很难观察到斑衣蜡蝉体表的螯蜂卵,而将斑衣蜡蝉若虫采集带回室内饲养,可能会因为部分斑衣蜡蝉死亡造成统计的寄生率偏低。
本研究分别从北京、山东泰安、河南驻马店和江苏南京采集到斑衣蜡蝉若虫期寄生蜂,其中江苏南京并未采集到成虫样本。为明确不同地理种群斑衣蜡蝉寄生蜂种类以及其地理种群间的遗传差异,开发寄生蜂快速检测方法,准确测定其对斑衣蜡蝉的寄生率,本研究利用DNA条形码技术分别对北京、山东泰安、河南驻马店和江苏南京的斑衣蜡蝉若虫寄生蜂种群COI和28S rDNA序列进行比对,基于COI序列分析各地理种群斑衣蜡蝉若虫寄生蜂的遗传差异,并根据COI序列设计种特异性引物用于寄生蜂的快速检测,测定其对斑衣蜡蝉的寄生率,明确该若虫寄生蜂对斑衣蜡蝉的控害作用,为进一步人工利用该天敌防治斑衣蜡蝉提供基础数据。

图1 斑衣蜡蝉若虫及其寄生蜂Fig. 1 Lycorma delicatula nymphs and parasitoidA: 斑衣蜡蝉健康若虫Healthy nymph of L. delicatula; B: 被寄生早期的斑衣蜡蝉若虫(无明显囊包)Parasitized L. delicatula nymph at the early stage (without visible thalacium); C: 被寄生晚期的斑衣蜡蝉若虫(囊包明显)Parasitized L. delicatula nymph at the late stage (with visible thalacia).
1 材料与方法
1.1 供试昆虫
1.1.1螯蜂属天敌形态鉴定样本采集:斑衣蜡蝉若虫寄生蜂样本分别采集于北京、山东泰安和河南驻马店(表1),于2019年5月下旬-6月上旬分别在试验点设置黄板诱捕寄生蜂成虫,选取形态特征完整的雌、雄成虫各3头,浸泡于75%酒精中用于形态鉴定。
1.1.2中华螯蜂不同地理种群遗传差异样本采集:分别于北京、山东泰安、江苏南京和河南驻马店(表1)各地理种群中选取5头囊包明显的斑衣蜡蝉若虫将囊包解剖后获得中华螯蜂幼虫,提取DNA用于中华螯蜂不同地理种遗传分化和种特异性PCR(species-specific PCR, SS-PCR)引物检测效果的测定,在北京试验点选取5头寄生蜂成虫提取DNA作为对照。

表1 斑衣蜡蝉若虫寄生蜂样本信息Table 1 Sample information of parasitoids of Lycorma delicatula nymphs
1.1.3SS-PCR引物特异性检测样本:为测定SS-PCR引物对不同虫态中华螯蜂、未被寄生的斑衣蜡蝉若虫和不同地理种群中华螯蜂幼虫的扩增作用,分别采集中华螯蜂幼虫、被中华螯蜂寄生的斑衣蜡蝉若虫、中华螯蜂成虫和未被寄生的斑衣蜡蝉若虫。其中,从在北京试验点采集的具明显中华螯蜂囊包的斑衣蜡蝉若虫(图1: C),取其中10头保存于无水酒精中作为被中华螯蜂寄生的斑衣蜡蝉若虫样本备用;另20头置于50 mL离心管中,提供臭椿新鲜小枝供斑衣蜡蝉取食,放置于25℃、相对湿度65%±5%、光周期12L∶12D的培养箱中饲养,每日更换臭椿枝条至寄生蜂幼虫脱囊做茧,随后分别将茧剖开取出寄生蜂老熟幼虫,作为中华螯蜂幼虫样本。中华螯蜂成虫为黄板诱集后保存备用。未被寄生的斑衣蜡蝉若虫为北京地区采集到的斑衣蜡蝉卵块放置于相同条件的培养箱中,待其孵化后收集斑衣蜡蝉若虫,以确保斑衣蜡蝉若虫未被寄生。上述样品均保存于无水乙醇中用于提取DNA。
1.1.4不同地理种群斑衣蜡蝉若虫寄生率检测样本:分别在北京、山东泰安、江苏南京和河南驻马店采集2-4龄斑衣蜡蝉若虫,每个采样点随机选择两个不同的种群,每个种群50~100头,浸泡于无水乙醇中用于提取DNA。
1.2 斑衣蜡蝉若虫寄生蜂的鉴定
将1.1.1节所述的诱集到的斑衣蜡蝉若虫寄生蜂带回实验室内,利用二氯甲烷溶解其体表粘虫胶后,整姿制成标本,在蔡司Stemi 2000-C体视显微镜下进行形态学观察,并利用佳能70D照相机拍照,随后根据其寄主和形态特征进行鉴定,同时寄送螯蜂分类专家鉴定核实。
1.3 DNA提取
利用QIAGEN DNeasy® Blood and Tissues Kit试剂盒分别提取1.1节所采集的待测样本总DNA。随后利用1.2%琼脂糖凝胶电泳检测提取到的DNA的质量,并利用NanoDrop Spectrophotometer (DS-11 Envivx)测定DNA浓度,检测合格后保存于-20℃备用。
1.4 COI和28S rDNA序列PCR扩增和测序
COI和28S rDNA基因PCR扩增引物为通用引物。COI引物(Folmeretal., 1994), LCO1490: 5′-GGTCAACAAATCATAAAGATATTGG-3′; HCO2198: 5′-TAAACTTCAGGGTGACCAAAAAATCA-3′。28S rDNA引物(Campbelletal., 1993; Goolsbyetal., 2006), D2-3549: 5′-AGTCGTGTTGCTTGATAGTGCA G-3′; D2-4068: 5′-TTGGTCCGTGTTTCAAGACGGG-3′。PCR反应体系(25 μL): GoTaq® Green Master Mix (Promega)预混液12.5 μL, 上下游引物(10 μmol/L)各1 μL, 1.3节提取的不同地理种群斑衣蜡蝉若虫寄生蜂DNA模板(25~150 ng/μL) 1 μL, 9.5 μL ddH2O。COI和28S rDNA序列的PCR反应条件: 95℃预变性2 min; 95℃变性10 s, 54℃退火15 s, 72℃延伸30 s, 重复35个循环;72℃最终延伸5 min。所有PCR 反应均使用Biometra TOne 96G(Analytikjena, 德国)进行。利用1.2%琼脂糖凝胶电泳对PCR产物进行检测,选取目标条带清晰的样品送样至英潍捷基(上海)贸易有限公司利用ABI 3730测序仪(Applied Biosystens, 美国)进行双向测序。
1.5 SS-PCR中华螯蜂快速鉴定
基于1.4节测序结果,利用Primer 3(http:∥bioinfo.ut.ee/primer3/)(Koressaaretal., 2018)和NCBI Primer Blast工具(https:∥www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINKLOC=MultiSensor) (Yeetal., 2012)对COI序列设计SS-PCR特异性引物(表2)。随后以1.3节提取的中华螯蜂幼虫、被中华螯蜂寄生的斑衣蜡蝉若虫、中华螯蜂成虫和未被中华螯蜂寄生的斑衣蜡蝉若虫DNA为模板,PCR反应体系及条件同1.4节,每对引物重复5次。利用琼脂糖凝胶电泳对所得PCR产物进行检测,以确定引物的特异性,并随机选择10份PCR产物进行测序,以确定PCR产物为目标COI序列部分片段。
选择扩增出明显特异性条带的引物用于SS-PCR引物种特异性的检验,并根据引物退火温度设置PCR反应体系和条件(同1.4节)。随后将1.3节提取的中华螯蜂幼虫DNA分别溶解于无核酸酶水和寄主斑衣蜡蝉若虫DNA(50 ng/μL)中,中华螯蜂幼虫DNA浓度梯度为50, 5, 0.5, 0.05, 0.005, 0.0005, 0.00005和0.000005 ng/μL,每个浓度重复5次,测定SS-PCR引物对中华螯蜂DNA的最低检测阈值。
1.6 寄生蜂对斑衣蜡蝉若虫寄生率的测定
肉眼观察各个采样点的斑衣蜡蝉若虫翅芽下是否存在寄生蜂卵或幼虫囊包(闫家河等, 2008)(图1: C),分别记录目测法统计的被寄生斑衣蜡蝉若虫总数和总样本数,计算目测法斑衣蜡蝉若虫的寄生率。随后以1.3节提取的所有肉眼观察过的斑衣蜡蝉若虫单头DNA为模板,利用SS-PCR引物进行PCR(反应体系和条件同1.4节),根据PCR产物测序结果确定斑衣蜡蝉若虫是否被寄生,计算寄生率。寄生率=被寄生斑衣蜡蝉若虫总数/总样本数×100%。
1.7 数据分析
利用BioEdit (v7.2.5) 对1.4节双向测序结果进行拼接、校对,排除假基因的可能后将序列提交至NCBI,获得GenBank登录号。随后利用DNAMAN 8(Lynnon Biosoft, Quebec, 加拿大)软件检验所得序列能否正确翻译蛋白质以确保序列的正确性,在NCBI database(www.ncbi.nlm.nih.gov)中利用BLAST搜索确定其为螯蜂序列, 以排除其他物种干扰。使用MEGA 10.0.6(Kumaretal., 2018)对序列进行多重比对。COI和28S rDNA序列分别利用DnaSP 5.1(Rozasetal., 2010)计算各序列多态位点数量(S)、单倍型数量(H)、单倍型多样性(Hd)、核苷酸多样性(Pi)和遗传分化(Fst),并进行Tajima’sD检验。在MEGA 10.0.6 中利用Clustal W序列校对后,分析各序列的碱基组成。随后采用Network 4.1软件绘制COI序列单倍型网络图(Bandeltetal., 1999),基于COI序列利用K2P模型(Kimura-2-parameter distance)(Kimura, 1980)分析各寄生蜂种群间的遗传距离。以柯氏螯蜂Dryinuskoebelei(GenBank登录号: JN306860)作为外群(NCBI database; Stahlhutetal., 2013),利用邻接(neighbor-joining, NJ)法构建系统发育树。

表2 基于中华螯蜂COI序列的SS-PCR引物信息Table 2 SS-PCR primer information based on the COI sequence of Dryinus sinicus
利用SPSS 20.0进行数据分析,不同地理种群中华螯蜂的寄生率和不同检测方法统计的寄生率间的差异显著性利用χ2检验(α=0.05)。
2 结果
2.1 斑衣蜡蝉若虫寄生蜂鉴定
斑衣蜡蝉若虫寄生蜂标本寄给世界螯蜂科权威分类专家意大利图西亚大学(Tuscia University)Massimo Olmi教授鉴定为中华螯蜂Dryinussinicus,Olmi教授为该蜂的命名人。形态描述及图片可参考杨集昆(1994)、何俊华和许再福(2002)和Xu等(2013)文献(图2: A),雌蜂前足螯的大爪上均具亚端齿(图2: B),且其触角第3节极长,约等于第4和5节触角之和(图2: C),与文献中中华螯蜂的形态特征描述一致,因此本研究所采集的斑衣蜡蝉若虫寄生蜂为中华螯蜂。
2.2 中华螯蜂种群遗传多样性
PCR扩增得到中华螯蜂种群643 bp的COI序列和614 bp的28S rDNA序列。其中,COI序列中A, T, C, G碱基占比分别为31.77%, 44.17%, 10.43%和31.77%,A+T含量为75.94%,含有保守位点624个,变异位点19个,简约信息位点7个,自裔位点12个。28S rDNA序列中A, T, C, G碱基占比分别为20.82%, 22.22%, 26.50%和30.47%,A+T含量为43.04%。其中含有保守位点586个,变异位点28个,简约信息位点16个,自裔位点12个。
COI序列中共检测到16种单倍型,其中泰安种群(TA)中3个样本共享单倍型为H15,其余单倍型均为样本独有的单倍型(图3)。而28S rDNA序列中则检测到4个单倍型,北京(BJ)、驻马店(ZMD)和泰安(TA)种群中均为Hap1,南京种群(NJ)则包含4个不同的单倍型(表3)。COI序列核苷酸多样性(Pi)最高为南京种群(NJ)(0.0099±0.0027),泰安种群(TA)最低(0.0018±0.0000);28SrDNA序列核苷酸多样性最高为南京种群(NJ)(0.0245±0.0078)。北京种群(BJ)和南京种群(NJ)的COI序列的单倍型多样性(Hd)高于其他两个种群的,但除南京种群(NJ)外,其他3个种群28S rDNA序列的单倍型多样性均为0。分子多样性指数表明南京种群(NJ)遗传多样性最高。

图2 中华螯蜂主要形态特征Fig. 2 Main morphological characteristics of Dryinus sinicusA: 中华螯蜂雌成虫Dryinus sinicus female adult; B: 雌成虫前足 Propodium of female adult; C: 雌成虫触角Antenna of female adult.

图3 基于COI序列的中华螯蜂单倍型中介网络图Fig. 3 Median-joining haplotype network of Dryinus sinicus based on COI sequenceH1-H16: 单倍型Haplotypes; mv1-mv3: 可能突变的位点Possible mutation sites.

表3 不同地理种群中华螯蜂单倍型多样性Table 3 Haplotype diversity of different geographical populations of Dryinus sinicus
2.3 基于COⅠ的中华螯蜂遗传距离及遗传分化
利用K2P模型计算中华螯蜂不同地理种群间遗传距离在0.00691~0.01310之间(表4)。驻马店种群(ZMD)和泰安种群(TA)间遗传距离最近(0.00691),泰安种群(TA)与南京种群(NJ)间遗传距离最远(0.01310)。在不同地理种群遗传分化方面,种群间固定系数(Fst)在0.11111~0.60983之间,其中北京种群(BJ)和泰安种群(TA)Fst最高,为0.60983,表明北京种群和泰安种群间分化程度较高,而南京种群和驻马店种群间Fst系数最低。
2.4 基于COI序列的不同地理种群中华螯蜂的系统发育分析
NJ系统发育树表明,本研究所采集的斑衣蜡蝉若虫寄生蜂样本的COI序列均聚于一枝,而与外群柯氏螯蜂COI序列分离(图4),表明所选择的外群COI序列所属物种与斑衣蜡蝉若虫寄生蜂亲缘关系远,而不同地理种群间斑衣蜡蝉若虫寄生蜂亲缘关系较近,因此本研究所检测斑衣蜡蝉若虫寄生蜂均为同一物种。

表4 基于COI序列的中华螯蜂不同地理种群间遗传距离(下三角)和固定系数Fst(上三角)Table 4 Pairwise genetic distance (below the diagonal) and Fst (above the diagonal) among different geographical populations of Dryinus sinicus based on COI sequence

图4 基于COI序列用K2P模型构建的中华螯蜂不同地理种群样本邻接系统发育树Fig. 4 Neighbor-joining tree of specimens from different geographical populations of Dryinus sinicus using Kimura-2-parameter based on COI sequences括号内代码为GenBank登录号; 以柯氏螯蜂COI基因序列为外群。The codes in brackets are GenBank accession no. COI gene sequence of Dryinus koebulei was used as the outgroup.
2.5 应用SS-PCR引物对中华螯蜂的快速检测
根据COI序列设计10对SS-PCR引物(表2),并以1.3节提取的中华螯蜂幼虫和成虫、未被寄生的斑衣蜡蝉若虫和被寄生的斑衣蜡蝉若虫DNA为模板进行扩增后发现,引物DS-54/DS-279(表2)对中华螯蜂幼虫和成虫及被寄生的斑衣蜡蝉若虫均具有扩增能力,但不能扩增未被中华螯蜂寄生的斑衣蜡蝉若虫DNA,且可以成功扩增出各个地理种群中华螯蜂DNA,表明该引物为中华螯蜂的特异性引物(图5)。SS-PCR最低检测阈值测定表明,DS-54/DS-279可以扩增出稀释至0.000005 ng/μL的中华螯蜂DNA(图6)。
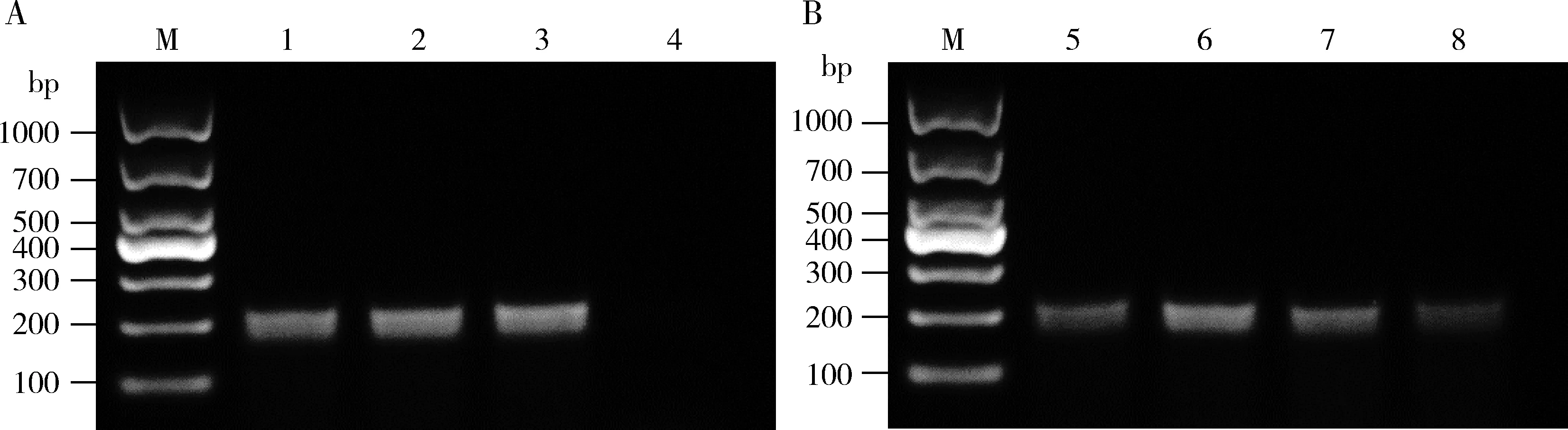
图5 SS-PCR引物DS-54/DS-279对不同虫态中华螯蜂和斑衣蜡蝉若虫DNA的扩增能力Fig. 5 Amplification pattern of DNA from Dryinus sinicus at different developmental stages and Lycorma delicatula nymphs by SS-PCR primer DS-54/DS-279M: DNA分子量标准DNA molecular weight marker; 1: 中华螯蜂幼虫D. sinicus larva; 2: 被中华螯蜂寄生的斑衣蜡蝉若虫L. delicatula nymph parasitized by D. sinicus; 3: 中华螯蜂成虫D. sinicus adult; 4: 未被寄生的斑衣蜡蝉若虫Un-parasitized L. delicatula nymph; 5-8: 分别为北京(BJ)、南京(NJ)、驻马店(ZMD)、泰安(TA)中华螯蜂种群幼虫D. sinicus larvae of Beijing (BJ), Nanjing (NJ), Zhumadian (ZMD), and Tai′an (TA) populations, respectively.

图6 SS-PCR引物DS-54/DS-279对中华螯蜂DNA的最低检测阈值Fig. 6 The detection threshold for Dryinus sinicus DNA using SS-PCR primer DS-54/DS-279M: DNA分子量标准DNA molecular weight marker; 1-7: 以浓度分别为50, 5, 0.5, 0.05, 0.005, 0.0005, 0.00005和0.000005 ng/μL的中华螯蜂DNA为模板的PCR产物PCR products using D. sinicus DNA at the concentrations of 50, 5, 0.5, 0.05, 0.005, 0.0005, 0.00005 and 0.000005 ng/μL, respectively, as the template; 8-14: 斑衣蜡蝉DNA (50 ng/μL)分别与50, 5, 0.5, 0.05, 0.005, 0.0005, 0.00005和0.000005 ng/μL中华螯蜂DNA的混合物为模板的PCR产物PCR products using DNA mixtures of 50 ng/μL L. delicatula DNA mixed with D. sinicus DNA at the concentrations of 50, 5, 0.5, 0.05, 0.005, 0.0005, 0.00005 and 0.000005 ng/μL, respectively, as the template.
2.6 中华螯蜂对不同采样点斑衣蜡蝉若虫的寄生率
利用SS-PCR检测中华螯蜂对斑衣蜡蝉若虫的寄生率,结果表明该寄生蜂对斑衣蜡蝉若虫寄生率较高(图7),其中驻马店种群的寄生率高达60.00%,南京种群的寄生率仅为22.54%,显著低于其他采样点种群的寄生率(χ2=14.718,df=3,P=0.002)。而利用目测法观察统计的寄生率范围为5.63%~36.98%,南京种群的寄生率同样显著低于其他采样点种群的寄生率(χ2=23.448,df=3,P<0.001)。使用SS-PCR检测得到的中华螯蜂对各采样点斑衣蜡蝉若虫的寄生率均显著高于使用目测法观察得到的结果,两种方法检测中华螯蜂对北京斑衣蜡蝉若虫的寄生率差异最显著,可达40.43%(χ2=17.121,df=1,P<0.001)。
3 结论与讨论

图7中华螯蜂对不同采样点斑衣蜡蝉若虫的寄生率Fig. 7 Parasitism rate of Dryinus sinicus on Lycorma delicatula nymphs sampled from different sampling localities图中数据为平均值±标准误;柱上不同大写字母表示同一检测方法所得寄生率在不同采样点间差异显著(χ2检验, α=0.05),不同小写字母表示相同采样点的寄生率在不同检测方法间差异显著(χ2检验, α=0.05)。Data in the figure are mean±SE. Different capital letters above bars indicate significant differences in parasitism rates among different sampling localities using the same detection method (χ2 test, α=0.05), while different small letters indicate significant differences in parasitism rates in the same sampling locality analyzed by different detection methods (χ2 test, α=0.05).
本研究利用DNA条形码技术明确了所采集的斑衣蜡蝉若虫期天敌种群间没有显著的遗传差异,为同一种中华螯蜂。并在此基础上根据COI序列设计了中华螯蜂SS-PCR引物,该引物可以成功扩增所有虫态中华螯蜂的种特异性片段,最低检测阈值可达0.000005 ng/μL DNA。利用不同方法对不同地理种群斑衣蜡蝉若虫的中华螯蜂寄生率进行了检测,SS-PCR检测寄生率的准确度明显优于目测法。
本研究基于COI序列的遗传差异分析结果显示中华螯蜂不同地理种群间遗传多样性较低,但在构建系统发育树时由于数据库中螯蜂属序列上传较少,因此以螯蜂科其他昆虫COI序列作为外群进行分析,中华螯蜂所有地理种群COI序列均聚为一枝,而与外群柯氏螯蜂COI序列分离,这表明中华螯蜂与所选外群亲缘关系较远。中华螯蜂种群间遗传距离在0.00691~0.01310之间,Hebert等(2003)对动物线粒体COI序列进行分析认为98%物种种内遗传距离差异为0~2.00%,没有出现种下分化,为同一种。寄生斑衣蜡蝉若虫期螯蜂属天敌还有史氏螯蜂Dryinusstantoni(Xuetal., 2013),而本研究所采集的螯蜂属天敌经形态鉴定为中华螯蜂,且不同地理种群的样本之间均没有显著的遗传差异,因此目前采集到的北京、泰安、南京和驻马店种群均为中华螯蜂。这两种斑衣蜡蝉螯蜂属天敌是否为同物异名有待进一步研究。
目前常用的天敌控害作用评价方法除传统的生态学方法外(刘树生, 2004),酶联免疫(ELISA)、同位素标记技术和SS-PCR等分子生物学方法在天敌控害作用的评价中应用日益广泛(Zhangetal., 2007)。本研究分别利用直接观察法和SS-PCR技术对中华螯蜂对斑衣蜡蝉若虫的寄生率进行了检测,SS-PCR检测到的寄生率显著高于采用目测法直接观察的结果。这可能是由于在中华螯蜂寄生早期,其卵和囊包较小,不易发现,导致直接观察到的寄生率偏低。若将斑衣蜡蝉带回实验室进行实验室种群饲养观察,同样可能由于斑衣蜡蝉若虫期死亡导致统计的寄生率偏低。虽然研究认为有些寄生蜂在寄生后可能因寄主免疫导致其后代在寄主体内死亡,特别是内寄生性天敌,SS-PCR可以用于检测寄生蜂寄生寄主的百分比。将SS-PCR与室内人工饲养和传统解剖相结合则能够得到更准确的寄生率(Gariepyetal., 2007)。目前SS-PCR广泛应用于茧蜂科(Braconidae)、姬蜂科(Ichneumonidae)、金小蜂科(Pteromalidae)等天敌的检测(Haleetal., 2004; Douhovnikoffetal., 2006; Traugottetal., 2006)。而中华螯蜂作为斑衣蜡蝉若虫的外寄生性天敌,其所受到的寄主免疫较内寄生性天敌低,研究开发中华螯蜂不同发育阶段的快速检测鉴定技术,可以快速、准确检测出中华螯蜂寄生率,并结合室内饲养明确中华螯蜂对斑衣蜡蝉的寄生成功率,可评估其对斑衣蜡蝉的控制作用,为利用中华螯蜂防治斑衣蜡蝉奠定基础。
中华螯蜂在不同采样点的寄生率存在显著差异,驻马店和北京种群的寄生率明显高于南京种群,这可能是由于北京、驻马店和泰安采集的样本均为近自然环境,使用化学农药较少,而南京地区的采集于行道树,为防治斑衣蜡蝉等园林害虫通常会使用化学农药进行防治,导致天敌种群密度降低。此外采用两种方法检测的中华螯蜂对北京斑衣蜡蝉若虫的寄生率差异最大,这可能是由于不同采样点斑衣蜡蝉若虫种群生活史存在一定差异,北京地区的中华螯蜂羽化较晚,使用目测法统计的中华螯蜂寄生率远低于实际寄生率。因此,本研究开发的快速检测技术可以应用于中华螯蜂寄生早期准确、快速检测。
此外,在往年调查过程中还在陕西延安、甘肃兰州及山东烟台和商河发现螯蜂茧或者被螯蜂寄生的斑衣蜡蝉若虫,这表明中华螯蜂在我国分布范围较广,基本可以覆盖斑衣蜡蝉的分布区。虽然目前斑衣蜡蝉在我国并不属于主要害虫,但其不仅直接影响寄主植物树势,还可以作为媒介昆虫传播柿疯病影响柿树的产量,严重时甚至导致柿树死亡(俎显诗, 1992)。柿疯病在我国广泛分布,其中一些地区发病株率达70%以上,河北、山西、河南等区域斑衣蜡蝉危害也十分严重(王祈楷等, 1989; 俎显诗, 1992; 宗学普和黎彦, 2005)。斑衣蜡蝉作为柿疯病的媒介昆虫之一,降低斑衣蜡蝉种群密度可以有效控制柿疯病的传播,避免柿疯病的进一步传播扩散(李令军, 2014)。斑衣蜡蝉排泄的蜜露还会引发煤污病,影响其寄主植物及周围其他植物光合作用(Barringeretal., 2015; EPPO, 2017)。自其入侵至韩国和美国等国家后严重危害葡萄,影响葡萄产业(Kimetal., 2011; Leeetal., 2019)。由于斑衣蜡蝉通常危害经济树种和园林绿化树种,而目前对斑衣蜡蝉通常采取施用大量化学农药进行防治,影响生态环境和人类健康(EPPO, 2017; Leeetal., 2019)。因此,研发中华螯蜂人工繁殖和释放利用技术是斑衣蜡蝉绿色防控的重要手段之一。
致谢本研究螯蜂样本由意大利图西亚大学(Tuscia University)Massimo Olmi教授鉴定,山东省商河县森林保护站闫家河高级工程师对螯蜂饲养技术给予了指导和帮助,谨致谢忱。
