二乙碳酰氨嗪对野百合碱所致大鼠肺动脉高压的保护作用
2020-03-30姚亚妮
范 丽 姚亚妮 李 瑜
肺动脉高压(pulmonary arterial hypertension,PAH)是指非肌型动脉肌层化,肺血管阻力进行性增高,进而引起右心力衰竭,导致患者死亡的心肺血管临床综合征[1,2]。凋亡是多种心血管疾病发生、发展的细胞学基础,近期研究表明,肺动脉平滑肌细胞凋亡的减少是引发PAH肺血管重塑的关键事件之一,可造成细胞过度堆积从而引发肺血管壁增厚,导致血管内径减小和阻力增加[3,4]。
二乙碳酰氨嗪(diethylcarbamazine,DEC)作为一种哌嗪衍生物,被广泛应用于治疗淋巴丝虫病,其作用机制尚未清楚。近年来多项研究报道DEC在多种肺部疾病模型中均表现出了优秀的药理活性,如嗜酸性粒细胞性肺炎、哮喘、卡拉胶急性肺损伤和急性肺炎等[5~8]。Queto等[6]研究指出,DEC通过CD95L/CD95信号通路抑制肺和骨髓中嗜酸性粒细胞的增多,实现对肺炎的保护作用。其中CD95L(FasL)是凋亡诱导受体CD95(Fas)的配体,该实验表明DEC可以充当细胞凋亡诱导剂的作用。本研究旨在通过评价DEC对PAH大鼠模型的肺组织及肺血管功能学、形态学以及凋亡相关指标的影响,来探讨DEC对野百合碱诱导的大鼠PAH的治疗作用及其作用机制。
材料与方法
1.材料:(1)试剂:野百合碱购自美国Sigma公司。抗FADD、caspase-8、Bax、Bcl-2和GAPDH等抗体购自美国Cell Signaling Technology公司,HRP-IgG购包美国Santa Cruz公司。抗α-SMA单克隆抗体购自美国Proteintech公司。生物素标记的IgG二抗,ECL超敏发光试剂盒购自碧云天生物技术研究所。TUNEL试剂盒购自美国Roche公司。DAB显色试剂购自索莱宝生物技术有限公司。(2)实验动物:SPF级雄性Sprague Dawley大鼠30只,5周龄,体质量220~250g,由新疆医科大学实验动物中心提供,实验动物生产合格证号:65000700000045。动物饲养环境SPF级,自由摄食水,日关灯控制12h交替照明,室温保持在21±2℃,湿度60%~80%,动物实验过程严格遵照实验动物护理和使用准则(The Guidelines for the Care and Use of Laboratory Animals)[9]。
2.动物分组及模型制备:大鼠适应性喂养1周后,随机分为正常组、模型组、DEC组。除正常组外的大鼠腹腔注射30mg/kg戊巴比妥钠麻醉,通过一次性腹腔注射60mg/kg野百合碱诱导肺动脉高压模型[10]。DEC组腹腔注射35mg/kg DEC,连续给药28天,每天1次。正常组和模型组腹腔注射等体积0.9%的氯化钠注射液。
3.RVSP、PAP的测定及RVHI的计算:各组大鼠腹腔注射30mg/kg戊巴比妥钠麻醉,固定于手术台,颈部消毒后纵向切开皮肤,钝性分离右侧颈总静脉,结扎血管远心端。眼科剪切口,沿切口向右心室方向缓慢插入预充肝素0.9%氯化钠注射液的聚乙烯导管,另一端连接生物换能器。Powerlab生物信息采集与处理系统已提前打开,并连接三通管和生物换能器监护仪。缓缓向前推进导管,根据显示的压力值和压力波形判断导管所在位置。当右心室压力波形和肺动脉压力波形出现时,固定导管位置,稳定记录10~15min后保存生物采集系统所捕获的RVSP和PAP值。RVSP或PAP>25mmHg是公认的野百合碱诱导的肺动脉高压模型成功建立的标准。完成RVSP和PAP的检测后,迅速暴露大鼠心脏,取出并用4℃ PBS冲洗干净。沿着房室间沟剪去心房及大血管根部,经肺动脉出口沿肺动脉圆锥和室间隔分离右心室游离壁,左心室加室间隔组织(left ventricle and interventricular septum,LV+S)两部分。滤纸吸干表面多余的水分后称量RV游离壁及LV+S的重量,两者的比值即为右心室肥厚指数RVHI=RV/(LV+S)%。
4.HE染色、α-SMA免疫组织化学以及TUNEL染色:用HE染色法观察各组肺血管重建情况[11]。取出大鼠左侧肺叶,10%甲醛中固定48h后,蒸馏水冲洗10min。乙醇逐级脱水,浸蜡包埋并切片。切片行苏木精-伊红(HE)染色,光镜下观察直径50~200μm肺部细动脉病理改变并拍照,每只大鼠测定25支外观相对圆整的血管。用Image-Pro Plus v6.0测量管腔的内外径,计算肺动脉血管壁的中膜厚度(medial wall thickness, MT)与外径(external diameter, ED)的比值,即中膜厚度百分比作为肺血管重建的指标,MT%=(2MT/ED)×100%。用α-SMA免疫组织化学染色法评估各组肺动脉肌化水平。肺组织常规石蜡包埋切片。二甲苯脱蜡、抗原热修复,3% H2O2室温下孵育15min,α-SMA单克隆抗体(1∶50)4℃孵育过夜。用生物素标记的羊抗兔IgG二抗室温下孵育30min,DAB显色后苏木精复染,中性树胶封片后显微镜下观察。200×显微镜下可见200支左右血管,每只大鼠检测25支直径20~200μm的动脉并拍照。根据Jones等[12]评价方法,将血管分为完全肌化、部分肌化和无肌化3个等级,对各组3种肌化程度的血管数统计并分析。肺动脉壁中血管平滑肌细胞的凋亡情况采用原位细胞凋亡检测试剂盒测定。组织的石蜡包埋和切片方法同HE染色和α-SMA免疫组织化学染色法,具体操作按照试剂盒说明进行。400×显微镜下观察凋亡情况并拍照,用TUNEL阳性率来反映各组凋亡情况。
5.FADD、caspase-8、Bax和Bcl-2等蛋白表达水平的检测:取肺组织100mg,加入裂解液冰上提取总蛋白。15000r/min离心10min获得上清,BCA定量总蛋白浓度,蛋白煮沸以变性,置于-20℃保存。SDS-PAGE凝胶电泳后,湿转法转移蛋白条带至PVDF膜上。5%脱脂奶粉封闭PVDF膜1h。加入FADD、caspase-8、Bax和Bcl-2的单克隆抗体,4℃层析柜中孵育过夜。加入HRP-IgG二抗,室温下振荡孵育1h。滴加ECL显色液,凝胶成像仪曝光,运用Image J获得灰度值。
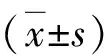
结 果
1.各组RVSP、PAP和RVHI的变化:与正常组比较,模型组RVSP、PAP和RVHI均明显升高(P<0.05)。其中模型组的PAP或RVSP>25mmHg表明野百合碱诱导的肺动脉高压模型成功建立,而RVHI的变化表明大鼠右心室出现肥厚。DEC组RVSP、PAP和RVHI均显著低于模型组,差异有统计学意义(P<0.05),说明DEC显著降低大鼠肺动脉压力,缓解右心室肥厚(表1)。

表1 各组RVSP、PAP和RVHI的变化
与正常组比较,*P<0.05;与模型组比较,#P<0.05
2.HE染色、α-SMA免疫组化和TUNEL染色:正常组肺动脉内表面光滑,管壁薄且管腔正常,几乎无炎性细胞浸润。模型组肺动脉内皮细胞严重破坏,管壁明显增厚伴随管腔狭窄,炎性细胞大量浸润。DEC组肺动脉内皮细胞排列较整齐,管壁厚度较模型组明显缩小,炎性细胞浸润现象减轻(图1A)。与对照组比较,模型组肺动脉MT%明显增加,而DEC干预后肺小动脉MT%明显下降(P<0.05,图1B)。根据α-SMA免疫组化结果(图1C),按照α-SMA阳性分布率统计各组无肌化、部分肌化和完全肌化的肺动脉所占比例(图1D)。与正常组比较,模型组中无肌化肺动脉所占比例显著降低,而完全肌化比例显著提高(P<0.05)。DEC组无肌化肺动脉所占比例显著高于模型组,而完全肌化比例显著低于模型组(P<0.05)。各组间部分肌化的肺动脉所占比例的差异无统计学意义(P>0.05)。TUNEL染色检测DEC对肺血管平滑肌细胞凋亡情况的影响(图1E、F)。模型组中肺血管平滑肌细胞的TUNEL阳性率显著低于正常组(P<0.05),DEC组TUNEL阳性率显著高于模型组(P<0.05)。

图1 HE染色、α-SMA免疫组化和TUNEL染色A.HE染色(×200);B.血管中膜厚度百分比(MT%);C.α-SMA免疫组化(×200);D.动脉肌化程度;E.TUNEL染色(×400);F.TUNEL阳性率;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.肺组织中FADD、caspase-8、Bax、Bcl-2等蛋白的表达水平检测:检测肺组织中内源性和外源性凋亡相关蛋白的表达水平。与正常组比较,FADD、caspase-8和Bax等凋亡蛋白在模型组中的表达水平显著降低,抗凋亡蛋白Bcl-2的表达水平显著提高(P<0.05)。DEC组凋亡蛋白FADD、caspase-8和Bax的表达水平显著高于模型组,Bcl-2的表达水平显著低于模型组(P<0.05,图2)。

图2 FADD、caspase-8、Bax和Bcl-2等蛋白表达水平的变化A.蛋白免疫印迹;B.FADD、caspase-8、Bax和Bcl-2等蛋白表达水平;与正常组比较,*P<0.05;与模型组比较,#P<0.05
讨 论
肺动脉高压是指肺动脉内膜增生和重构引起的肺血管阻力进行性增加,最终导致右心负荷增加及右心功能不全的疾病[13]。MCT在大鼠体内经肝代谢转换成吡咯野百合碱后作用于肺动脉管壁,导致血管内皮损伤,肺血管平滑肌层增生,其诱导的PAH大鼠的病理改变与临床动脉性肺高压相似,是目前最常用的PAH模型[14]。本研究旨在评价DEC对MCT诱导的PAH大鼠的保护作用,并探讨其作用机制。
PAP和RVSP反映肺动脉压力,是判断肺动脉高压模型是否建立成的客观指标[15]。高压力负荷下的右心室功能决定了患者病情的严重程度和生存情况,RVHI反映右心功能,其代表的右心室肥厚程度是影响PAH预后的重要因素[16]。本研究结果发现,DEC能有效降低MCT肺动脉高压大鼠的RVSP、PAP和RVHI等指标,说明DEC能改善MCT诱导的肺动脉压力的上升和右心室肥厚的情况。
HE染色结果显示,DEC能改善MCT诱导的肺动脉平滑肌细胞增生、肌层增厚和管腔狭窄等肺血管重构的表现,有效降低炎性细胞浸润。α-SMA是平滑肌表型的分子标志物,由肺平滑肌细胞表达,其表达的上调反映肺动脉中膜层的增厚和肺动脉的肌化[17]。研究结果显示,模型组α-SMA阳性率显著高于正常组,说明PAH模型中肺动脉严重肌化。而DEC能够明显改善因为野百合碱诱导所提高的α-SMA阳性率,显著降低PAH大鼠肺动脉中完全肌化的动脉比例,同时提高无肌化动脉所占比例,提示DEC能够逆转野百合碱诱导的肺动脉肌化。为了探讨DEC逆转肺动脉壁重构的作用机制,TUNEL法检测各组肺动脉壁中动脉平滑肌细胞的凋亡情况。结果显示,DEC组TUNEL阳性率显著高于模型组,说明DEC能通过促进细胞凋亡发挥改善肺血管重构作用。为了进一步探究其促凋亡分子机制,采用蛋白免疫印迹法检测各组肺组织中FADD、caspase-8、Bax和Bcl-2等蛋白的表达水平。
细胞凋亡主要由两条途径触发,分别是死亡受体途径(外源性途径)和线粒体通路(内源性途径)。外源途径由外源性配体与其特定促凋亡受体结合而触发,例如Fas结合FADD后活化caspase-8形成死亡诱导信号复合物,进而激活下游凋亡执行蛋白caspase-1、caspase-3等[18,19]。内源性途径涉及线粒体应激反应,包括Bcl-2凋亡蛋白家族。Deng等[20]研究发现,FoxO1表达的下调会导致肺动脉高压大鼠血栓的形成,出现Bcl-2的下调和Bad的上调。蛋白免疫印迹法检测结果表明,DEC能从外源途径上显著增加PAH大鼠中FADD、caspase-8的表达水平。DEC从内源途径上显著下调了因MCT诱导而上升的抗凋亡蛋白Bcl-2的表达水平,显著上调Bax表达。提示DEC能同时促进内源性和外源性凋亡来减轻肺动脉平滑肌层增生。
综上所述,DEC能同时作用于内源和外源途径凋亡分子标志物,改善MCT诱导的PAH大鼠的肺动脉压力上升,右心室肥厚以及肺动脉重塑和肌化情况,希望能为临床PAH的治疗提供帮助。
