乳腺癌腋窝淋巴结微转移的预后与治疗探讨
2020-03-30王立军李智宇张懿敏孙圣荣
王立军 唐 蔚 李智宇 张懿敏 孙圣荣 涂 毅
乳腺癌患者的腋窝淋巴结状态是判断预后及指导辅助治疗的关键因素之一[1]。多年来,前哨淋巴结活检(SLNB)和免疫组织化学(IHC)的出现提高了孤立肿瘤细胞(ITC)和微小转移(N1mi)的检测阳性率,使得发现腋窝淋巴结微转移的可能性增加[2,3]。ITC定义为单个细胞或最大径≤0.2mm的小细胞簇或单张组织切片不连续或接近连续的细胞簇≤200个细胞。N1mi定义为肿瘤病灶最大径>0.2mm,但≤2.0mm,或单张组织切片不连续,或接近连续的细胞簇>200个细胞[4]。
对于乳腺癌腋窝淋巴结微转移的临床意义及其处理方式在国际上仍存在争议。一项大型队列研究报道ITC和N1mi是乳腺癌的独立危险预后因素,这类患者可从辅助治疗中获益[5]。而另一些研究表明,ITC和N1mi患者预后与淋巴结阴性(N0)患者相似,可能无法从辅助治疗中获益[6,7]。本研究探讨了乳腺癌ITC和N1mi患者的预后及治疗方式选择,为乳腺癌腋窝淋巴结微转移患者的临床处理决策提供理论参考依据。
资料与方法
1.一般资料:选取SEER数据库中2010~2014年间乳腺癌腋窝淋巴结微转移患者作为研究对象,排除男性乳腺癌、组织病理学诊断为原位癌、腋窝淋巴结宏转移(>4枚)以及随访不明的患者,选取同时期淋巴结阴性(N0)和宏转移(N1)的乳腺癌患者作为对照,收集患者临床病理资料和随访信息。
2.临床信息:包括诊断年龄(<35岁、35~49岁、50~64岁、≥65岁)、组织学分类(浸润性导管癌、浸润性小叶癌、浸润性导管混合小叶癌、其他浸润性癌)、组织分级、肿瘤直径(≤10mm、11~20mm、21~30mm、31~40mm、41~50mm,51~60mm,>60mm)、淋巴结状态(N0、ITC、N1mi、N1)、远处转移状态。亚型分为HR+HER-2-、HR+HER-2+、HR-HER-2+和三阴型。治疗方式包括手术(乳房全切术、保乳)、放疗、化疗等。总体生存率(OS)和乳腺癌特异性生存率(BCSS)是两个主要的事件终点。
3.统计学方法:采用SPSS 19.0统计学软件对数据进行统计分析,采用χ2检验进行统计描述,采用多因素COX比例风险回归评估患者预后,以P<0.05为差异有统计学意义。
结 果
1.临床病理特征:选取2010~2014年间符合纳入标准的乳腺癌腋窝淋巴结微转移患者共18432例,其中ITC组6274例,N1mi组12158例,对照组中N0组纳入194434例患者,N1组纳入53850例患者,中位随访时间为27个月(表1)。ITC及N1mi组患者肿瘤直径较对照组更大,且病理分化程度更差。4组中接受治疗的患者比例均与淋巴结转移有关。乳房切除术分别在N0、ITC、N1mi和N1患者中占比为35.1%、49.5%、51.1%和50.9%。腋窝淋巴结清扫(axillary lymph node dissection,ALND)分别占12.3%、16.1%、39.2%和55.9%,化疗分别占25.7%、37.1%、51.0%和67.5%。
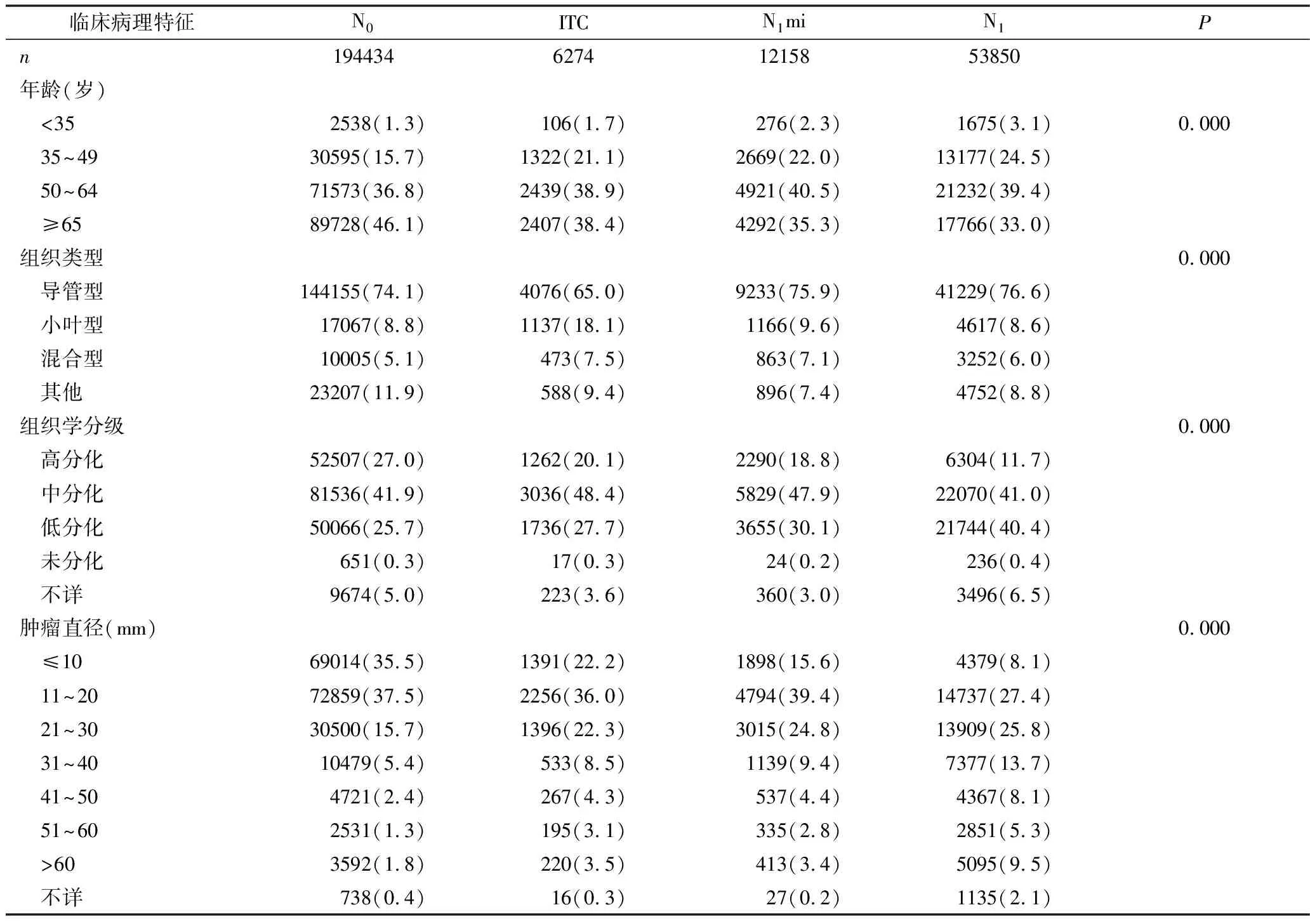
表1 不同亚组患者的临床病理学特征[n(%)]
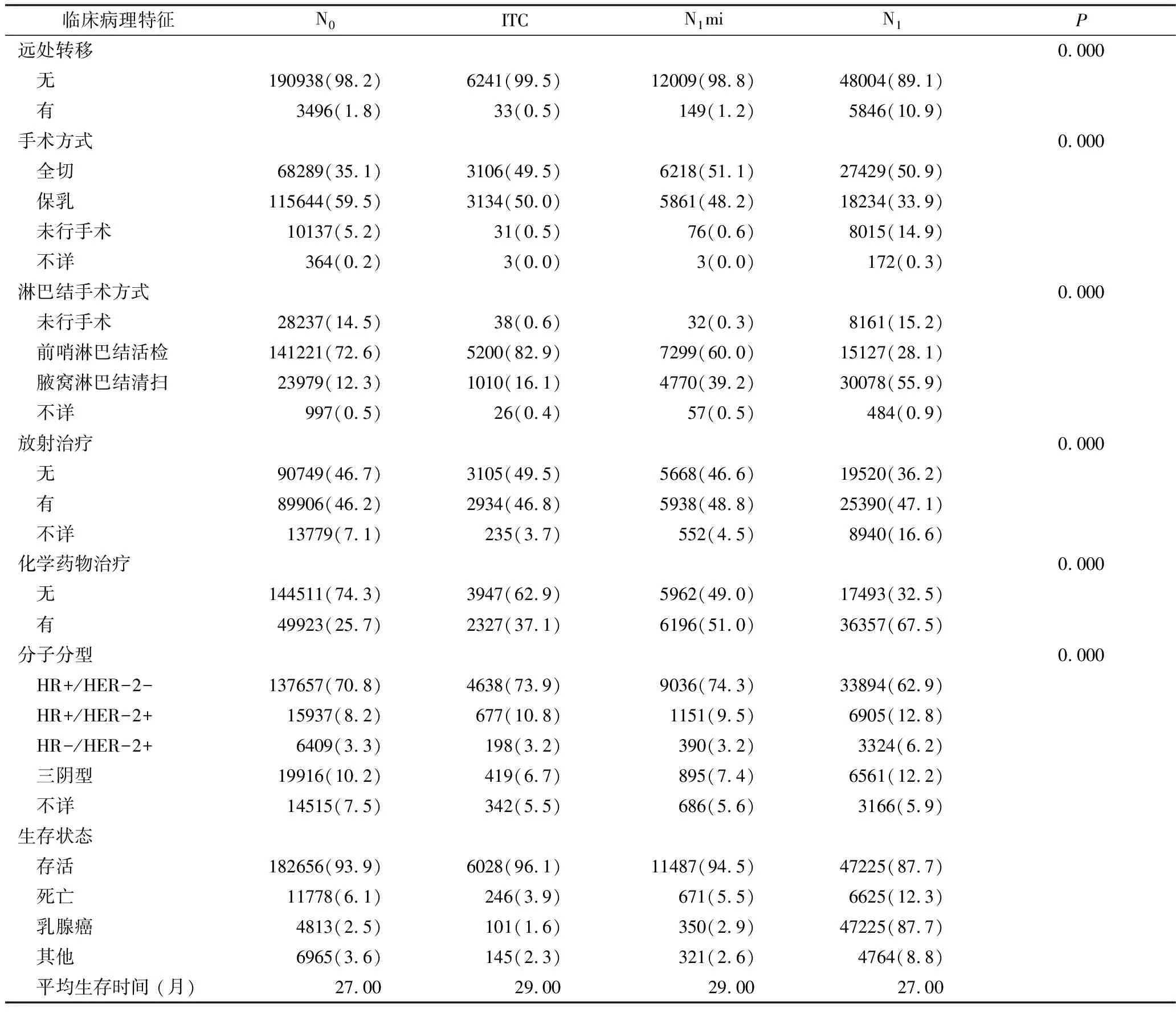
续表1
N0.无淋巴结转移;ITC.孤立肿瘤细胞;N1mi.微小淋巴结转移;N1.淋巴结宏转移;HR.激素受体;HER-2.人类表皮生长因子2
2.生存分析:通过多因素风险回归模型发现,ITC组患者的预后与N0组患者相似(OS,P=0.848,aHR=1.013;BCSS,P=0.385,aHR=1.097)。然而与N0组患者比较,N1mi组患者具有更差的OS和BCSS(OS,P=0.000,aHR=1.427;BCSS,P=0.000,aHR=1.799,图1)。在N1mi组,肿瘤直径、组织分级、远处转移和乳腺亚型均与预后相关(表2),肿瘤越大、分级越高、伴远处转移其预后往往更差;而分子分型中HR+/HER-2-、HR+/HER-2+和HR-/HER-2+预后相似,三阴型乳腺癌合并N1mi患者的预后最差。(OS:P=0.000,AHR=2.741;BCSS:P=0.000,AHR=3.398)。
3.治疗方式:对N1mi患者进行多因素分析,手术方面接受保乳手术联合放疗治疗的N1mi患者与接受乳房切除术的患者比较,OS和BCSS较高,预后较好(OS:P=0.000,aHR=0.514;BCSS:P=0.000,aHR=0.461)。辅助治疗方面接受化疗的患者OS比未化疗的患者好(P=0.000,AHR=0.703)。但就BCSS而言,化学药物治疗和放射治疗还不是影响预后的因素(P=0.495,P=0.500)。在N1mi组中,当肿瘤直径≤20mm时,化疗组与未化疗组患者的OS和BCSS相似(P分别为0.535、0.433,图2);然而当肿瘤直径>20mm时,接受化疗的患者较未接受化疗的患者预后更好(OS:P=0.000,aHR=0.596;BCSS:P=0.049,aHR=0.730,图3)。

图1 不同亚组患者的预后分析A.总生存率;B.特异性生存率
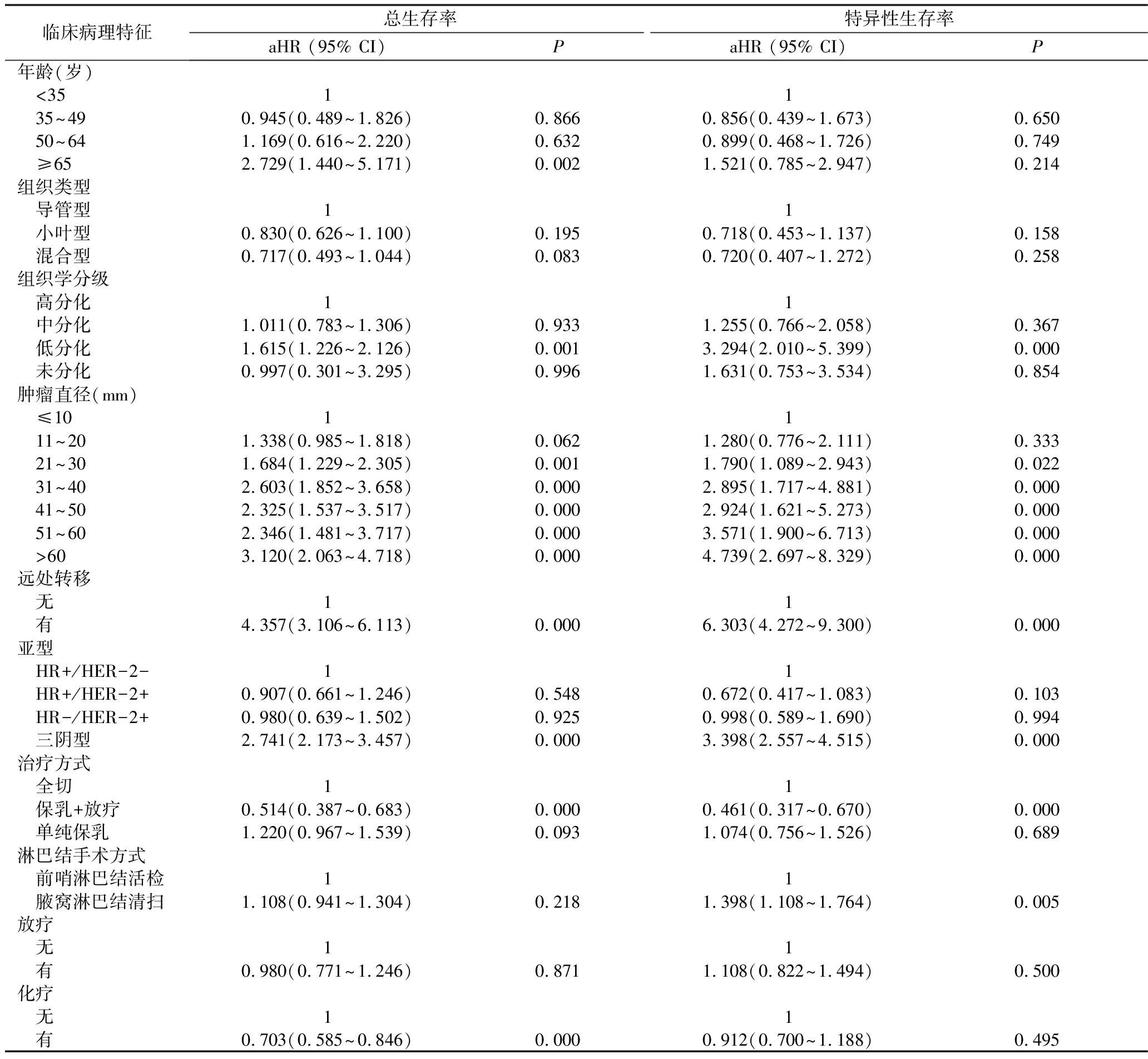
表2 N1mi患者总体生存率和特异性生存率的危险因素分析
N1mi.微小淋巴结转移;HR.激素受体;HER-2.人类表皮生长因子2
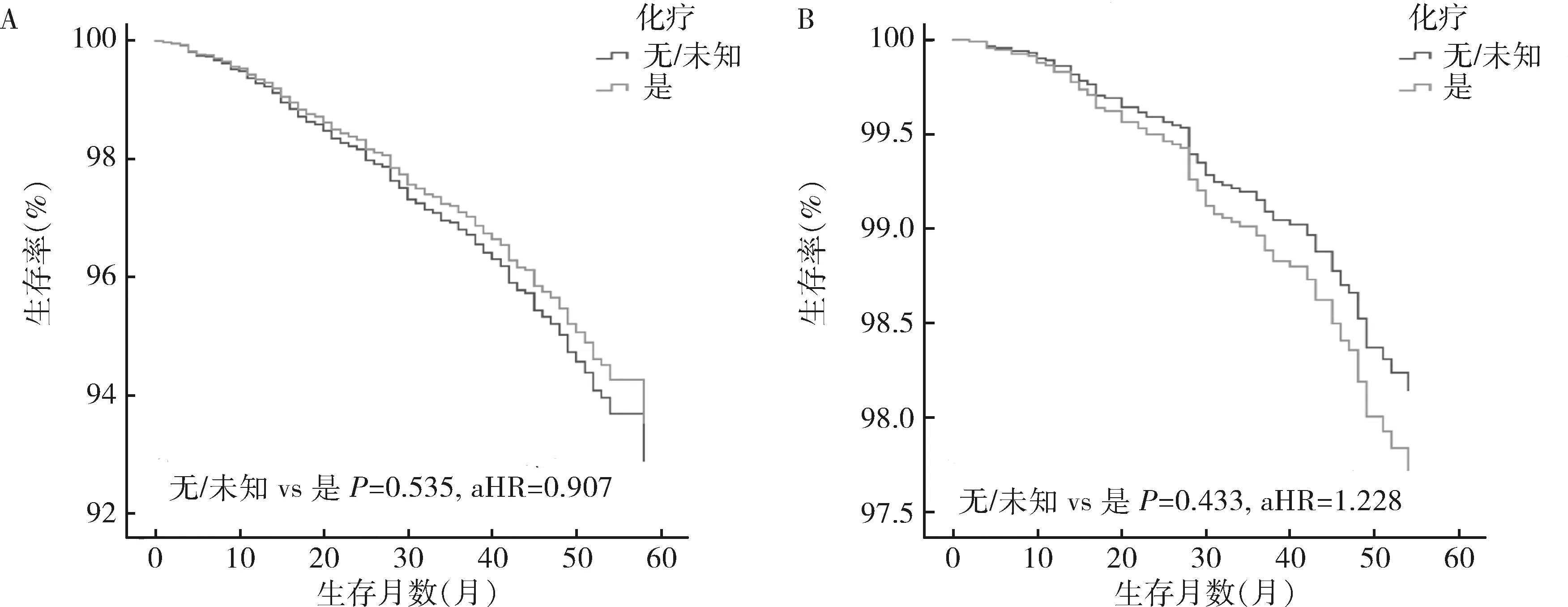
图2 N1mi组患者肿瘤≤20mm时化疗组与未化疗组的预后分析A.总生存率;B.特异性生存率
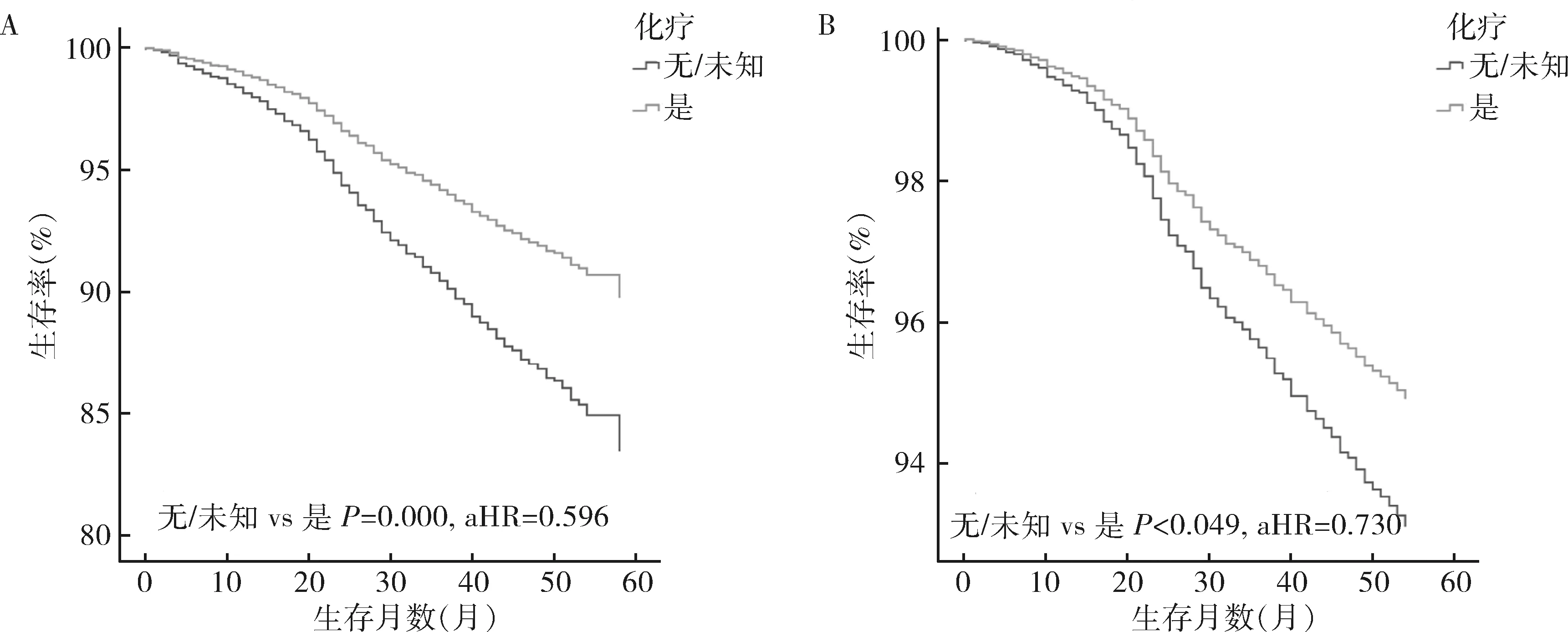
图3 N1mi组患者肿瘤>20mm时化疗组与未化疗组的预后分析A.总生存率;B.特异性生存率
讨 论
腋窝淋巴结微转移患者的预后究竟与淋巴结无转移者相似还是更差,在国内外仍存有争议。一些研究表明ITC是乳腺癌患者的不良预后因素[8,9]。其中一项研究显示ITC患者的5年乳腺癌特异性病死率和5年远处转移率均增加[8]。本研究结果显示,ITC患者和淋巴结阴性患者的预后相似,ITC不是乳腺癌的预后指标,这与国内的文献报道相一致[10,11]。不同的研究结果可能需要增加随访时间来进一步验证。同时有研究认为ITC不是真正的转移性疾病,而只是外伤性上皮细胞移位的结果[12,13]。
腋窝淋巴结的N1mi分期是乳腺癌预后的重要预测因素。本研究结果显示N1mi患者的预后比N1患者好,但比ITC患者及N0患者预后差,这与两项大型队列研究NSABP试验B-32和Mirror研究结果相似,因此腋窝淋巴结的微小转移N1mi与早期乳腺癌无病生存率的降低有关[9,14]。ITC和N1mi均属于淋巴结微转移但患者预后却不相同,这可能因为淋巴结的肿瘤负荷是一个连续变量,预后与淋巴结的肿瘤负荷有关,肿瘤负荷越多预后越差。
本研究结果表明,ITC和N0患者的预后相似,但N1mi患者预后更差,因此对待N1mi患者的治疗应更加积极,选择更恰当的治疗方式。在N1mi组中,保乳手术联合放疗比乳腺全切患者的预后要好,原因可能为保乳手术的患者术后往往联合了放疗,这可能改善了预后[15]。因此N1mi患者手术方式选择上,当有保乳指征时更建议选择保乳手术。
Mirror研究显示,N1mi的乳腺癌患者在接受辅助化疗时5年无病生存率(DFS)显著提高。而另一项大型队列研究报告指出,N1mi患者比N0病患者在更大程度上受益于激素治疗,而化疗几乎没有什么益处[16]。本研究结果显示N1mi患者是否需要化疗与肿瘤的直径有关,肿瘤>20mm时N1mi患者接受化疗后能改善患者的预后,而肿瘤≤20mm时化疗并不能改善患者生存。因此建议根据N1mi患者的肿瘤直径进行分层指导不同的辅助化疗策略:当肿瘤≤20mm考虑到化疗的不良反应及化疗并不能改善患者的生存,不推荐行化学辅助治疗;当肿瘤>20mm时,患者接受化疗后的预后有改善,能从辅助化疗中获益,因此更推荐术后行辅助化疗。当然,术后辅助治疗策略的制定往往是多因素决定的,比如肿瘤的分子分型等,因此需更多的前瞻性研究来提供参考。
本研究通过大样本回顾性分析表明了ITC对乳腺癌的预后价值不大,但N1mi是乳腺癌预后的危险因素。对于N1mi患者选择保乳手术联合放疗可能是一种更优的手术方式,而肿瘤>20mm时术后更建议行化疗。本研究的局限性在于回顾性分析导致的选择偏倚,同时缺少内分泌治疗及靶向治疗的相关信息。因此今后仍需开展更多的前瞻性研究,从而为乳腺癌腋窝淋巴结微转移的患者制定更优化的诊疗策略。
