维生素D3对自发高血压大鼠主动脉环血管内皮依赖的收缩及舒张的影响机制研究
2020-03-30屈晨祝岩
屈 晨 祝 岩
高血压是导致心脑血管疾病发生、发展的重要因素之一。高血压会损害血管内皮的功能, 同时血管内皮的功能障碍反之也会加重并恶化高血压愈后,因此血管内皮收缩因子的增多与减少被认为是高血压病发生、发展过程中的重要因素[1,2]。同时血管内皮的功能异常在高血压病、动脉粥样硬化、冠心病及缺血-再灌注损伤、休克等许多心血管疾病的发生、发展过程中具有重要的意义[3~5]。研究表明,人体内维生素D的水平与心力衰竭、心血管疾病的发生率呈反比[6~8]。人们发现在长期接受维生素D的治疗后, 慢性肾功能不全患者的心血管事件的发生率以及病死率有明显降低的趋势,并且透析前死亡风险也相对降低[9,10]。相关研究发现,血液中的1,25二羟基维生素D的浓度越低,心肌梗死的风险会越高[11]。维生素D3是维生素D族中有着最高生物代谢率的一种活性形式,与动脉血压呈负相关[12~14]。研究发现,个体产生或者摄入维生素D不足会有更高的高血压易患因素[15~17]。
虽然维生素D3在降压方面的研究很多,但涉及血管内皮收缩与舒张的作用及机制的研究尚少。本研究旨在探讨维生素D3对高血压状态下血管内皮舒张与收缩的影响及环氧化酶(COX)的信号转导途径的机制研究,以探讨维生素D3的抗血管收缩及抗高血压保护作用机制。
材料与方法
1.实验动物及分组:选择雄性自发性高血压病大鼠(spontaneously hypertensive rats SHR)(北京维通利华实验动物技术有限公司),38~42周龄,体质量600~800g,实验开始前测量老鼠血压≥160/90mmHg(1mmHg=0.133kPa)可以入组。将大鼠分为维生素D3治疗组和对照组,每组20只。维生素D3治疗组给予维生素D310ng/(100g·d)灌胃,持续3周治疗;对照组给予蒸馏水1ml/(kg·d)灌胃,疗程3周。所有大鼠给予正常喂食及饮水,每日喂药前测量体质量。3周的治疗结束后,测量血压,给予自发性高血压病大鼠苯巴比妥70mg/kg腹膜下麻醉,留取血样,离取主动脉环用于实验。
2.试剂与仪器:换能器(美国Assay Designs公司),放大器(Powerlab model ML785 and ML119),多导生理记录仪(美国AD Instruments公司),Bio-Rad蛋白分析仪(美国Bio-Rad公司);一氧化氮合成酶抗体及环氧化酶-1抗体(美国R&D公司),过氧化物酶标记的兔抗山羊IgG抗体(美国R&D公司)。ELISA试剂盒 (美国Caymen Chemical公司) 测量内皮收缩因子的释放。
3.实验方法:(1)对自发性高血压病大鼠每日测量体质量。直到实验前记录并比较两组实验动物的体质量变化。(2)经给药3周后,对比维生素D3治疗组及对照组自发性高血压病大鼠血压的变化。采用Tail-cuff方法测量鼠尾的血压。(3)血管张力的测定:离取大鼠的主动脉,阻断血流,离断血管后10min内获得靶血管,保存在4℃克-林二氏重碳酸盐缓冲液中。观察靶血管管壁有无肉眼可见病变或是动脉粥样硬化性改变。取得的血管环用两根钢丝牵引,操作在10ml的组织水浴槽(37℃、pH 7.4、95% O2、5% CO2)中进行。拉力传感器、换能器、放大器及多导生理记录仪等检测设备连接钢丝的一端上,用以记录等长张力的变化;钢丝另一端则固定于可以精细调节的装置上用以调节被动张力。组织水浴槽需要用缓冲液冲洗,间隔15min,直至平衡至少90min。在此期间,让实验血管环逐渐达到最佳静息张力状态。可给予2.5g血管环静止的持续性张力,该状态直至实验结束,即所有实验均在此状态/实验平台上完成。部分实验中通过浸泡血管环于triton溶液中(0.1%)30s,从而去除血管内皮,用于对照实验。(4)一氧化氮(NO)测定:给药3周后,维生素D3治疗组及对照组自发性高血压病大鼠给予戊巴比妥100mg/kg皮下注射麻醉后,留取血液样本。购买ELISA试剂盒,测量NO含量。(5)一氧化氮合成酶、环氧化酶-1(COX-1)蛋白表达:将血管组织冷冻于提取缓冲液(1∶3wt/vol),主要成分为140mmol/L NaCl,10mmol/L Tris HCl, pH 7.5,1mmol/L EDTA,25%甘油, 0.5% SDS, 0.5% 已基苯基聚乙二醇(Nonident P-40), 0.1mmol/L PMSF, 100ng/ml 蛋白酶混合抑制剂;然后行均质化处理(30s、2000r/min)。离心(4℃、10min、14000r/min), 采用Western blot法来测量上清液蛋白浓度,采用Bio-Rad蛋白分析仪,-80℃液氮冷冻保存。在十二烷基磺酸钠中加入血管胞质蛋白40μg,95~100℃ 5min。然后行10%十二烷基磷酸钠-聚丙烯酰胺凝胶电泳。电泳后转膜,置于5%脱脂奶粉溶于TBST中2h。将山羊抗人一氧化氮合成酶及环氧化酶-1抗体以1∶400比例稀释于TBST(含5%牛血清白蛋白)中,4℃过夜。然后加入辣根过氧化物酶标记的兔抗山羊IgG抗体1∶2000稀释于TBST(含5%脱脂奶粉)中,室温孵育1.5~2.0h,再次洗膜。然后与1∶20稀释的LumiGLOTM发光剂及过氧化物反应1min,自显影。(6)血管内皮收缩因子测定:离体血管环经过收缩实验后前列腺素释放内皮依赖性收缩因子,主要包括(PG)F1α(PGF1α)、PGF2α和血栓素A2,收集浴槽内液体通过ELISA法进行分析。
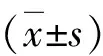
结 果
1.体质量及血压改变:经过维生素D3长期应用,治疗组体质量保持上升,对照组大鼠体质量在20天时开始呈下降趋势(图1A),治疗组血压较对照组血压明显下降(图1B)。

图1 维生素D3对体质量及血压的影响A.体质量;B.血压;与对照组比较,*P<0.05
2.离体主动脉血管张力测定结果:给予维生素D3治疗3周后,比较主动脉环(有血管内皮)的药物浓度舒张曲线。维生素D3治疗组血管环的药物浓度舒张曲线较对照组降增加达43.0%±2.3%。随之继发性血管收缩(图2A)。给予维生素D3治疗3周后,比较主动脉环(无血管内皮)对硝普钠的药物浓度舒张曲线。维生素D3治疗组血管环的药物浓度舒张曲线较对照组无改变(图2B)。给予维生素D3治疗3周后,比较主动脉环的药物浓度收缩曲线。维生素D3治疗组主动脉环的药物浓度收缩曲线较对照组降低血管收缩达24.0%±1.5%。无血管内皮组,无明显血管收缩(图2C)。
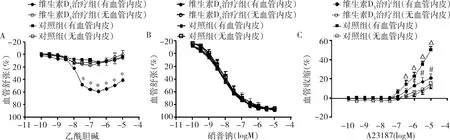
图2 维生素D3对血管张力的影响A.血管舒张;B.血管舒张;C.血管收缩;与其他3组比较,*P=0.001;与对照组(有血管内皮)比较,#P=0.007;与对照组(无血管内皮)比较,ΔP=0.021
3.NO含量测定:经过维生素D3长期给药,维生素D3治疗组一氧化氮释放较对照组明显上升,详见图3。
4.血管内皮一氧化氮合成酶的蛋白表达:在自发性高血压病大鼠经过3周维生素D3给药后,在有血管内皮存在的基础上,一氧化氮合成酶表达明显增加,详见图4。
5.血管内皮环氧化酶-1蛋白表达:在自发性高血压病大鼠中,给予维生素D3药物治疗3周后,在有血管内皮存在的基础上,环氧化酶-1表达明显减少,无血管内皮的存在,环氧化酶-1的表达无区别,详见图5。
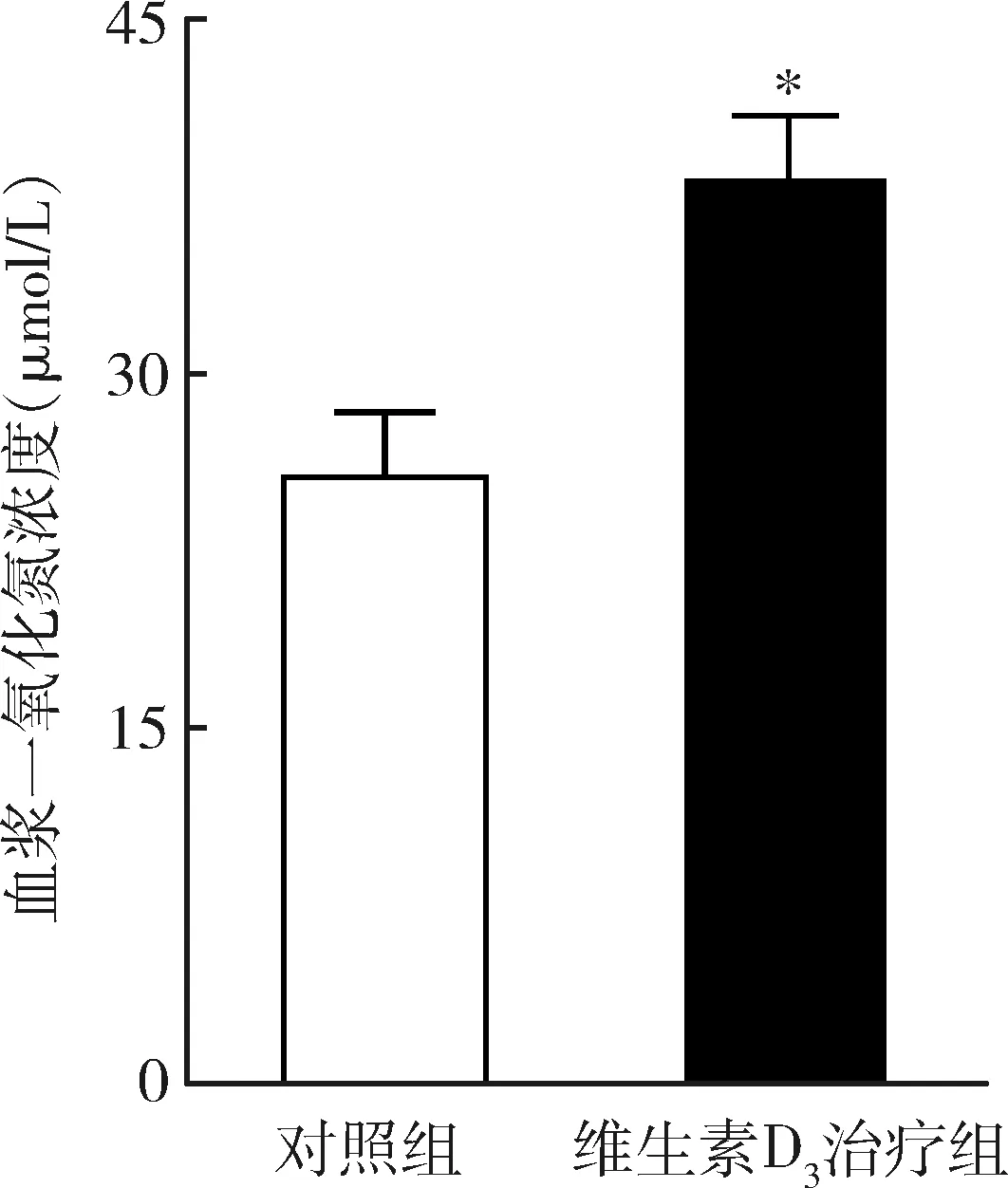
图3 一氧化氮的表达与对照组比较,*P=0.001
6.血管内皮收缩因子的释放:血管内皮收缩因子的释放主要依赖测定其代谢产物的表达。与对照组比较,维生素D3可以明显减少6-keto prostaglandin F1α(PGF1α, 前列环素的稳定代谢产物)、PGF2α和thromboxane B2(血栓素A2的稳定代谢产物)的释放,与对照组释放相似,详见图6。
讨 论
血管内皮可以通过释放血管活性物质控制内皮下平滑肌细胞发挥调节血管紧张性的作用[18]。本研究应用乙酰胆碱激发的血管舒张实验结果显示,在有血管内皮的情况下,长期维生素D3治疗可以增加内皮依赖的血管舒张作用;在没有血管内皮的情况下,血管不产生舒张,治疗组和对照组之间比较差异无统计学意义。同样,在应用A23187激发的血管收缩实验中,也获得了与乙酰胆碱舒张实验结果相似的趋势,即有血管内皮存在可增加收缩作用,无血管内皮则无效果。应用硝普钠进行管舒张实验显示,维生素D3治疗组与对照组比较,血管舒张程度一致,既不受有无血管内皮的影响,也不受药物治疗影响。这些现象证明了长期维生素D3治疗影响血管的收缩与舒张没有改变自发高血压大鼠的主动脉血管平滑肌的生物活性,只对血管内皮起到有效的作用。与此同时,血管内皮依赖的血管张力实验证明,血管舒张在长期治疗给药后可以得到明显修复;血管的收缩明显降低,证明了血管舒张与血管内皮收缩存在一种平衡机制,相互协调与制约。这也说明在疾病的发生、发展过程中血管内皮的活性变化是制约血管收缩与舒张的先决条件。本实验结果中一氧化氮及收缩因子的测定更进一步证明了该结论。
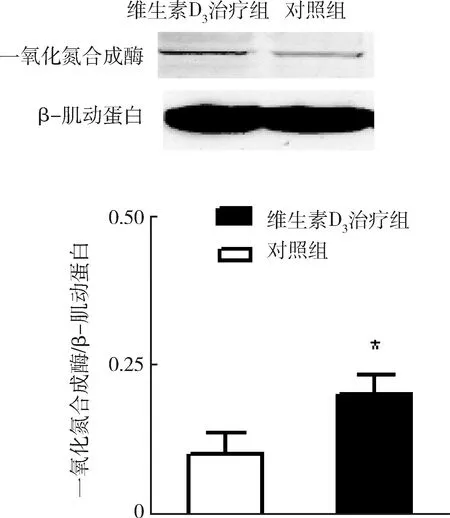
图4 一氧化氮合成酶的蛋白表达与对照组比较,*P=0.021
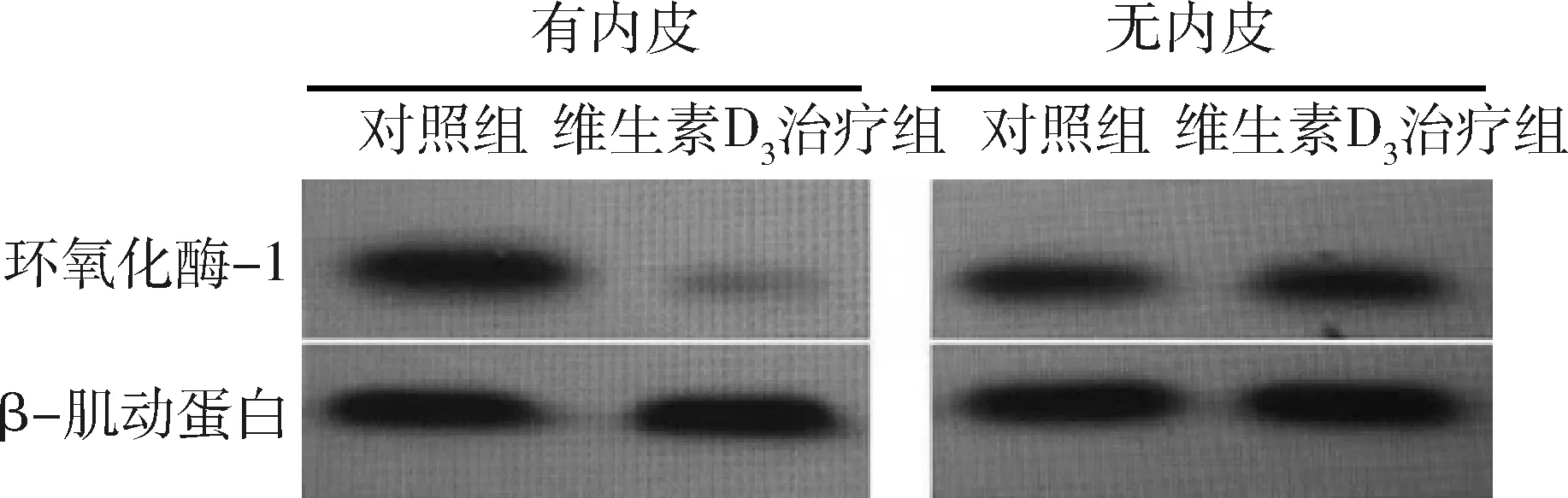
图5 环氧化酶-1蛋白表达
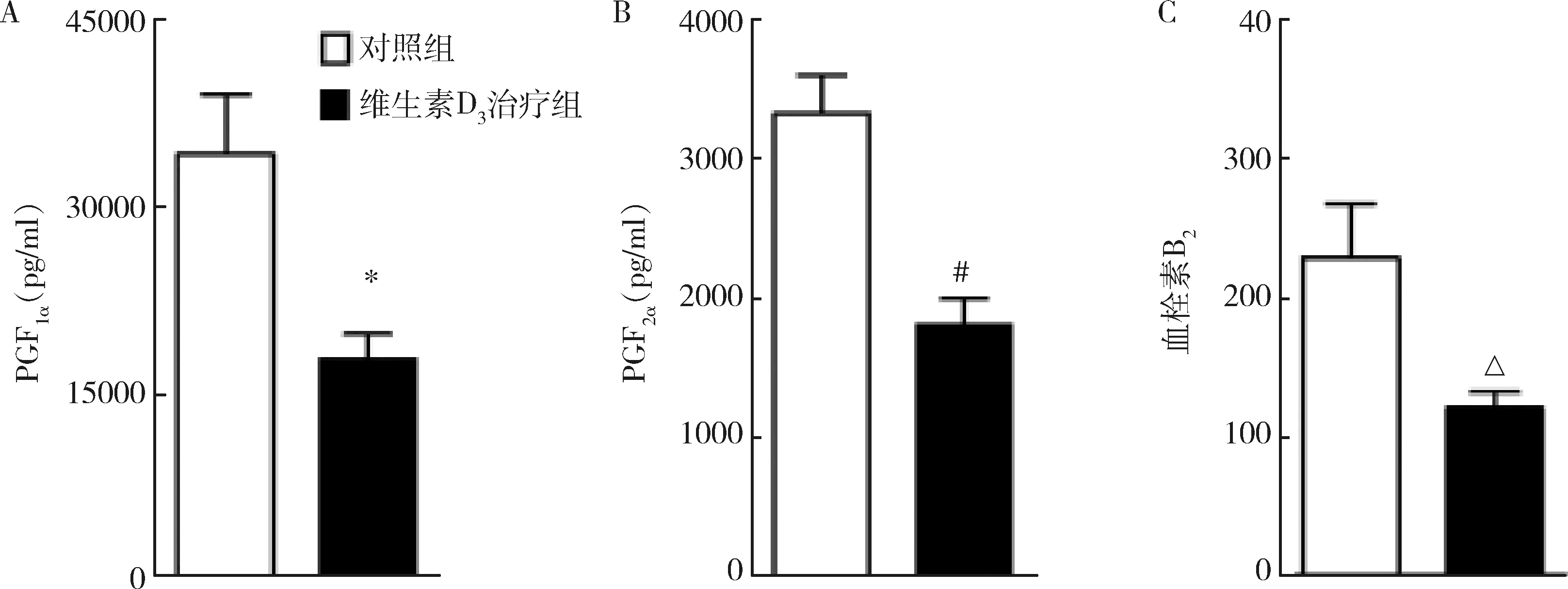
图6 血管内皮收缩因子的测定A.6-酮前列腺素 F1α(PGF1α);B.前列腺素F2α(PGF2α);C.血栓素 B2;与对照组比较,*P=0.017,#P=0.013,ΔP=0.012
在众多血管内皮释放因子中,由一氧化氮合成酶合成的一氧化氮在内皮依赖性血管舒张因子中起到最为重要的作用[19~21]。血管内皮的损伤通常发生在一氧化氮合成酶表达降低,一氧化氮合成减少,如高血压[22]。维生素D3对血管内皮有良好的保护作用,同时可以增加一氧化氮合成酶的活性作用[23]。除了释放一氧化氮之外,血管内皮可以在一氧化氮合成减少的情况下,释放血管收缩活性物质,如前列腺素类,从而导致血管收缩更加严重[24]。本研究旨在证明在动物实验中长期应用维生素D3是否可以影响血管内皮的收缩。血管内皮收缩因子的产生是通过环氧化酶(COX)介导的。环氧化酶-1被证实是介导血管内皮收缩因子产生的关键酶[25]。本研究中,自发高血压大鼠经过3周维生素D3治疗后,环氧化酶-1的表达明显降低,环氧化酶-2无改变(该组数据未呈现)。因此环氧化酶-1被证实是在自发高血压大鼠中介导血管内皮收缩因子产生的关键酶。当考虑到血管内皮收缩时,很多实验主要考虑到的影响血管内皮收缩因子合成的酶即为环氧化酶-1。有研究证明,在自发高血压大鼠中,环氧化酶-1的表达是增高的。维生素D3长时间干预后,自发性高血压病大鼠胸主动脉血管环的收缩较对照组明显减低,收缩状态得到明显改善,结果提示维生素D3是血管内皮损伤的保护性修复因素。综上所述,环氧化酶-1蛋白的表达在维生素D3长期给药后明显减少,证明维生素D3可以改变环氧化酶-1的表达在有疾患的血管,并且可以减少环氧化酶-1的过度表达。
维生素D3是维生素D主要活化形式,其血清浓度与动脉血压的数值呈反比关系[12]。在大鼠中维生素D的缺乏已被证实与心肌纤维化和心肌肥厚明显相关。日前可以系统逆转心血管内皮细胞损伤的方法并不多见,而维生素D3可以做到。这是一种修复心血管系统的非常廉价的措施。维生素D3可通过刺激一氧化氮产生,降低血管内皮细胞的氧化应激程度,从而改善血流,起到保护血管的作用。晒太阳会使身体自然产生维生素D3,但仅通过这一途径难以获取足够的维生素D3,并且在阳光中过多暴晒会增高皮肤癌等患病风险。而口服补充外源性的维生素D3就更容易实现。
综上所述,长期持续给予维生素D3治疗可以减少自发高血压大鼠主动脉的血管内皮收缩,这种抑制效应伴随着血压的下降、一氧化氮合成酶的升高及环氧化酶-1的合成减少。受研究条件和动物数量所限,本研究仍然存在一定局限性,如只研究了一个剂量的维生素D3治疗组,未能进行不同治疗剂量之间效果差异的对比;未能进行不同给药时间情况下各项指标的动态监测。后续研究笔者将增加剂量和时间点的设置,并采用蛋白组学或转录组学等高通量检测手段,在基因调控和蛋白表达的水平上对该机制进行进一步阐明。
