副猪嗜血杆菌试验感染KM小鼠及在其体内的分布
2020-03-30王丽荣董永军张守平樊俊洋李任峰王振伟王三虎
王丽荣 , 董永军 , 张守平 , 樊俊洋 , 李任峰 , 王振伟 , 李 玲 , 王三虎
(河南科技学院动物科技学院 , 河南 新乡 453003)
副猪嗜血杆菌(Haemophilusparasuis,Hps)属于巴氏杆菌科嗜血杆菌属,革兰阴性多形性杆菌,能引起猪的格氏病,表现浆膜炎、关节炎和脑炎的一种高度接触性呼吸道传染病。根据琼脂扩散(Kieletein-rapp-gabriedson,KRG)血清分型方法,Hps分为15种血清型,且不同的血清型其毒力有一定的差异,血清型1、5、10、12、13、14具有高致病力,能够引起动物死亡 ; 血清型2、4、8、15具有中等毒力,能够引起猪的多发性浆膜炎,但并不引起死亡 ; 但是血清型3、6、7、9、11不引起明显的临床症状和病理损伤[1]。
Hps生物学特性复杂,目前国内对此病的报道多在病原分离鉴定、血清学调查、诊断技术和疫苗研制等方面,而有关Hps致病机理方面的研究很少报道,其致病机理和毒力因子至今尚不完全清楚。构建稳定、可靠的活体感染模型是深入研究这些问题的关键。而常规的饲养猪复制Glasser’s病例,结果很难达到预期效果,且生产成本高也不易饲喂。国内外学者曾使用禁食初乳猪[2-3]、自然分娩未食初乳猪[4]作为实验动物,但由于其对试验条件要求和成本均较高,使得其实际研究有局限性,并不现实。SPF仔猪即Hps阴性仔猪,也曾被应用于Hps的活体感染模型,但目前条件下Hps阴性猪群已经很难找到,而且该方法同样对技术要求高,致使成本昂贵,操作难度更大且不可靠,其应用研究有局限性[5-6]。因此,很多学者探索用经典的实验动物小鼠作为替代动物模型研究Hps的相关机理。
本试验用Hps河南地区临床分离野毒株和血清5型标准毒株采用腹腔、灌胃感染实验动物小鼠,通过观察发病或死亡情况和病原再分离,探索河南野毒株对KM小鼠的致病力,并检测Hps在KM小鼠体内的分布,比较不同接种途径对KM小鼠致病的差异,评价Hps河南地区野毒株和血清5型标准株对KM小鼠的致病性,以选择一种经济、稳定及易操作的感染模型,构建副猪嗜血杆菌的动物感染KM模型,为深入研究Hps的致病机制、免疫及疾病防控等提供科学依据。
1 材料与方法
1.1 主要试剂 胰蛋白大豆琼脂(TSA)和胰蛋白大豆肉汤(TSB),均购自郑州久是生物技术有限责任公司;烟酰胺腺嘌呤二核苷酸NADH,购自广东美津生物技术有限公司;犊牛血清,购自北京鼎国生物技术有限责任公司。
1.2 菌株、实验动物 副猪嗜血杆菌标准菌株血清5型(BZ),购自中国兽医药品监察所菌种毒种保藏中心;河南野毒株血清5型(YD)由河南科技学院预防兽医学实验室分离鉴定冻存。
昆明(KM)小鼠,雌性,体重18~20 g,购自新乡医学院实验动物研究中心。
1.3 动物感染试验 KM小鼠随机分为6组,每组7只,其中1~2组为灌胃(ig)感染组,3~4组为腹腔(ip)注射感染组,5~6组为对照组。
将2个Hps菌株分别接种含10%犊牛血清、0.1%NAD的TSB培养基,37 ℃、150 r/min摇床培养16 h,将培养物配制成1×109CFU剂量,采用灌胃、腹腔注射2种途径感染小鼠[7-8],接种剂量为腹腔注射每只0.5 mL,灌胃每只0.5 mL,对照组灭菌生理盐水,每只0.5 mL。
不同接种途径感染小鼠后,观察小鼠出现的临床症状,记录小鼠死亡数及出现的病变和Hps分离培养情况。未死亡小鼠观察1周剖检,观察病变和Hps分离培养,比较不同菌株对小鼠敏感性的差异。
1.4 临床和病理观察 感染后临床连续观察7 d,记录实验动物的临床表现;对死亡小鼠及未死亡小鼠攻毒7 d后进行剖检,观察剖检病变,并记录结果。
1.5 细菌在感染动物体内分布的测定 副猪嗜血杆菌分别感染各组小鼠,感染后死亡及未死亡小鼠于7 d脱臼法迫杀小鼠,无菌取脾脏、肝脏和肺脏,剪一小块组织称重后利用组织研磨器研磨,以无菌PBS稀释,取匀浆液均匀涂布于含新生牛血清和NAD的TSA平板上,每个稀释度做3个重复,37 ℃培养过夜,同时取胸腔渗出液、心血,无菌PBS稀释后涂板培养。
2 结果
2.1 不同途径感染小鼠结果 感染后连续观察受试动物7 d,发现Hps腹腔感染小鼠2 h左右出现精神不振,食欲下降,被毛竖立,肌肉震颤,并出现扎堆现象,见中插彩版图1;至5 h左右时,小鼠肌肉震颤渐渐消失,被毛竖立现象消失,依旧扎堆;其中有河南野毒株感染小鼠于43 h、50 h各死亡1只,即感染小鼠2/7死亡,标准菌株感染后44 h死亡1只,即1/7死亡。灌胃感染小鼠4 h左右出现上述症状,其中只有河南野毒株组46 h死亡1只。对照组小鼠正常。结果见表1、图2。

表1 感染小鼠死亡情况Table 1 Death of infected mice (只)
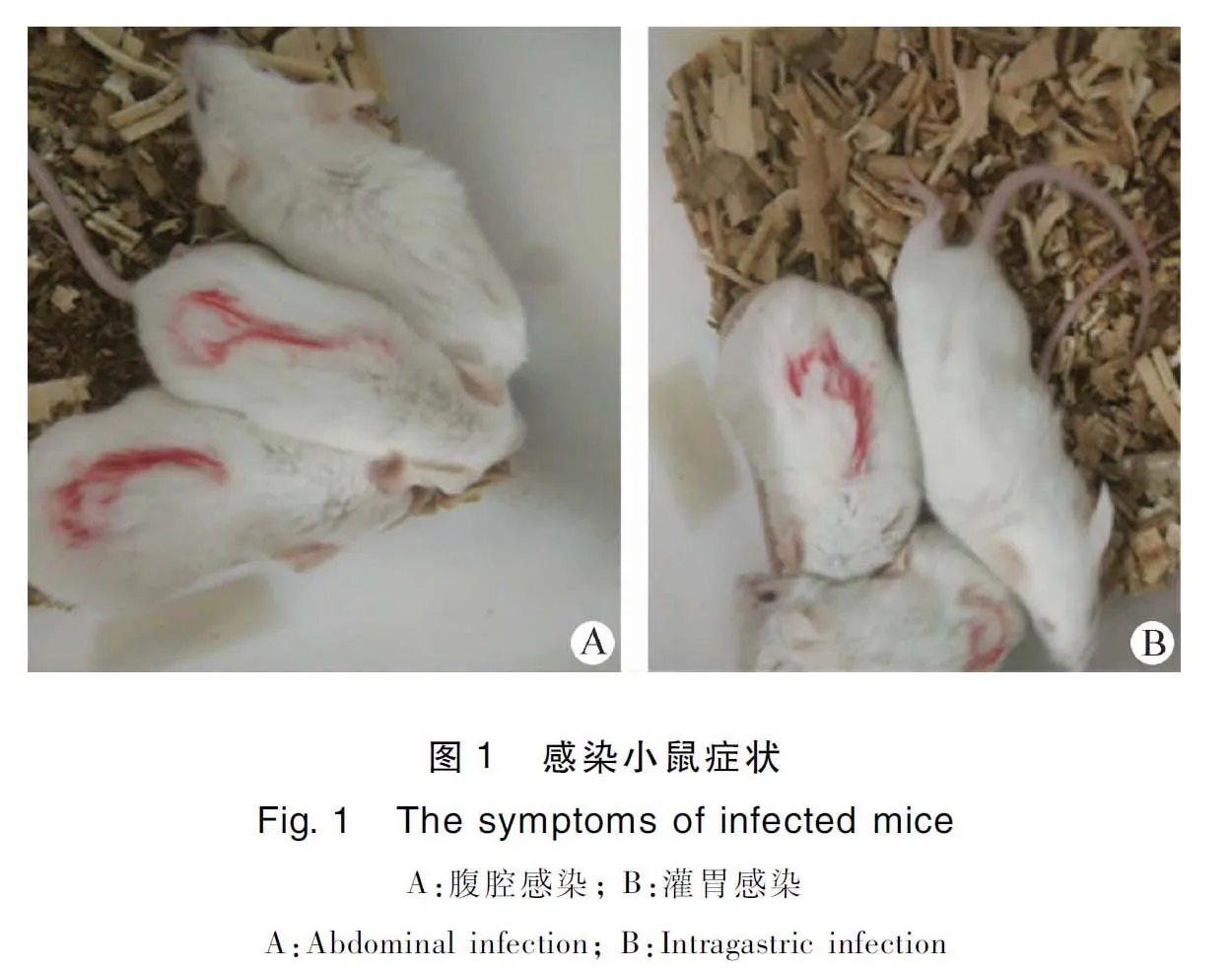

图2 感染小鼠的死亡率Fig.2 Death rate of infected miceA:腹腔感染; B:灌胃感染A:Abdominal infection; B:Intragastric infection
剖检发现,1~2组小鼠腹腔感染后,河南野毒株感染死亡的小鼠胸腔有积液,肺脏有出血点,胸腔有黑色血凝块,腹腔有轻微粘连,且其他脏器无明显变化;标准菌株感染组小鼠胸腔积液,肺脏出血,其他无明显变化。3~4组小鼠灌胃感染河南野毒株后,死亡小鼠剖检病变同腹腔感染组,见中插彩版图3。

2.2 病原分离结果 无菌取各组死亡和存活小鼠的胸腔积液、心血、肝脏、脾脏、肺脏,进行病原分离,测定其在组织脏器的分布,结果显示,河南野毒株和标准菌株均是腹腔感染组小鼠在心血和胸腔积液中分离到Hps,在肝脏、脾脏、肺脏中未分离到Hps;2菌株灌胃感染组小鼠和对照组小鼠的胸腔积液、心血、肝脏、脾脏、肺脏均未分离到Hps。见表2。
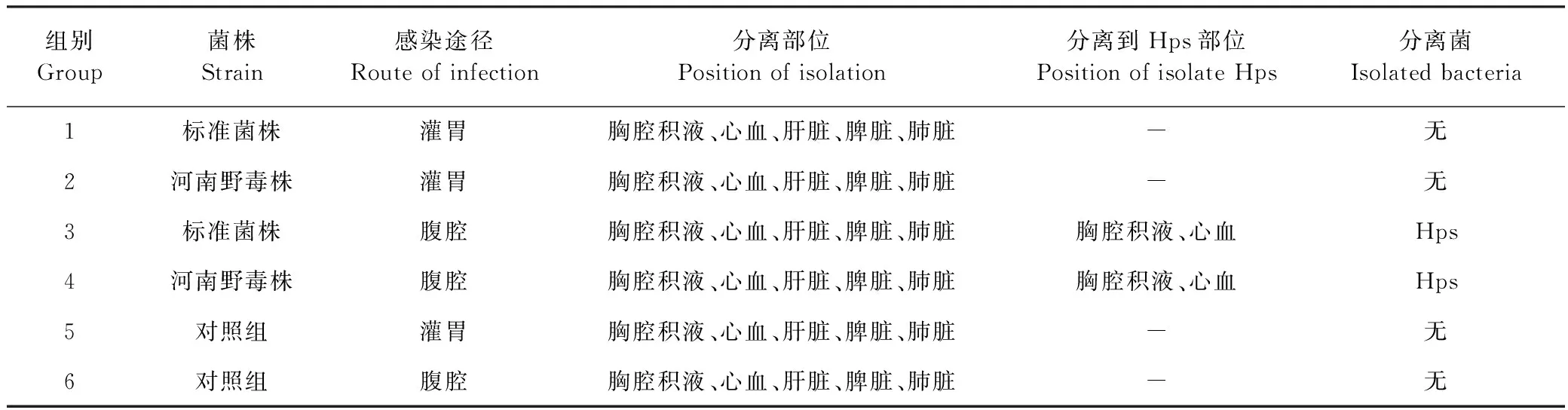
表2 感染小鼠Hps分离情况Table 2 Isolation of Hps from infected mice
3 讨论
副猪嗜血杆菌是猪群上呼吸道的一种常在定居菌,具有明显的地域特征,能够突破黏膜屏障导致全身性感染,其毒力是相对的,有时取决于猪感染的剂量和个体的易感性,毒力的差异所引起的保护性免疫应答能力也不相同,但目前Hps已成为猪场保育仔猪死亡的一个主要因素,其致病机理和毒力因子尚未完全清楚,Hps人工感染动物为阐明该病原菌的致病机理和寻找毒力因子提供了手段。Hps一般出现在混合感染的病例中,因此学者们通常认为Hps是某些疫病(如PCV2感染、Mhp感染或PRRSV感染)的继发病原,其原因是PCV2 或PRRSV能诱导感染动物免疫抑制,为细菌的继发感染创造条件,所以普通条件下感染该动物,不理想或重复性很差,用普通猪来作实验动物感染,成功的机率很低。本试验选用实验动物KM小鼠为研究对象,通过腹腔、灌胃感染 Hps 血清5型标准菌株和河南野毒株的液体培养物后,观察了受试动物的发病、死亡和病变情况,并对感染后各组织器官进行了Hps再分离,从而较系统的评估了 Hps 血清5型河南野毒株和标准毒株对常用实验动物KM小鼠的致病性。从试验的可操作性和经济方面考虑,在本试验中选用经典的实验动物昆明小鼠,腹腔、灌胃感染组均出现死亡,从小鼠肝脏、脾脏、肺脏不容易再次分离到Hps,这与贺云霞等[1]的结论基本一致,但能从死亡小鼠胸腔渗出液、心血中再分离到Hps,这与李雪松等[9]在小鼠心血中分离到Hps的结果一致。表明Hps可对KM小鼠致病,能引起小鼠发病,说明2个菌株的毒力均较强;受试动物死亡率不高及细菌分离率不高可能与感染剂量有关,这为KM小鼠作为Hps的感染动物模型的候选动物奠定了基础。
从出现的临床症状、小鼠死亡数、多发性浆膜炎及 Hps 分离培养,评估腹腔和灌胃2个途径感染的差异,表明腹腔感染优于灌胃感染组,且从试验操作可行性方面,腹腔感染更为简捷,易操作,这为研究Hps致病机理等提供了科学依据。
