过敏性疾病小鼠动物模型建立及表型变化的研究进展
2020-03-30白梦天胡竹林
白梦天,胡竹林*
(1.昆明医科大学第四附属医院,眼科,昆明 650032; 2.云南省眼科研究所,昆明 650032;3.云南省第二人民医院,眼科,昆明 650032; 4.姚克专家工作站,昆明 650032)
过敏性疾病在发达国家、部分发展中国家及地区已具有较高的发病率,这与当地经济因素、环境因素密切相关。不同个体致敏后,其抗体对于抗原的敏感性存在差异,且不同个体之间可能存在不同的临床表现,使得过敏性疾病的的临床表现及治疗存在较大差异[1]。为了更有效方便地研究过敏性疾病,过敏性疾病小鼠模型已经被广泛运用,并且取得了丰硕的成果。同时,研究者正尝试将成果服务于临床[2]。尽管不同的过敏性疾病发病机制不同,但构建过敏性小鼠模型时却常采用相同的方式,即抗原系统性致敏,其后进行局部激发。而常用的抗原包括卵清蛋白(ovalbumin, OVA)、豚草花粉(ragweed pollen, RW)、屋尘螨(house dust mites,HDM)等。致敏小鼠以发生I型和IV型过敏反应为主。包括嗜酸性粒细胞浸润、肥大细胞脱颗粒、抗原特异性IgE的产生,Th细胞的活化、Th1/Th2失衡等[3]。本文将对过敏性结膜炎、过敏性哮喘、特应性接触性皮炎、食物性过敏的小鼠动物模型构建以及表型变化进行综述。
1 过敏性结膜炎
据统计,过敏性结膜炎全球患病率约10%~30%,但真实患病率可能高于当前统计结果,可能的原因在于其缺乏特征性临床体征且部分患者未及时就诊。过敏性结膜炎作为一种免疫系统疾病,其与过敏性哮喘、食物性过敏具有相似的免疫学机制[4]。
过敏性结膜炎动物模型的建立首先需全身致敏,而后进行眼部抗原激发(表1)。目前认为,特异性IgE介导的I型超敏反应,特异性T细胞介导的IV型超敏反应与过敏性结膜炎具有密切关联。当机体处于致敏状态下,变应原与眼表肥大细胞膜FcεRI上的IgE结合,启动早期相反应(early phase reaction,EPR),引起肥大细胞脱颗粒,释放一系列细胞因子,如嗜酸性粒细胞趋化因子(eosinophilic chemotactic factor)、组胺(histamine)以及白三烯(leukotrienes)等[10]。当进入晚期相反应(later phase reaction,LPR)时,则可见大量嗜酸性粒细胞、嗜碱性粒细胞、T淋巴细胞浸润,并释放细胞因子、趋化因子,引起角结膜组织的炎性损伤。
树突状细胞(Dendritic cell,DCs)可将变应原收集并运输至淋巴结,激活T细胞,造成Th1/Th2漂移,Th2细胞优势表达。Th2细胞产生的IL-4、IL-5、IL-6、IL-13可促进IgE的产生,并促进IgE与肥大细胞膜FcεRI的结合,引起炎症损伤[11]。2000年IL-37被首次提出[12],IL-37属于IL-1基因家族成员,IL-1家族包含7个促炎因子(IL-1α、IL-1β、IL-18、IL-33、IL-36α、IL-36β、 IL-36γ),4个抗炎因子(IL-1R 拮抗因子、IL-36R拮抗因子、IL-37、IL-38)[13]。IL-37能够与IL-18竞争性结合IL-18Rα,招募孤儿受体IL-1R8。IL-1R8能够抑制先天性和获得性免疫,并且上调抗炎相关信号通路,如AMPK、JAK/STAT,下调促炎相关通路如NF-kB、NLR3等[14]。由于小鼠体内并不能检测到IL-37,因此无法使用基因敲除技术构建IL-37缺陷小鼠,但随着转基因技术的不断发展,IL-37转基因(IL-37 -transgenic, IL37-tg)小鼠已经成为过敏性疾病中研究IL-37常用的动物模型[15]。此外,经重组IL-37处理的野生型(wild-type, WT)小鼠同样能够发挥抗免疫作用[16]。当前,IL-37已经成为多种过敏性疾病研究的新热点。然而,IL-37在过敏性结膜炎的研究中还鲜有报道。
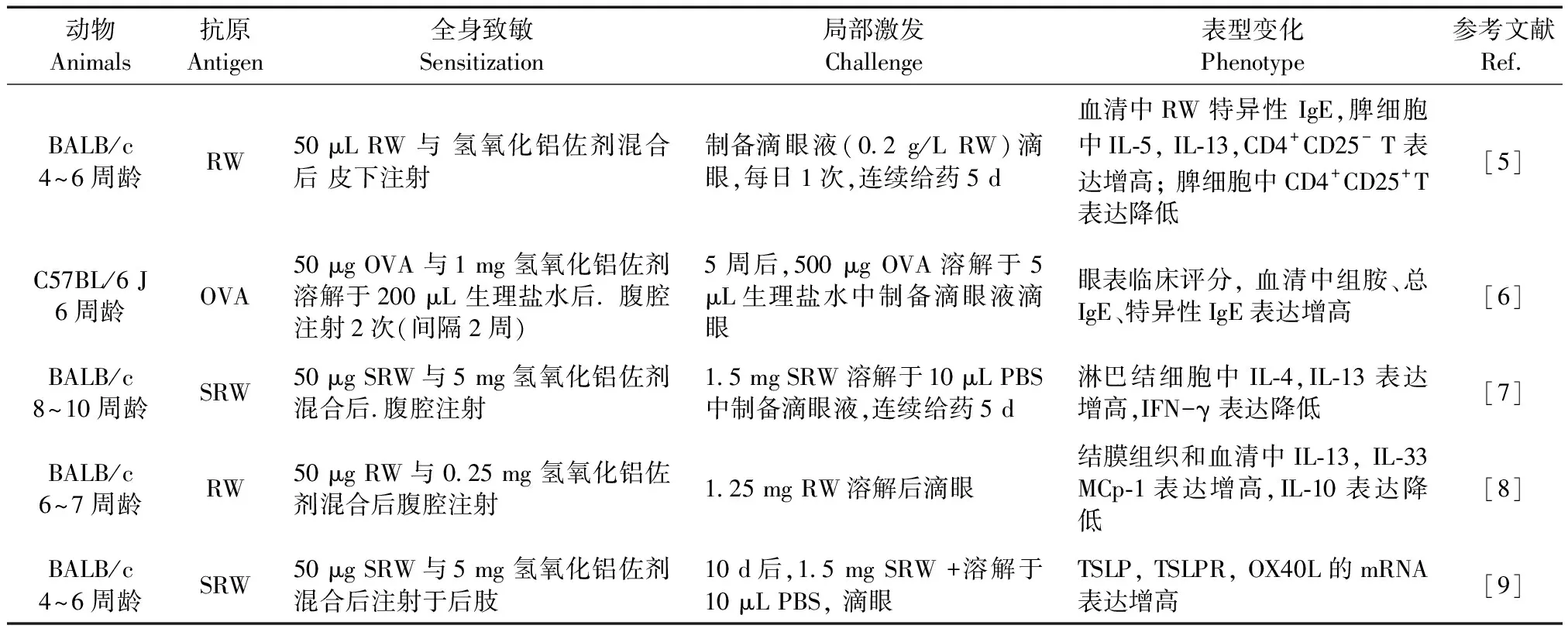
表 1 过敏性结膜炎小鼠造模方法及表型变化
注:RW:豚草花粉; OVA:卵清蛋白;SWR:短豚草花粉。
Note. RW, ragweed pollen. OVA: Ovalbumin. SWR:short ragweed pollen.
2 过敏性哮喘
由于小鼠致敏程度高、繁殖能力强且适合大规模饲养,因此成为该类疾病常用的模型动物。但有研究者[17]认为,过敏性哮喘小鼠不会自发地表现出气道高反应性(airway hyperresponsiveness,AHR),需要在模型成功建立的基础上使用支气管收缩剂,其原因为小鼠气道直径相对较大,不易出现可逆性气流阻塞,并不能直接反应气道受阻情况,但仍能观察到嗜酸性粒细胞浸润增加,CD4+细胞表达增高,特异性IgE表达增高等,Th1/Th2失衡等现象。
过敏性哮喘小鼠模型的建立分为致敏阶段和效应阶段,在致敏阶段需全身致敏,效应阶段则多采用雾化吸入方法激活效应细胞,从而引起过敏反应(表2)。在EPR阶段,IgE激活肥大细胞,使支气管平滑肌收缩,黏蛋白分泌增加以及炎性因子增加。在LPR阶段,随着炎性细胞迁移至肺组织和气道上皮细胞,引起气道平滑肌肥大、气道上皮脱落、杯状细胞化生以及上皮纤维化[23]。在过敏性哮喘小鼠模型中,IL-4主要作用于B淋巴细胞,增强肥大细胞、嗜碱性粒细胞中IgE受体的亲和力,从而促进抗原特异性IgE的产生。IL-5主要激活和招募骨髓组织中嗜酸性粒细胞。IL-13主要引起气道上皮细胞高反应性、杯状细胞化生以及激活巨噬细胞等[24]。
IL-37广泛分布在人体的各个器官和组织中,如肺、淋巴结、胸腺等,此外,人和小鼠的上皮细胞、树突状细胞、巨噬细胞有IL-18Rα。 给予过敏性哮喘小鼠rhIL-37滴鼻,在其肺泡灌洗液中发现Th2相关细胞因子显著下降,同时出现哮喘症状的明显改善[25]。而敲除IL-18Rα后,则无法观察到IL-37的抗炎作用[26]。提示IL-18Rα对于IL-37效应的发挥具有重要。IL-37发挥抗过敏性哮喘作用的机制也是研究者目前关注的热点。有研究认为在过敏性哮喘动物模型中,IL-37通过抑制IL-4/IL-6诱导的CCL1的产生而发挥作用[27]。Robuffo等[28]认为,IL-37通过抑制髓样分化因子88(myeloid differentiation factor 88,MyD88),进而抑制TLR通路而发挥作用。而Lunding等[25]发现IL-37可通过直接抑制Th2型细胞而发挥作用。IL-37对抗过敏性哮喘的机制可能涉及多靶点、多通路,但何种靶点或通路发挥了主要作用目前尚不得而知。
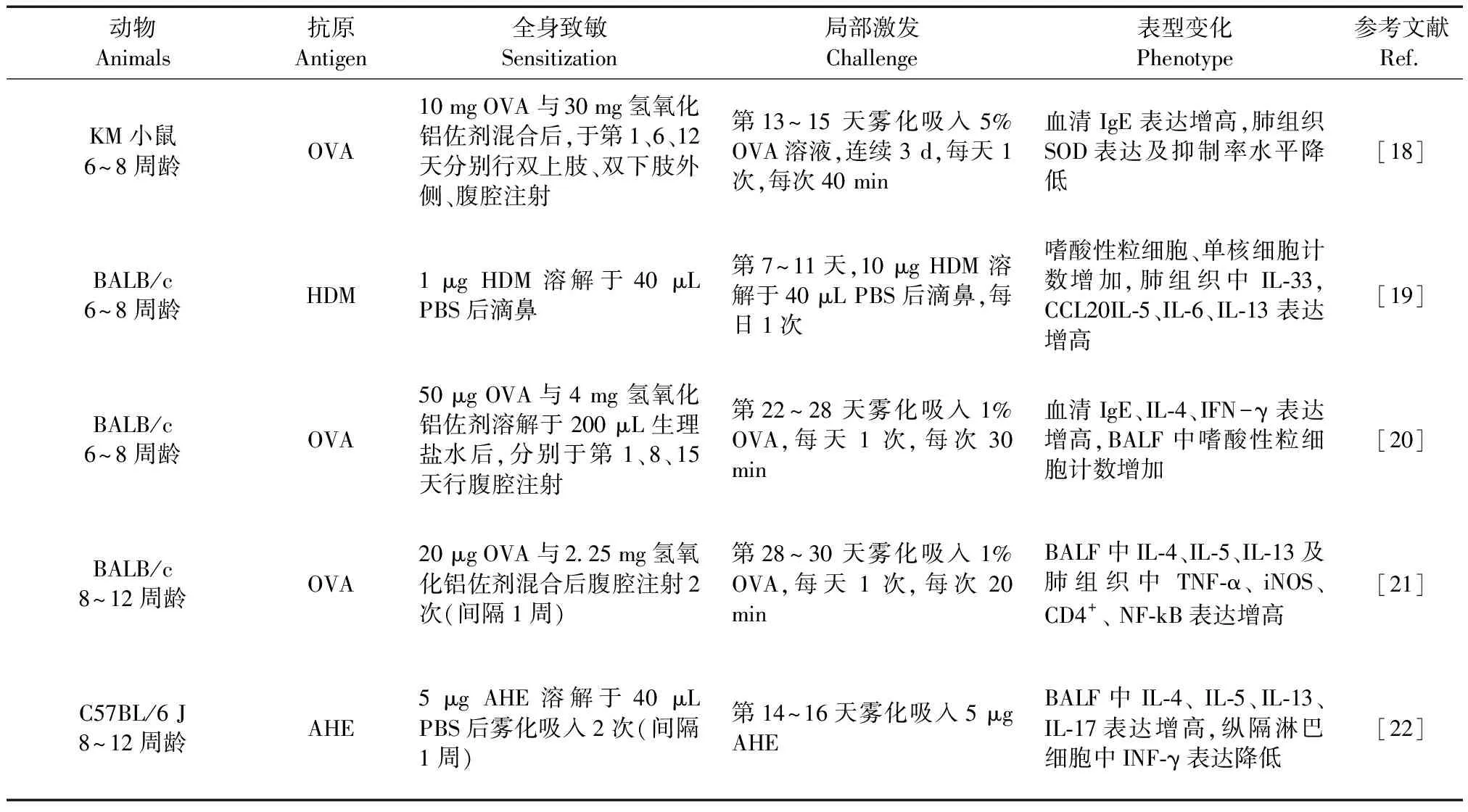
表 2 过敏性哮喘小鼠造模方法及表型变化
注:HDM:屋尘螨;AHE:曲霉菌丝提取物;BALF:支气管肺泡灌洗液;iNOS:诱导型一氧化氮合酶;SOD:超氧化物歧化酶。
Note: HDM, house dust mite. AHE, aspergillus hyphal extract. BALF, bronchoalveolar lavage fluid. iNOS, inducible nitric oxide synthase. SOD, superoxide dismutase.
3 变应性接触性皮炎
变应性接触性皮炎(allergic contact dermatitis, ACD)是由T淋巴细胞介导的迟发型(IV型)超敏反应,其致敏原为被称为半抗原(分子量小于500×103)。半抗原并不具备抗原性,但可与载体蛋白形成半抗原-载体蛋白复合体,皮肤的树突状细胞(dendritic cells,DCs)可将其捕获并移行至淋巴结。
抗原的呈递使T淋巴细胞致敏分化为不同亚群,如Th1细胞、Tc1细胞。当机体再次接触到过敏原后,Th1/Tc1细胞被激活并产生IFN-γ,并激活临近角质细胞而产生炎性反应[29]。
ACD动物模型又称为接触性超敏反应 (contact hypersensitivity,CHS),其半抗原主要有二硝基氟苯(dinitrofluoroben-zene,DNFB)、恶唑酮、三氯乙烯、甲苯二异氰酸酯、荧光素-5-异硫氰酸盐和硝基氯代苯(Trinitrochloro-benzene,TNCB)、等。目前经典的ACD小鼠动物模型建立方法为采用DNFB腹部涂抹,待小鼠全身致敏后,DNFB耳廓或背部涂抹激发(表3)。
目前已发现DCs三种亚群,即朗格汉斯细胞(Langerhans cells,LCs)、CD103-DCs、CD103+DCs。传统观念认为,皮肤中含有大量LCs、易于和抗原复合物结合且具有抗原呈递功能,其应该为诱导Th1/Tc1的主要细胞。但研究者敲除LCs基因后,发现CHS无明显改变;而敲除CD103+DCs基因后,CHS反应明显下降[35-36]。而Edelson等[37]又发现Batf-/-小鼠(先天性缺乏CD103+DCs基因)的CHS又未受到影响。因此DCs调控CHS的具体机制还需进一步研究。
有研究发现,维生素D可通过抑制Toll样受体抑制炎性反应,增强IL-10的产生,抑制DCs活化,降低Th1相关细胞因子的产生,诱导Treg细胞产生以及抑制B细胞活化和IgE的产生来发挥免疫抑制作用[38-39]。Malley等[40]观察到,缺乏维生素D的雄性小鼠对ACD更为敏感,而在雌性小鼠中无此现象存在。这提示维生素D可能确实存在抑制ACD作用,但目前此方面报道尚少,确切机制尚不清楚。
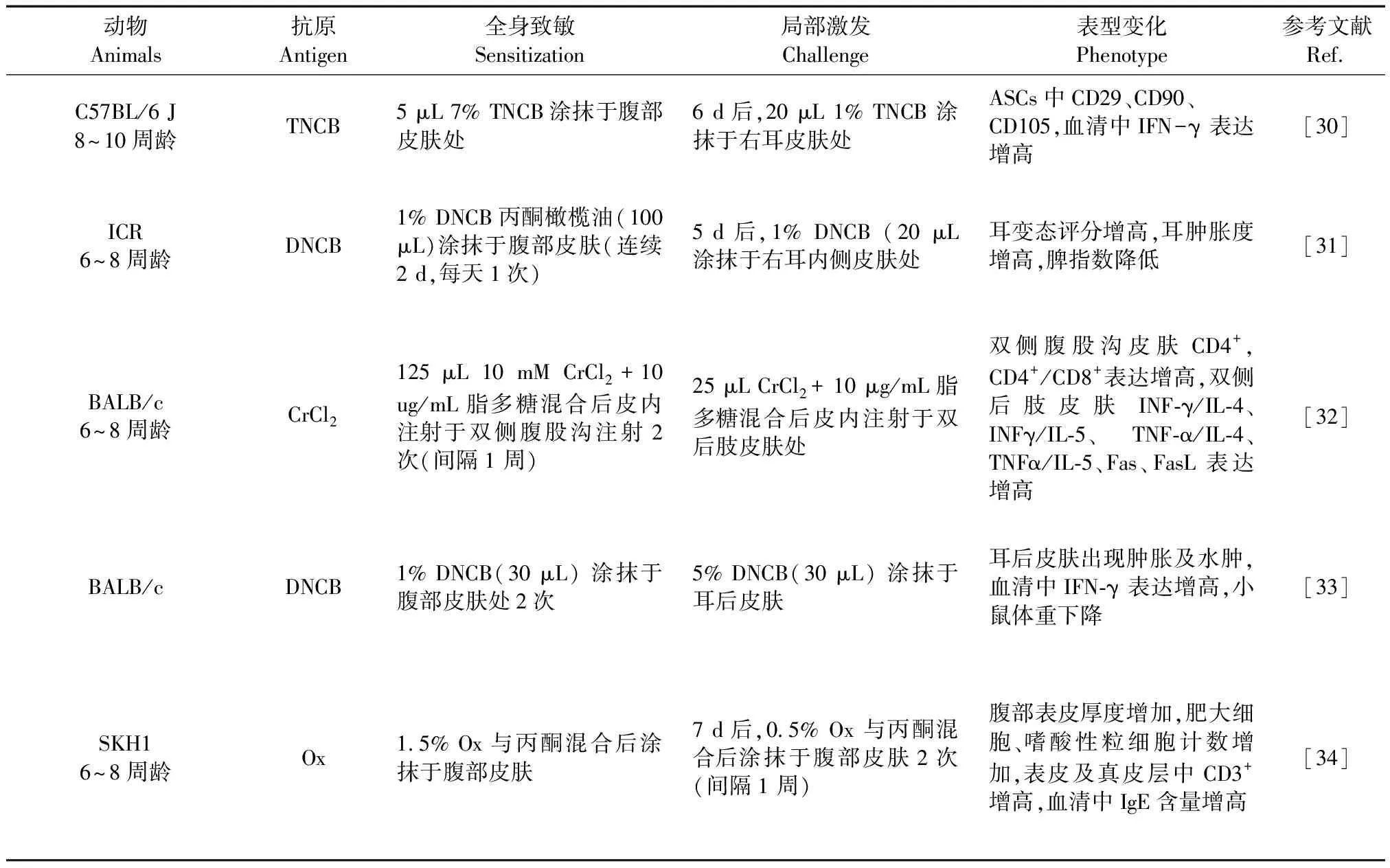
表 3 接触性皮炎小鼠造模方法及表型变化
注:TNCB: 2,4,6-三硝基氯苯;ASCs: 脂肪组织源性多能干细胞;SADBE: 接触敏化剂; DNCB:二硝基氯苯; Ox: 恶唑酮; DNFB: 2,4-二硝基氟苯。
Note. TNCB, 2,4,6-trinitro-1-chlorobenzene. ASCs, adipose tissue-derived multipotent mesenchymal stem cells. SADBE, contact sensitizer. DNCB, dinitrochlorobenzene. Ox, oxazolone. DNFB, 2, 4-Dinitrofluorobenzene.
4 食物性过敏
食物性过敏(food allergy,FA)的发病率仅次于呼吸系统过敏,且多为IgE介导的I型超敏反应。目前,被国际免疫学会认定的食物性过敏原超过100种,但90%的食物性过敏由牛奶、鸡蛋、鱼类、贝壳类、花生、大豆、小麦、坚果8类食物引起。在美国,儿童发病率高达8%,成年人高达2%~3%[41]。
同过敏性哮喘、过敏性结膜炎动物模型类似,FA小鼠模型也需全身致敏(多为腹腔注射),再予以口服抗原激发(表4)。由于食物中蛋白质的分子结构在胃肠道中会发生改变,其致敏性被降低,采取腹腔注射可更好的保证致敏原分子结构的完整性。此外,FA小鼠模型常会出现体温下降、腹泻等表现[46]。
在FA动物模型中,Th1相关因子(IFN-γ)含量显著下降,而Th2相关因子(IL-4、IL-5、IL-13)含量上升,出现Th1/Th2失衡,即“Th1/Th2漂移”现象。Liotta等[47]发现Notch通路被阻断后,IL-4含量降低但IFN-γ显著上升,且小鼠过敏症状明显减轻。这与Sauma等[48]的研究结果一致。提示Notch通路可能通过下调Th2,而上调Th1改善FA小鼠过敏症状。此外,Jiang等[49]在FA小鼠模型中使用Notch通路抑制剂后,发现淋巴细胞和脾单个核细胞中NICD、Hes-1表达下降,T-bet(Th1转录相关因子)表达上升,而Gata-3(Th2转录相关因子)表达降低。猜测Notch可能在转录水平上调节FA。但具体机制仍不清楚。
在FA动物模型中,研究者可排除众多混杂因素,因此可以精确地评估致敏原、找到治病因素并采取有效的干预措施。但FA是一种全身性疾病,它与遗传因素、环境因素以及个体易感性等均有很大关联,因此很难精确判断个体的发病情况,严重程度以及持续时间。但尽管如此,研究者仍不断在动物模型的基础上尽可能找到可能出现的过敏原,明确其危害程度与暴露因素,并在此基础上避免具有易感体质的个体接触该类过敏原。
5 小结与展望
由于人类生活环境的复杂性和多样性,过敏性小鼠动物模型可能无法完全模拟过敏性疾病的流行病学、致病因素、疾病发展及转归,但其能够较好地揭示相关细胞因子表达、信号通路转导等信息。我们应该更为客观、科学地看待此种局限性,尽管实验动物研究已取得丰硕的结果,但向临床医学转化仍然任重道远。值得肯定的是,构建过敏性小鼠模型寻找过敏性疾病的潜在治疗靶点仍是当前研究的热点。此外,随着高通量测序的使用成本逐步下降,使得非编码RNA研究的不断深入,又为过敏性疾病的深入研究提供了有力的工具和理论基础。目前已知,外泌体广泛存在于细胞及体液中,其可携带多种蛋白质、mRNA、非编码RNA以及脂质等物质,作为细胞-细胞间信息传递系统而参与到机体免疫应答、抗原呈递、细胞迁移、分化等生物学现象中。尽管外泌体在肿瘤学、遗传学中已广泛研究,但其在过敏性疾病研究中还需要进一步深入,如能深入挖掘过敏性疾病中外泌体与非编码RNA、外泌体与蛋白组学的互相调控关系,外泌体与不同分子之间的直接交互作用导致分子拓扑结构改变对于疾病的影响,则可能对过敏性疾病的治疗提供新的思路和靶点。
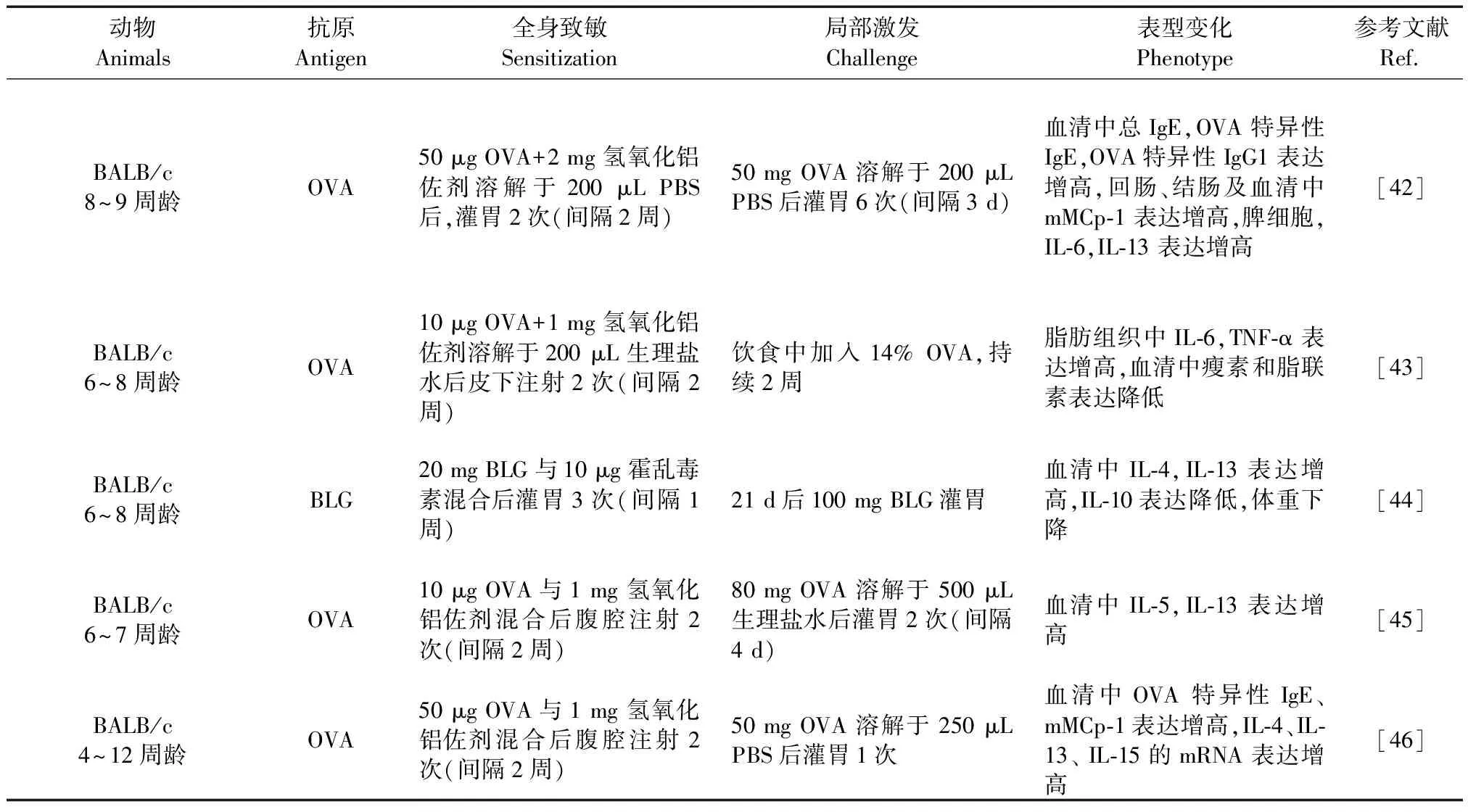
表 4 食物性小鼠造模方法及表型变化
注:BLG: β-乳球蛋白。
Note. BLG, β-lactoglobulin.
