布鲁氏菌及其疫苗的相关研究
2020-03-30韩文东
韩文东,瞿 涤,2*
(1.上海复旦大学三级生物安全防护实验室,上海 200032; 2.复旦大学基础医学院教育部/卫健委医学分子病毒学重点实验室,上海 200032)
布鲁氏菌病(Brucellosis,简称布病)是严重影响人类健康的细菌性人畜共患传染病[1],世界范围内每年新发人感染布病病例超过50万[2]。我国自2000年以来,布病感染范围从北方畜牧地区迅速扩展至沿海及东南部地区[3],且呈持续上升趋势。实验室获得性布鲁氏菌感染也常见报道[4]。人感染布病最常见的途径是食入未经消毒的牛奶、奶制品或直接接触感染动物的分泌物、流产物等[5],而人与之间的传播则相对罕见。患者感染布鲁氏菌后约90%病例出现急性发作的波状热,并伴随头疼、关节痛、盗汗、疲劳与厌食症,易误诊为感冒症状。如不及时治疗,病程可长达数年,主要表现为关节炎、附睾-睾丸炎、神经脊柱炎、肝脾脓肿以及心内膜炎,严重者可能死亡。牧民、屠宰工人及医院检验相关的医护人员因职业因素,发病率高于普通人群[6]。此外,布鲁氏菌还可通过气溶胶途径扩散传播,成为生物武器和生物恐怖主义青睐的潜在工具[7]。
人感染布病的主要途径是接触感染动物[8],对畜群进行疫苗接种被证实是控制人感染布病的有效策略,蒙古在WHO协助下连续进行了11年的羊群的疫苗接种,人类布病的发病率从1974年4.8/10万下降到1981年的0.23/10万[9]。虽然疫苗接种对控制布病流行具有重要作用,但目前布病疫苗存在保护时间短、血清学检测无法区分免疫/感染以及毒力回复等问题[10]。布病研究虽然取得了不少阶段性成果,但在许多国家布病仍然持续或再现[11]。因而,对布鲁氏菌病原学、流行病学、疫苗学等各方面的研究尚有待进一步加强。
1 布鲁氏菌生物种及感染宿主范围
历史资料显示,布病起源于地中海地区[12]。羊布鲁氏菌(Brucellamelitensis,B.melitensis)导致的布病又名马耳他热,其致病原首先由英国军医David Bruce于1887年分离出而命名为布鲁氏菌(Brucella)。丹麦兽医学家Bang[13]于1897年从患病牛体内分离出可导致流产的牛布鲁氏菌(B.abortus)。经过一个多世纪的研究,布鲁氏菌属菌株不断被发现。1914年Mohler等人[14]从感染猪的肝脾分离出猪布鲁氏菌(B.suis)。1952年从新西兰公羊附睾中分离出天然R型(Rough,粗糙型)绵羊附睾型布鲁氏菌(B.ovis)[15]。1957年从美国西部地区野生沙林鼠中分离到沙林鼠布鲁氏菌(B.neotomae)[16]。1966年从美国一家犬养殖场的流产胎犬组织中分离到犬布鲁氏菌(B.canis)[17]。1994年至1998年间,从海洋生物中分离到B.pinnipidialis(海豚和鲸鱼)和B.ceti(海豹)[18]。2007年从田鼠和红狐分离到田鼠布鲁氏菌B.microti[19]。2008年从奥地利红狐分离出慢生长布鲁氏菌B.vulpis[20]。2010年Scholz等人[21]从发生感染的乳房植入物分离到B.inopinata,其自然宿主尚不清楚,后来从蛙类标本中亦分离到同种菌株。2014年从狒狒的宫颈拭子中分离到B.papionis,但是否感染狒狒及对其他动物的致病性也尚无进一步研究[22]。
综上,世界范围内目前发现的布鲁氏菌基于细菌学、宿主偏好与致病性,结合分子分型与全基因组测序共确定了12个生物种,包括“经典”的布鲁氏菌6种,B.melitensis、B.abortus、B.suis、B.canis、B.ovis和B.neotomae;以及“新现”布鲁氏菌6种,B.microti、B.pinnipidialis、B.ceti、B.inopinata、B.papionis和B.vulpis。
布鲁氏菌对于宿主的偏好与其命名的生物种并非一一对应,某一布鲁氏菌在实验研究或自然条件下可感染除其主要宿主的其他动物,如牛布鲁氏菌的自然宿主是牛,但同时可感染羊群、野猪和骆驼(表1)。此外,“新现”布鲁氏菌扩展了人类对其宿主种类与地理分布范围的认识,不同布鲁氏菌之间可能存在基因的水平转移,这对布病的防控提出了更严峻的挑战。
2 布鲁氏菌胞内存活机制
布鲁氏菌是兼性细胞内寄生的革兰氏阴性菌,其致病性与细菌在胞内的存活密切相关,在此过程中其细胞壁发挥了主要作用。布鲁氏菌细胞壁主要由外膜和肽聚糖组成,其外膜包括脂多糖(Lipopolysaccharide, LPS)、外膜蛋白(脂蛋白、通道蛋白)和磷脂[23]。LPS由脂质A、核心单糖(core oligosaccharide)与O-多糖(O-polysaccharide,O-PS)组成,是布鲁氏菌主要的表面抗原,具有亲水性[24-26]。S型(Smooth,光滑型)菌株有完整的脂多糖(S-LPS)结构,而R型菌落则为不完整的LPS,缺乏O-多糖,主要通过基因组wbk基因簇中perosamine合成相关基因突变或缺失所致。布鲁氏菌的LPS与大肠杆菌相比,具有低内毒素活性、高度抵抗巨噬细胞降解以及介导细菌对宿主免疫应答的保护,从而利于细菌在细胞内存活和增殖,从而在动物体内呈持续感染状态(persistence)。而缺乏O-PS的R型菌株则无法在巨噬细胞及感染动物中长期存活[24]。布鲁氏菌S-LPS的O-PS含有诱导体液免疫应答的主要抗原决定簇,而R型菌落的免疫原主要是核心单糖和外膜蛋白。研究结果显示,针对O-PS的多克隆/单克隆抗体均可有效保护小鼠抵抗S型菌株的感染,而针对R-LPS表位设计的特异性单克隆抗体对小鼠抵抗S型菌株(B.abortus)感染的保护作用不大,但对抵抗天然R型菌株(B.ovis)的感染则具有很强的保护作用[25]。
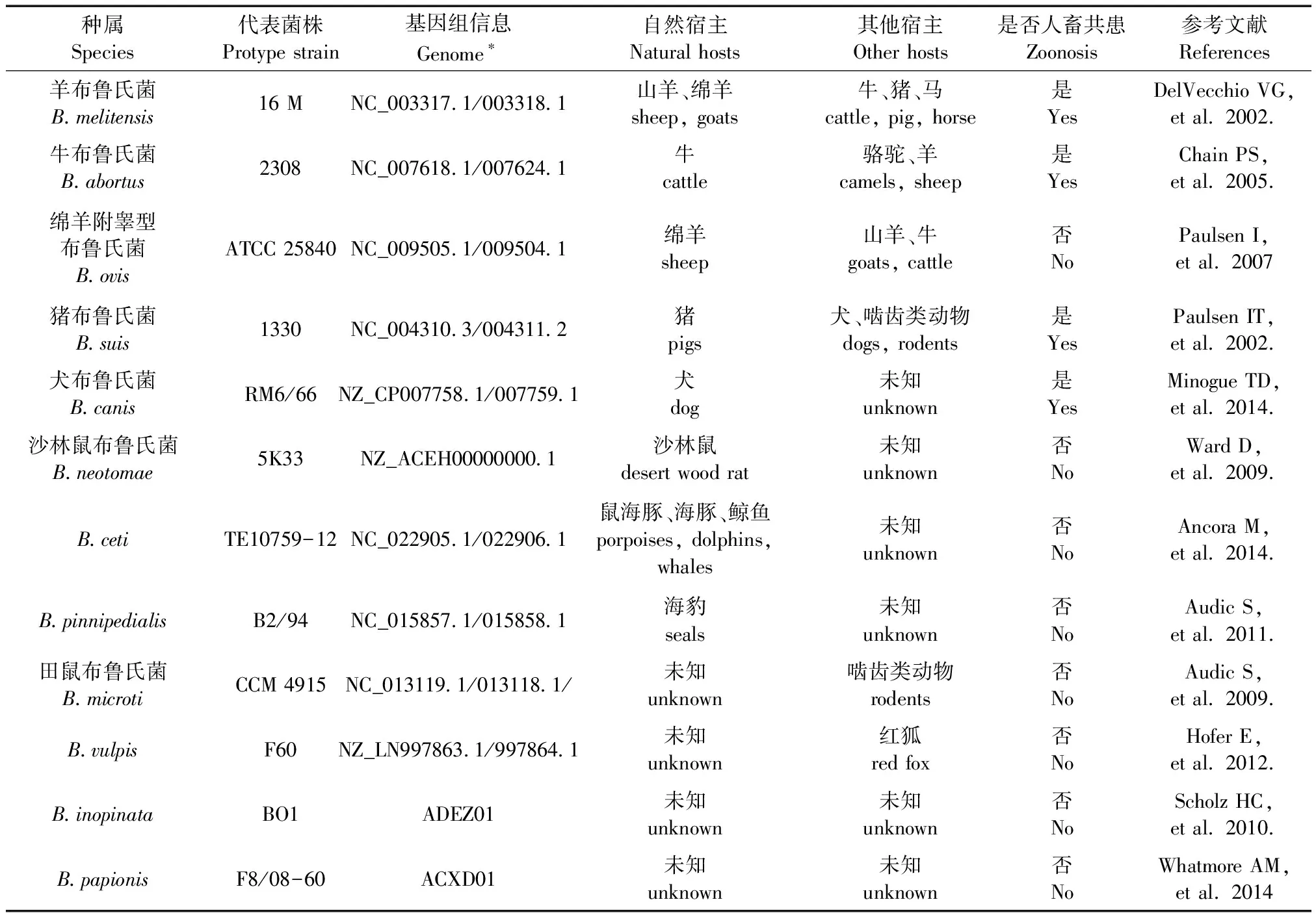
表1 布鲁氏菌及其自然感染宿主
注:*基因组信息:Gene Bank 参考基因组登录号。
Note.*Genome, Gene Bank Ref Seq accession number.
布鲁氏菌S型菌株感染主要依赖于宿主的细胞骨架进行内化[26]。细菌O-PS与宿主细胞膜富含胆固醇的脂筏相互作用,促进与宿主细胞的接触并介导其内化入巨噬细胞[27]。脂筏含有鞘糖脂、胆固醇以及糖基磷脂酰肌醇锚定蛋白,从而促进膜相关事件的发生,如多亚基膜复合物的形成、跨膜信号传导以及膜融合[28],同时布鲁氏菌具有防止补体介导的细菌裂解和宿主细胞凋亡的能力。巨噬细胞表面IgG和补体(C3b和4b)受体对布鲁氏菌产生调理作用[29],从而帮助与脂筏结合的细菌转移并靶向进入吞噬溶酶体。R型菌株由于缺乏O-PS从而不能维持与脂筏的相互作用,更易被巨噬细胞表面的Toll样受体4(TLR4)或甘露糖受体识别而促进了R型布鲁氏菌的内吞[30]。粗糙型菌株表现更高的侵袭性,可能是由于被O-PS保护的外膜蛋白暴露,从而增加了粘附巨噬细胞的能力。R型布鲁氏菌虽然更有效率地被宿主巨噬细胞吞噬,并迅速定位到吞噬溶酶体中,通常却无法复制,而被细胞内吞后存活的S型菌株则能够在细胞内复制(图1)。
通过脂筏进入宿主巨噬细胞的S型布鲁氏菌快速通过早期内体形成名为“布氏小体”的含有布鲁氏菌液泡(brucella-containing vacuole, BCV),继而通过类似于自噬体生发的方式获得内质网组分形成修饰吞噬体。布鲁氏菌最初定位于酸化的吞噬体内,酸化环境定向诱导VirB操纵子(virB1-10)的表达,调控Ⅳ型分泌系统(type Ⅳ secretion system, T4SS)相关基因的表达[31]。VirB操纵子与内质网交互,以中和吞噬体的pH值。布鲁氏菌细胞内存活的另一种机制涉及修饰吞噬体膜的脂质含量,细菌通过表达和分泌环状葡聚糖合酶(CGS),可以破坏细菌周围细胞内膜内的脂筏微结构域结构,脂筏分布的改变抑制吞噬体成熟,防止与溶酶体融合,从而保证了细菌自身的存活,这种机制是独立于virB操纵子而发挥作用[32]。
此外氧化杀伤是宿主吞噬细胞用于控制细胞内病原体复制的主要机制,现已发现布鲁氏菌具有多种对抗自由基的机制。布鲁氏菌表达2种超氧化物歧化酶SODA和SODC来分解自由基的产生,其中SODC发挥抵抗巨噬细胞呼吸爆发产生的超氧阴离子的作用[33]。布鲁氏菌AHPC(烷基氢过氧化物还原酶C)还原过氧化物发挥阻止氧化杀伤功能,同时O-PS也具有抵抗宿主细胞阳离子肽和氧代谢物的作用[34-35]。综上,布鲁氏菌通过精确调节不同阶段酶及分泌蛋白阻止被外界氧化杀伤从而移行至内质网以及高尔基体进行复制。
3 布病疫苗的研究
动物疫苗接种是控制布病扩散与流行的有效措施。减毒活疫苗是目前被广泛使用的,对布病(流产和/或感染的后代)的流行控制非常有效。20世纪60年代早期,B.abortusS19、B.melitensisRev1以及灭活的B.abortus45/20疫苗被广泛使用[36]。美国在1996年批准使用B.abortusRB51[37],我国使用的疫苗株为B.suisS2、B.melitensisM5,有效控制了我国布病的蔓延[38],但减毒活疫苗存在保护时间短、导致怀孕母畜流产等毒力恢复的现象,另外目前血清学检测手段尚不能区分疫苗接种与野菌株的感染[39],这对疫苗的有效接种提出了挑战。
迄今除我国批准皮上划痕人用布鲁氏菌104 M活疫苗外[40],世界范围内无其他可用于人类预防布病的疫苗株,因此需要更加重视布病新型疫苗的研发。目前,不断有新型候选疫苗提出,但其效力与安全性研究大多在小鼠模型进行验证,缺乏疫苗对羊、牛、马、猪大型动物及灵长类感染的保护验证。此外,体内抗原表达、佐剂和递送方法的技术进步对于开发具有同等或更高保护效力的非活性布病疫苗提供了技术基础。最近研究显示,应用流感、沙门菌、志贺菌等作为载体开发布病亚单位疫苗具有良好的前景(表2)。
4 布病疫苗效力评价的动物模型
布病研究常用的动物模型是近交系小鼠,特别是BALB/c和C57BL,是最常用作研究布病发病机理的实验室模型,其他动物模型包括豚鼠、兔子、大鼠、非人灵长类及反刍动物如牛、羊[41]等。感染途径以皮下注射为主,其他常见途径包括腹腔注射、气溶胶感染和滴鼻感染。感染动物脾肿大指数及脾内细菌计数是常用的检测指标。非人灵长类动物如猕猴等被证实可通过口服、皮下和气溶胶途径感染布鲁氏菌[42],感染后病理进程如菌血症可长达8周,同时伴随发展形成局灶性肉芽肿性肝炎,脾炎,淋巴结炎、睾丸-附睾炎以及子宫内膜炎的病变,这些症状与人布病发展进程一致[43-44],但由于实验成本、伦理学等因素,限制了该模型的大规模使用,此外,羊、牛等反刍动物也存在同样的问题。其他实验动物如豚鼠,对布鲁氏菌感染非常敏感,同样被广泛用于布鲁氏菌的分离、抗生素治疗的有效性评估以及布病疫苗效力的验证[45]。豚鼠感染后,肝、脾、肺和淋巴结中均可观察到炎性病变,且豚鼠模型表现出“发热”症状,这是人布病发生后的典型症状(表3)。因此,基于实验的可操作性与性价比,开展布病实验研究应优先选择豚鼠、小鼠模型。
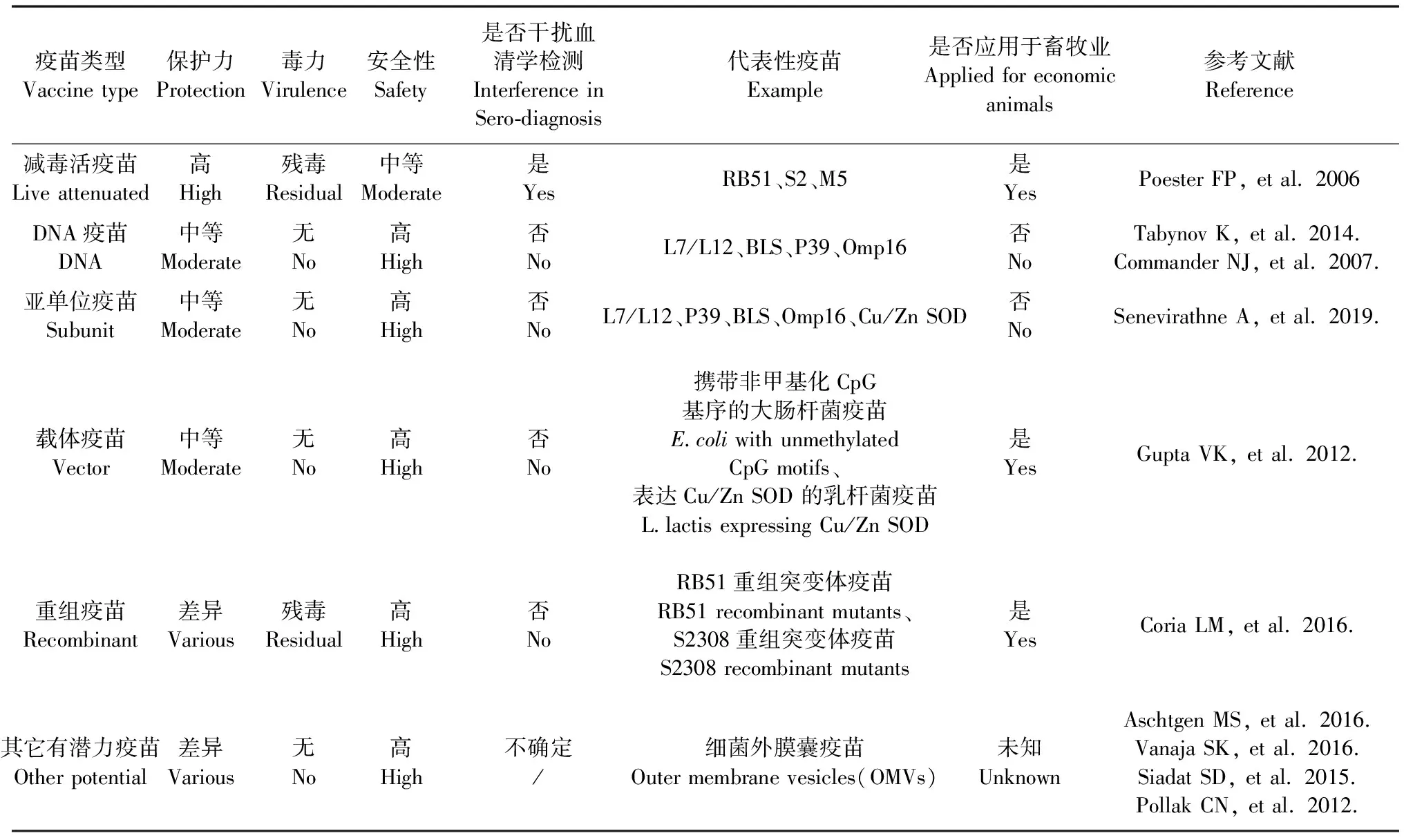
表2 布病疫苗类型

表3 用于布病研究的实验动物模型
5 主要问题与建议
综上所述,目前布病研究中存在问题如下:1) “新现”的布鲁氏菌生物种提示布鲁氏菌是一株古老而又现代的菌株,菌株的进化伴随着畜群的驯化、环境的变化以及畜牧业的扩展范围而变化,但各生物种之间的基因组进化尚不清楚。2)布鲁氏菌宿主分布广泛,从陆地到海洋,从恒温动物到变温动物,同时细菌也伴随野生动物的迁徙以及人类的活动而播散于全世界,生物种之间可能存在的基因水平转移,从而对布病的防控带来新的挑战。3)实验室布病研究常用动物模型为小鼠,细菌感染后其发病具有自限性,不能有效模拟人类感染的发病进程。虽然豚鼠感染表现优于小鼠,但其规模化饲养及性价比都弱于小鼠模型,从而限制了布病的研究。4)布病疫苗研制难度大,新型疫苗包括亚单位疫苗、DNA疫苗、载体疫苗等的保护力无法达到减毒活疫苗水平,功能基因组研究的深入可能对该问题提供一定的帮助。
因此,针对以上问题应该重点进行如下研究:1)对于布鲁氏菌菌株的多样性加强研究,寻找其与α-变形菌纲内其他细菌如巴尔通体、根瘤菌在进化过程中存在的联系,深入了解布鲁氏菌属细菌基因组的进化。2)加强对布鲁氏菌致病机制的研究,深入挖掘致病基因的功能及其与宿主之间的相互作用。3)优化布病动物模型,从而有效复制人类感染进程。4)进行人布病疫苗的开发以及持续的动物疫苗和人体疫苗的接种计划,对于控制布病缺一不可。
