兔源多杀巴斯德杆菌基因分型研究
2020-03-30黄树武潘金春陈梅玲闵凡贵
黄树武,王 静,潘金春,陈梅玲,张 钰,闵凡贵
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
多杀巴斯德杆菌(Pasteurellamultocida,P.multocida)是一种重要的人兽共患病原菌,其感染宿主十分广泛,能感染多种家禽、家畜、野生动物和人等,其中可引起兔鼻炎、肺炎、中耳炎和出血性败血症等疾病,导致兔急性或亚急性死亡,严重威胁兔的生命健康[1-2]。
细菌分型是了解细菌性传染病流行特征的重要技术之一,对研究感染源、感染途径以及地方性菌株和流行菌株之间的鉴别有着非常重要的作用[3]。随着分子生物学技术的发展,相较于生化分型、血清学分型、噬菌体分型等传统分型技术,基因分型技术以其快速、简便、灵敏、灵活等特点日渐受到青睐。目前,临床上用于多杀巴斯德杆菌诊断的基因分型方法主要包括基于荚膜编码区的多重PCR方法和多位点序列分型法(multi-locus sequence typing, MLST)[4-5]。近年来,有意大利[6]、西班牙[7]和捷克共和国[8]等国家对兔源P.multocida进行基因分型的报道,而我国仅有少量关于禽源、猪源等多杀巴斯德杆菌基因分型的研究[9-11]。
本研究对实验室分离的兔源P.multocida在生化表型特征的基础上,运用分子分型方法分析分离菌株的基因型特征和菌株间的同源性,揭示菌株间基因多态性和群体遗传结构,获得广东地区实验兔感染P.multocida分型数据,了解广东地区实验兔感染P.multocida的流行特点,有利于更好地指导广东本地实验动物质量控制与监测。
1 材料和方法
1.1 实验材料
实验菌株来源于2000年至2018年期间广东地区不同实验动物设施,从普通级急性发病死亡的新西兰兔呼吸道分离到的14株多杀巴斯德杆菌。实验操作在实验动物使用设施[SYXK(粤)2016-0122]进行,所有操作遵循动物福利和伦理要求,并按实验动物使用的3R原则给予人道主义关怀。多杀巴斯德杆菌阳性对照菌株(ATCC43137)来自中国医学科学院医学实验动物研究所馈赠。
1.2 主要试剂与仪器
血琼脂平板(批号:ZBAp-180715D)和DHL平板(批号:H1038Y)购自广东环凯微生物科技有限公司;三糖铁(批号:180828)、半固体琼脂(批号:170817)和无菌生理盐水(批号:H0993Y)购自北京陆桥技术股份有限公司;糖(苷或盐)类等微量生化管购自杭州滨和微生物试剂有限公司;触酶试剂盒(批号:1005440900)、氧化酶试剂盒(批号:19540501)、ID 32E(批号:1006416960)和API 20NE(批号:1006405070)生化试剂盒购自法国生物梅里埃股份有限公司;革兰染色液试剂盒(批号:418082)购自珠海贝索生物科技有限公司;PCR试剂包括细菌基因组DNA提取试剂盒(批号:R6717)、DNA纯化回收试剂盒(批号:Q5601)购自天根生化科技有限公司;Premix Taq(批号:A4701 A)、DL-2000 Marker(批号:A1801 A)、琼脂糖(批号:172175)等购自宝生物工程(大连)有限公司,各种试剂均在有限期内使用。
生物安全柜(德国,Biometra型);生化培养箱(宁波江南仪器厂,SPX-288型);生物显微镜(德国,Leica DM500型);ATB梅里埃鉴定仪(法国,ATB NEW型);PCR超净工作台(上海市金鹏科技有限公司,BHC-1300II A/B3型);PCR仪(德国,Biometra);离心机(湖南湘仪实验室仪器开发有限公司,TG16-W型);电泳仪(北京六一仪器厂,DYY-6C型);全自动凝胶成像系统(美国,Bio-Rad PowerPac Basic 164-5050型)。
1.3 实验方法
1.3.1 分离培养与生化鉴定
依据实验动物国家标准GB/T 14926.5-2001实验动物多杀巴斯德杆菌检测方法对临床分离的可疑多杀巴斯德杆菌进行系统生化鉴定分析。同时使用法国梅里埃生化鉴定条ID 32E和API 20 NE进行生化鉴定,并按照试剂盒说明书进行鉴定结果的判定。
1.3.2 分子分型分析
(1)菌株DNA提取
按照试剂盒说明书,将所有临床分离菌株使用细菌基因组DNA提取试剂盒进行基因提取,提取的核酸作为分子分型的DNA模板。
(2)荚膜分型
按照Townsend等[12]建立的荚膜多重PCR方法对分离菌株进行kmt基因定种鉴定,再使用荚膜特异基因hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD设计引物进行A、B、D、E和F分型,分型引物序列(见表1)。反应体系为2 μL基因组DNA加入2 μL引物(10 μmol/L), 25 μL Premix Ex Taq,加灭菌蒸馏水到反应总体系为50 μL。反应条件按95℃预变性12 min,95℃变性30 s,62℃退火30 s,72℃延伸30 s,反应进行35个循环,最后72℃延伸7 min。最后吸取10 μL PCR扩增产物用1.5%琼脂糖凝胶进行电泳检测。
(3)MLST分型
针对多杀巴斯德杆菌adk、aroA、deoD、gdhA、g6pd、mdh、pgi7个特异基因序列设计引物,分型引物序列及反应条件(见表1),对临床分离菌株进行PCR扩增和测序,测序后经过组装分析确认的序列提交MLST数据库(http://pubmlst.org/)进行比对,得出每个菌株各位点的等位基因数目,然后进行等位基因序列类型(sequence type, ST)鉴定,使用MLST数据库在线分析软件进行聚类分析,构建系统发育树,分析其遗传进化关系。
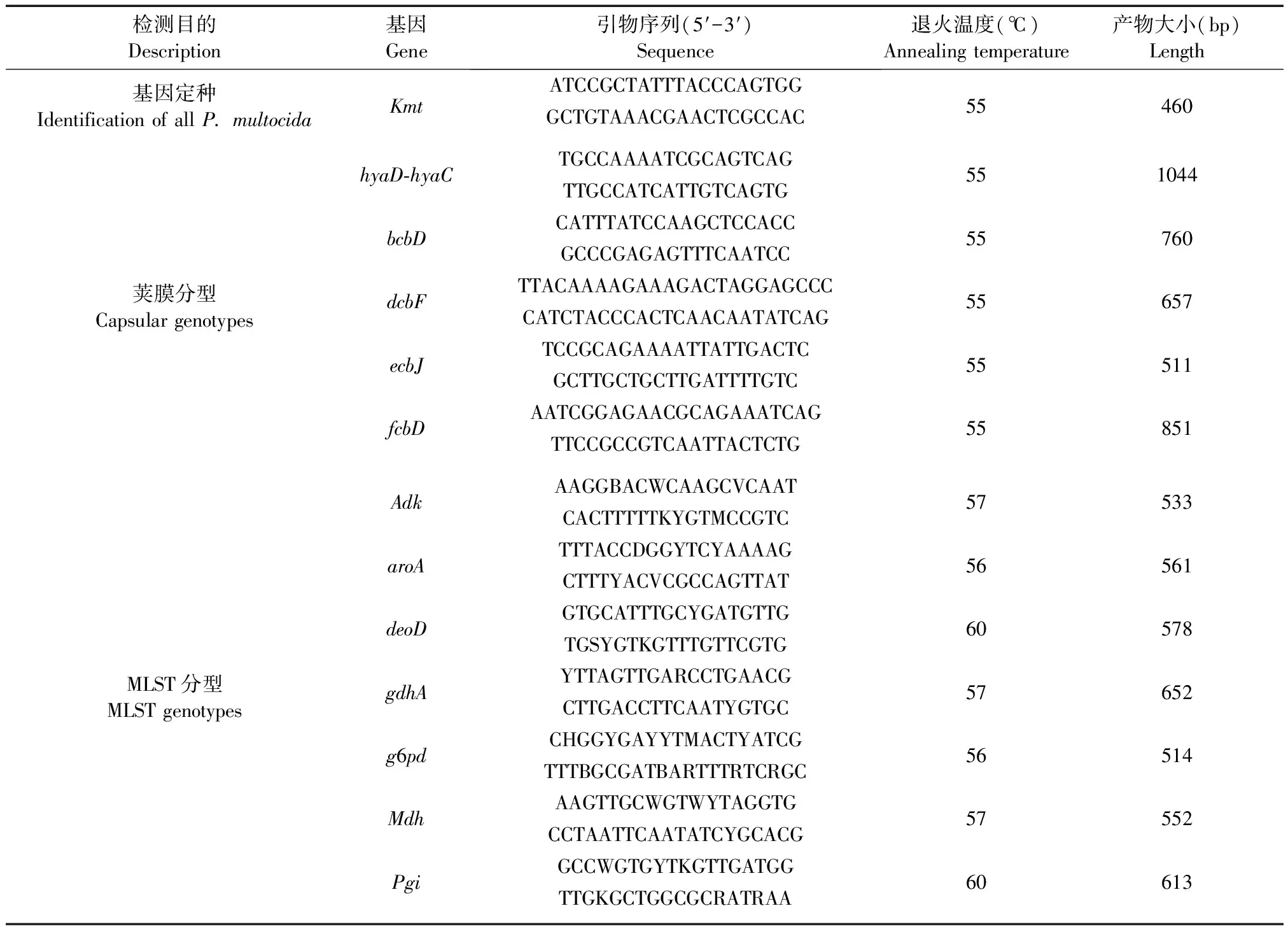
表1 多杀巴斯德杆菌株基因分型引物
2 结果
2.1 分离培养与生化鉴定结果
所有分离菌株在血琼脂平板上,于37℃生化培养箱中培养18~24 h后形成1 mm左右,光滑露滴样或灰白色、不溶血的菌落。在DHL琼脂平板上不生长。革兰氏染色为阴性小杆菌,两端钝圆并浓染。生化反应为触酶试验阳性,氧化酶阳性,三糖铁试验为斜面及底层产酸不产气、乙酸铅纸条法显示硫化氢阳性,半固体动力阴性,乳糖阳性,尿素酶阴性,靛基质试验阳性,硝酸盐还原试验阳性,枸橼酸盐利用试验阴性,赖氨酸脱羧酶为阴性,不液化明胶;而鸟氨酸脱羧酶结果为阳性其菌株所占比例为79%(11/14),葡萄糖阳性比例为57%(8/14),蔗糖阳性比例为79%(11/14),麦芽糖阳性比例为14%(2/14)。
使用法国梅里埃生化鉴定条ID 32E和API 20 NE都能鉴定所有临床分离菌株为多杀巴斯德杆菌,鉴定ID值都为99.3%以上,鉴定评价为好的鉴定。
2.2 分子分型结果
2.2.1 荚膜分型结果
将所有分离菌株进行kmt基因定种鉴定,均出现约460 bp的目的条带(见图1A)。使用荚膜分型多重PCR方法扩增后产物进行琼脂糖凝胶电泳,出现约1044 bp与760 bp两种目的条带(见图1B),据此将菌株分为A型与B型两种荚膜血清型,A型为主,占比71.4%(10/14)。
2.2.2 MLST分型结果
将所有分离菌株经7个管家基因的扩增和测序,测序后序列提交MLST数据库上进行比对分析,结果显示有ST12、ST35型、ST72型、ST73型、ST76型、ST77型共6种ST型,并且首次发现了新ST76型,ST77型(见表2)。然后对分离菌株进行聚类进化分析,构建广东兔源多杀巴斯德菌株遗传进化树与最小生成树(见图2);并将本研究菌株与MLST数据库中多个国家兔源多杀巴斯德菌株进行比对进化分析,结果表明,本研究中兔源多杀巴斯德杆菌与意大利、西班牙、捷克共和国、丹麦等国家的菌株存在复杂的遗传交叉进化关系(见图3)。
3 讨论
据多个国家流行病学调查资料显示,多杀巴斯德杆菌感染是一种全球性的现象[6-8,11, 13-15]。鉴于多杀巴斯德杆菌感染宿主的多样性与所致疾病的危害性,临床上针对分离菌株开展分型鉴定,对于了解其感染和致病规律,建立细菌流行病学资料具有重要的意义。
本研究在分离菌株培养特性与生理生化特性基础上,应用分子分型方法对其进行分型研究。在菌株生化反应特征上,临床分离菌株大部分生化反应相同,但个别生化反应结果与实验动物现行国家标准不一致。国内亦有文献报道多杀巴斯德的葡萄糖、蔗糖、麦芽糖和鸟氨酸脱羧酶等生化反应结果阴阳性不一[16-17]。倘若完全按照实验动物国家标准进行检测,可能会导致误判漏检。考虑通过PCR方法辅助诊断,或者借助商品化生化鉴定试剂盒方法验证结果的准确性,作为一种有益补充手段。

注:A:kmt 基因定种鉴定, M: DL2000 DNA Marker; 1~14号: 样本; 15: 多杀巴斯德杆菌株(ATCC43137)阳性对照; 16: 空白对照。B:荚膜分型多重PCR方法鉴定, M: DL2000 DNA Marker; 17~30: 样本; 31: 多杀巴斯德杆菌株(ATCC43137)阳性对照; 32: 空白对照。图1 广东地区兔源多杀巴斯德杆菌荚膜分型结果电泳图Note. A: Identification of kmt gene species. M, DL2000 DNA Marker; 1~14, Sample; 15, Pasteurella multocida strain (ATCC43137) positive control; 16, Blank control. B: Capsule typing multiplex PCR method was identified. M, DL2000 DNA Marker; 17~30, Sample; 31, Pasteurella multocida strain (ATCC43137) positive control; 32, Blank control.Figure 1 Electrogram of capsule typing of Pasteurella multocida from rabbits in Guangdong
注:“+”表示阳性。
Note. “+”: positive.
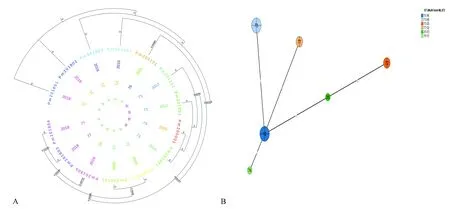
注:A:进化树圆圈从外到内为菌株编号,分离时间,ST型,荚膜型;B:圆圈内数字代表ST型。图2 广东地区兔源多杀巴斯德杆菌遗传进化关系与最小生成树Note. A, The sequence of evolutionary tree circle is strain numbers, isolation time, MLST genotypes, Capsular genotypes from outside to inside. B, The number in the circle represents the MLST genotypes.Figure 2 Genetic evolution relationship and minimal spanning tree of pasteurella multocida isolates from rabbits in Guangdong

图3 广东地区兔源多杀巴斯德杆菌与多个国家菌株遗传进化分析Figure 3 Genetic and evolutionary relationship between Pasteurella multocida isolated from rabbit and strains from several countries in Guangdong
多杀巴斯德杆菌根据荚膜抗原可分为5种血清型,分别为A、B、D、E和F,不同血清型与其宿主和疾病之间有一定相关性,血清A和F与呼吸道疾病和家禽霍乱有关,血清B和E与出血性败血症有关,而D血清通常与猪萎缩性鼻炎相关[1,11,18]。目前已报道兔源P.multocida有A、D和F型三种荚膜血清型[6-8,11]。本研究中荚膜分型结果显示广东地区兔源P.multocida主要为A型,也发现兔源P.multocida荚膜血清B型。这与我国不同地区鸡,鸭,猪等来源的P.multocida其荚膜优势血清型为A型一致[9-11,17]。病原菌株分离至兔呼吸道,通过呼吸道传播感染,从而导致兔急性或亚急性死亡,应引起实验动物生产者与使用者的关注。
本研究将菌株MLST分型结果显示,广东地区兔源多杀巴斯德杆菌存在ST12、ST35、ST72、ST73、ST76、ST77共6种ST型,并且首次发现了新ST76(Adk8-aroA4-deoD5-gdhA3-g6pd5-Mdh7-Pgi5)型和ST77(Adk18-aroA21-deoD20-gdhA18-g6pd19-Mdh18-Pgi18)型,已提交MLST数据库确认并收录。此研究揭示了广东地区兔源多杀巴斯德杆菌菌株间的基因多态性,且动物设施A,D,E的兔子都存在ST73型的菌株污染,构成一个遗传群体结构,其他的ST型菌株感染存在散播性。另外,实验动物设施F从2016年分离到ST12型菌株,2018年6月份再次分离到同种基因型菌株,后8月份分离到ST77型菌株,考虑此时有外来变异菌株污染设施。通过对广东地区菌株的进化分析,ST12型菌株与ST35型、ST73型、ST76型和ST77型存在一定的进化同源关系,而与ST72型菌株亲缘关系相对较远,尤其新发现的ST76型和ST77型可由ST12型菌株各进化出一个分支而来。本研究将分型结果与MLST数据库中不同时间地理区域分离菌株进行横向与纵向比对分析。不同基因型的菌株流行存在地理区域性和偏向性,意大利以ST9、ST50和ST74为主,西班牙为ST50,捷克共和国为ST9,而本研究的兔源P.multocida以ST12和ST73为主;同源性比对分析发现本研究菌株与意大利、西班牙、捷克共和国等国家的菌株存在复杂的遗传交叉进化关系。
实验动物国家标准中普通级兔不要求排除多杀巴斯德杆菌,导致实验动物生产机构放松了对该菌的控制,课题组曾对广东地区普通级兔感染多杀巴斯德杆菌的携带情况进行调查,显示阳性率为2.5%(4/160)(数据暂未发表),鉴于多杀巴斯德杆菌对兔的危害性,且菌株主要通过呼吸道途径传播感染,在实验兔的生产繁育过程中需要高度重视。
