纤维蛋白为载体的BMP-4/7对骨质疏松性骨缺损愈合过程的影响
2020-03-28袁绍辉博超刚李洪涛韩雪松
袁绍辉,博超刚,李洪涛,韩雪松
(哈尔滨医科大学附属第一医院骨科,哈尔滨 150001)
进入更年期后的女性,随着体内雌激素水平的逐渐下降,椎体会出现骨质疏松以及局部骨缺损,其严重影响更年期后女性的骨骼质量[1]。骨质疏松通常采用补钙及其他一些保守治疗方法,但治疗效果往往不理想,并易引起病理性骨缺损,脊柱尤为显著。近年来骨形态发生蛋白(bone morthogenetic protein,BMP)的出现引起了组织工程研究学者的广泛关注。大量基础实验已证实BMP在骨缺损愈合过程中可以引起骨骼细胞发生与再生、加速骨骼纤维的交织与矿化[1-4]。其中,Ⅰ型骨胶原蛋白是骨缺损愈合过程中促进骨细胞分化和增强成骨细胞黏附能力的主要因素[5-7]。同时,纤维蛋白是一种良好的蛋白附着载体,可以携载多种BMP同源异构体,因此可作为理想的药物缓释载体,促进骨缺损愈合[8-10]。
目前以纤维蛋白为载体的BMP-4/7对骨质疏松性椎体骨缺损愈合的相关报道较少见。本研究通过观察以纤维蛋白为载体的BMP-4/7对大鼠骨质疏松性椎体骨缺损愈合过程中Ⅰ型骨胶原蛋白含量及局部生物力学强度的变化,探讨以纤维蛋白为载体的BMP4/7对骨质疏松性椎体骨缺损愈合的作用。
1 材料与方法
1.1材料 实验动物:选择雌性Sprague-Dawley(SD)大鼠84只,8个月龄,体重180~200 g,由哈尔滨医科大学附属第一医院实验动物中心提供,为无特定病原体动物,医学实验动物管理委员会合格证号:13-067。实验对动物的处理方法符合《关于善待实验动物的指导性意见》(中华人民共和国科学技术部)。
主要仪器及试剂:Fax itron样本放射系统(美国Itron公司);AG-I生物力学测量系统(日本岛津公司);DPX2L型双能X线骨密度仪(美国Lunar公司);WDW-10KN型计算机电子万能力学试验系统(日本松下公司);X-TIRE361T光谱微孔板光密度仪(美国Bio-Rad公司);Fax itron样本放射系统(美国Faxitron公司);Bradford试剂盒、G250染色液、二喹啉甲酸标准蛋白(美国Invitrogen公司);鼠抗人Ⅰ型胶原单克隆一抗(美国Invitrogen公司);兔抗鼠二抗IgG(美国Santa Cruz公司)。
1.2实验方法
1.2.1实验分组 84只大鼠依据随机数字法分为4组,每组21只。A组:骨质疏松性骨缺损+(BMP-4/7 24 μg+纤维蛋白20 mg);B组:骨质疏松性骨缺损+胎牛血清;C组:正常骨质骨缺损+(BMP-4/7 24 μg+纤维蛋白20 mg);D组:正常骨质骨缺损+胎牛血清。
1.2.2骨缺损模型的建立 麻醉采用腹腔注射麻醉(氯氨酮0.1 g/kg)。A组、B组大鼠切除双侧卵巢,C组、D组切除少量腹部脂肪组织。所有大鼠于术后3个月在麻醉下建立骨缺损模型。大鼠取侧卧位,消毒后逐步显露横突韧带、坐骨神经,保护神经,充分显露椎体,于L5椎体侧面中心行开窗术,面积为1.5 mm×3.0 mm,深度约为椎体松质骨直径,刮除术区内所有松质骨,A组和C组注入BMP-4/7(前期工作构建)[6]和纤维蛋白混合物;B组和D组注入等量胎牛血清(购于哈尔滨宏博生物技术有限公司),封闭骨窗,逐层缝合。严格无菌环境下进行所有手术,术后饲养于完全清洁级环境中(哈尔滨医科大学附属第一医院实验动物中心清洁级动物室)。全部实验大鼠于术后当日立即行放射系统拍摄,判断骨缺损模型建立情况。
1.2.3免疫印迹法在蛋白水平检测Ⅰ型骨胶原蛋白 制备蛋白:各组动物分别于骨缺损建模后第1、2、4、5、8、12周各处死3只大鼠[8]。将L5骨缺损标本常规脱钙7 d(置于200 g/L的乙二胺四乙酸中4 ℃下脱钙)。组织裂解法[11]:利用蛋白酶,溶菌酶或细胞壁分解酶在一定条件下作用于生物标本,而使细胞膜或细胞壁破碎,释放胞内蛋白质;利用蛋白质-染料结合的原理,定量测定微量蛋白质浓度。二喹啉甲酸标准蛋白浓度已稀释至500 μg/mL,-20 ℃保存[9]。
免疫印迹法分析骨痂中Ⅰ型胶原蛋白水平:机械碎裂法裂解标本,准备好硝酸纤维素膜(nitrocellulose filter membrane,NC膜),在半干电转缓冲液中浸泡15 min。按双层滤纸→分离胶→NC膜→双层滤纸的顺序叠放,用湿玻棒轻轻滚过,凝胶靠近负极,而NC膜靠近正极。设定电流100 mA,转移约35 min,转移完毕,蒸馏水冲洗,将NC膜放放已盛有TBST(TBS+0.05%的吐温)的培养皿中在摇床约 4 min。在培养皿中加入体积为10~15 mL的含5%的脱脂奶粉的TBST,放入NC膜,室温下摇动封闭30 min以上,用胶膜盖好培养皿,置胶膜盖好培养皿,置冰箱中过夜,上一抗(Ⅰ型胶原一抗为鼠抗人Ⅰ型胶原单克隆抗体,稀释度为1∶1 500)(10 μL IgG加TBST 15 mL):将NC膜TBST洗涤摇洗3次,每次5 min。室温在摇床上杂交2 h。洗涤,上二抗[兔抗鼠二抗(IgG),稀释度为1∶2 000](10 μL IgG加TBST 20 mL)杂交1 h。用TBST洗涤NC膜4次,每次10 min,将配好的发光液化学发光试剂 1 mL 滴到NC膜上,并确保发光液均匀布在膜上,反应3~5 min。曝光4 min,显影8 s,定影,晾干,记录,保存实验结果。将X线胶片置于Gel Doc2000图像分析系统。测定目的条带的平均吸光度值,每个组进行5次重复实验,取平均值作为Ⅰ型胶原蛋白含量的相对值。
1.2.4骨痂组织的骨密度测定 于骨缺损建模后第4、8、12、16周每组各处死3只大鼠,严格无菌消毒。充分暴露腰椎,取出腰椎标本,以腰椎骨骼结痂为中心,进行扫描(DPX2L 型双能X线骨密度仪)。将标本继续封闭保存于冷冻冰箱内(-20 ℃),进一步进行力学实验测定。
1.2.5力学性能测试 于骨缺损建模后第4、8、12、16周每组各处死3只大鼠,严格无菌消毒。充分暴露腰椎,取出椎体,保护椎体及其外壳皮质,剔除周边脂肪组织及筋膜,磨平椎体表面,制成柱形标本,使其接力面积约为9 mm2(长、宽、高分别为 5 mm、3 mm、2 mm),进行椎体紧压测试,以2 mm/min速度进行紧压。记录生物力学相关指标,包括最大负载荷量、最大应变量和弹性模量。

2 结 果
2.1实验入组情况 84只大鼠中,6只因感染和过度进食而死亡未进入实验分析,其余78只均进入结果分析。并于实验结束后,补充相应组别的实验鼠进行对应相同处理,获取相应的实验数据。实验大鼠姿势、步态、精神、食欲正常、营养良好、被毛光泽、体温、呼吸、反射、二便未见明显异常。
2.2Ⅰ型骨胶原蛋白含量变化 A组和C组Ⅰ型骨胶原蛋白含量于第2周开始逐渐升高,在第4周时达峰值,之后维持较高水平;B组和D组在第2周即达到峰值,4周后Ⅰ型骨胶原蛋白含量逐渐下降,呈现时间依赖性。在第1周时,A组和B组、C组和D组间比较差异无统计学意义(P>0.05),C组和D组Ⅰ型骨胶原蛋白含量均低于A组和B组(P<0.05);在第2周时,A组和C组比较差异无统计学意义(P>0.05),B组和D组比较差异无统计学意义(P>0.05),但B组和D组均显著高于A组,C组低于B组,D组高于C组(P<0.05);在4、5、8、12周时,B组和D组低于A组,C组均高于B组,D组低于C组(P<0.05),A组与C组比较差异无统计学意义(P>0.05),D组高于B组(P<0.05)。见图1、表1。
2.3骨痂组织的骨密度变化 4组骨密度值均在第8组时达到高峰,8周后骨密度值随着时间延长逐渐下降,呈时间依赖性。在第4周时,B组和C组骨密度值低于A组(P<0.05),D组均高于B组和C组(P<0.05),B组与C组比较差异无统计学意义(P>0.05),D组低于A组(P<0.05);第8周、12周、16周时,B组和D组低于A组,C组高于B组,D组低于C组(P<0.05),A组与C组比较差异无统计学意义(P>0.05),D组高于B组(P<0.05)。见表2。

Mr:分子量;A组:骨质疏松性骨缺损+(BMP-4/7 24 μg+纤维蛋白20 mg);B组:骨质疏松性骨缺损+胎牛血清;C组:正常骨质骨缺损+(BMP-4/7 24 μg +纤维蛋白20 mg);D组:正常骨质骨缺损+胎牛血清
图1 Ⅰ型胶原蛋白的含量
2.4检测骨缺损椎体生物力学性状 第4周时,最大载荷量:B组和D组低于A组,C组高于B组,D组低于C组(P<0.05),A组与C组比较差异无统计学意义(P>0.05),D组高于B组(P<0.05);最大应变力:D组大于A组、B组、C组(P<0.05),C组均高于B组,B组低于A组,A组和C组比较差异无统计学意义(P>0.05);弹性模量:C组高于A组、B组,D组低于C组(P<0.05),A组、B组、D组间比较差异无统计学意义(P>0.05)。第8周、12周、16周时,最大载荷量、最大应变力、弹性模量:B组和D组低于A组,C组均高于B组,D组低于C组(P<0.05),A组与C组间比较差异无统计学意义(P>0.05),D组高于B组(P<0.05)。见表3。
2.5骨痂组织中Ⅰ型骨胶原蛋白含量与骨痂组织生物力学指标关联性分析 A组Ⅰ型骨胶原蛋白含量与最大载荷量、最大应变量、弹性模量呈正相关(r=0.684,P=0.004;r=0.715,P=0.005;r=0.869,P=0.009;B组Ⅰ型骨胶原蛋白含量与最大负载荷量、最大应变量、弹性模量呈正相关(r=0.613,P=0.021;r=0.752,P=0.032;r=0.674,P=0.029);C组Ⅰ型骨胶原蛋白含量与最大载荷、最大应变量、弹性模量呈正相关(r=0.592,P=0.005;r=0.727,P=0.008;r=0.806,P=0.006);D组Ⅰ型骨胶原蛋白含量与最大载荷、最大应变量、弹性模量呈正相关(r=0.684,P=0.004;r=0.882,P=0.007;r=0.712,P=0.003)。

组别第1周第2周第4周第5周第8周第12周A组13.8±0.328.7±1.958.2±5.751.9±3.533.6±2.625.8±3.9B组13.5±0.743.6±2.6a32.3±3.1a18.6±2.8a16.7±4.3a10.2±3.5aC组11.8±0.8ab22.8±1.6b56.7±5.3b48.7±4.9b26.8±3.8b21.1±1.6bD组12.5±0.9ab48.4±3.2ac38.9±2.7abc23.5±3.2abc22.4±3.8abc13.9±2.6abcF值21.440851.000216.9001047.000197.100141.300P值0.043<0.0010.005<0.0010.0050.007
A组:骨质疏松性骨缺损+(BMP-4/7 24 μg+纤维蛋白20 mg);B组:骨质疏松性骨缺损+胎牛血清;C组:正常骨质骨缺损+(BMP-4/7 24 μg+纤维蛋白20 mg);D组:正常骨质骨缺损+胎牛血清;a与A组比较,P<0.05;b与B组比较,P<0.05;c与C组比较,P<0.05

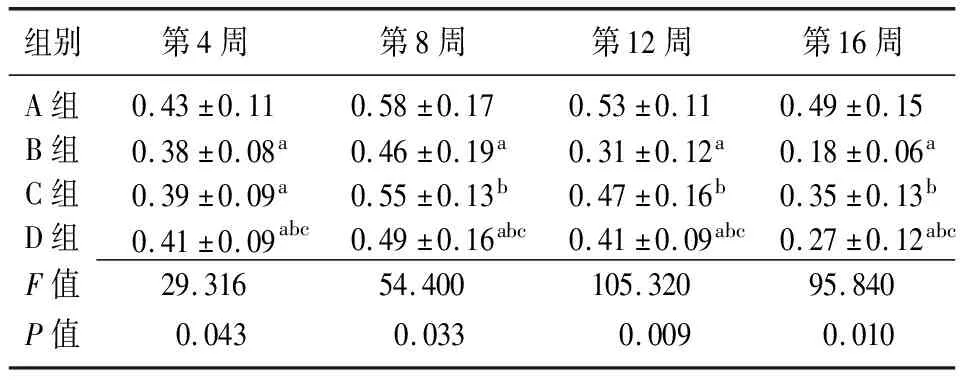
组别第4周第8周第12周第16周A组0.43±0.110.58±0.170.53±0.110.49±0.15B组0.38±0.08a0.46±0.19a0.31±0.12a0.18±0.06aC组0.39±0.09a0.55±0.13b0.47±0.16b0.35±0.13bD组0.41±0.09abc0.49±0.16abc0.41±0.09abc0.27±0.12abcF值29.31654.400105.32095.840P值0.0430.0330.0090.010
A组:骨质疏松性骨缺损+(BMP-4/7 24 μg+纤维蛋白 20 mg);B组:骨质疏松性骨缺损+胎牛血清;C组:正常骨质骨缺损+(BMP-4/7 24 μg +纤维蛋白20 mg);D组:正常骨质骨缺损+胎牛血清;a与A组比较,P<0.05;b与B组比较,P<0.05;c与C组比较,P<0.05
3 讨 论
随着我国人口的老龄化,在临床上由骨质疏松引起的椎体病理性骨缺损越来越常见[11]。但目前除手术治疗外,尚无其他明确而有效的治疗措施。故寻找有效减缓骨质疏松进程,早期预防和根本治疗骨质疏松性骨缺损的方法迫在眉睫。研究证实,BMP可以促进骨膜细胞向成骨细胞的分化,骨骼形成[12]。同时,有学者发现[13],纤维粘连蛋白(fibronectin,FN)对体外培养骨纤维细胞的胞外基质的表达具有明确的调节倾向,参与骨细胞分化,在维持组织形态和调节细胞的黏附性、生长及分化、增殖周期、基因表达中有重要作用。同时FN也是一种重要的连接元素,可有效促进骨细胞与材料之间的黏合。


组别最大载荷量第4周第8周第12周第16周A组35.45±4.3267.54±4.35106.38±11.02126.63±8.75B组21.36±1.82a35.63±2.69a51.78±3.50a63.21±2.71aC组33.52±3.92b65.12±3.28b116.45±9.63b124.47±5.76bD组29.76±1.55abc43.76±2.01abc58.35±4.87abc71.29±3.82abcF值57.960758.100246.000490.400P值0.017<0.0010.0400.002组别最大应变量第4周第8周第12周第16周A组15.27±2.1529.63±3.0931.91±2.2343.87±2.81B组11.36±1.62a16.47±0.92a18.92±2.53a24.83±3.08aC组16.84±3.25b28.73±2.99b42.15±2.54b46.36±2.87bD组28.73±2.99abc19.37±1.72abc23.31±3.58abc27.59±4.25abcF值296.600214.8001448.000700.600P值0.0030.005<0.001<0.001组别弹性模量第4周第8周第12周第16周A组47.85±2.6158.67±4.7269.24±2.5875.84±2.31B组46.52±3.5251.57±2.55a57.28±2.34a61.84±3.88aC组52.53±3.20ab56.48±2.64b68.53±3.03b73.18±3.26bD组48.81±4.27c54.37±4.33abc61.76±5.62abc64.66±4.35abcF值41.69016.79042.850172.900P值0.0230.0300.0230.006
A组:骨质疏松性骨缺损+(BMP-4/7 24 μg+纤维蛋白 20 mg);B组:骨质疏松性骨缺损+胎牛血清;C组:正常骨质骨缺损+(BMP-4/7 24 μg +纤维蛋白20 mg);D组:正常骨质骨缺损+胎牛血清;a与A组比较,P<0.05;b与B组比较,P<0.05;c与C组比较,P<0.05
本研究结果显示,A组与C组Ⅰ型骨胶原蛋白含量趋势基本相同,B组和D组Ⅰ型骨胶原蛋白含量均明显低于A组和C组,并于第4周即开始下降。提示FN可作为BMP-4/7的良好黏附和缓释载体,可维持较长时间的BMP水平,使BMP-4/7更好地发挥成骨效应[14]。同时,通过纤维蛋白为载体,BMP可在骨质疏松环境下充分发挥促进骨愈合的功能。本研究D组略高于B组,也符合骨质疏松影响病理性骨缺损的愈合力能力的理论。
有研究报道,Ⅰ型骨胶原蛋白的合成峰过早和提前衰落可刺激机体破骨细胞的功能亢进,促进由成骨细胞引发的破骨细胞前体分化与融合,诱导破骨细胞凋亡,抑制成骨作用[15]。因BMP-4/7与FN复合物在骨质疏松性骨缺损愈合过程中可长时有效维持骨吸收和骨形成的动态平衡,因此具有更好的成骨功效,本实验结果也验证了这一点[16]。本研究结果显示,A组骨密度在各时点间与C组比较其峰值和下降幅度未出现明显差异,而B组骨密度值明显下降,在伤后16周时最低。说明BMP4/7与FN复合物可有效改善骨质疏松性骨缺损骨密度状态。这与文献中报道的BMP可抑制骨缺损骨纤维骨小梁间隙的增大,增加骨量,促进骨形成的原理相一致[17-18]。
本研究中,A组最大载荷、最大应变量、弹性模量较同时期(8、12、16周)和C组等同,B组和D组显著低于A组。表明BMP4/7与FN复合物可明显改善小鼠局部骨痂生物学性能。骨质疏松性椎体骨骨小梁厚度及连续性增加,骨缺损愈合质量明显提高,致骨缺损区张力增强,椎体的力学性能增加,骨小梁抗载荷能力提高,不易骨折,可明确改善骨质疏松性骨缺损愈合的骨强度和骨痂形状,抗张力明显增强[19]。本研究加入BMP-4/7与FN复合物后,Ⅰ型胶原蛋白的含量与骨痂组织的最大载荷、最大应变量、弹性模量均呈高度直线相关,其相关性明显高于未加入BMP-4/7与FN复合物组。提示融合基因BMP-4/7可以通过纤维蛋白作为有效载体,在一定程度上逆转Ⅰ型胶原在骨质疏松性骨缺损骨愈合过程骨矿化能力的下降,并提供良好的生物支架,减少BMP基因蛋白的丢失。这可能与纤维蛋白能够充分作用于骨缺损的愈合骨痂表面,而加速钙盐等无机质的沉积,增加骨缺损愈合的骨痂的抗张力、提升骨缺损愈合质量等性能相关[20]。
综上所述,以纤维蛋白为载体的BMP-4/7对大鼠椎体骨质疏松性骨缺损愈合过程具有较强的促进骨愈合作用。
