氧化物负载纳米金催化葡萄糖选择氧化
2020-03-27张云来张军营黄家辉
张云来, 张军营, 洪 峰, 邵 斌, 黄家辉
(1.中国科学院 大连化学物理研究所 金催化研究中心,辽宁 大连 116023;2.中国科学院大学,北京 100049)
随着化石能源的枯竭及环境污染问题的日益严重,将生物质资源转化为有价值的化学品逐步引起人们的关注[1-3]。纤维素作为含量最为丰富的生物质资源,其水解产物葡萄糖及葡萄糖氧化产物葡萄糖酸及其盐因良好的生物相容性,被广泛应用于食品、制药、造纸等行业。近些年来,人们发现在Pd、Pt和 Au等催化剂作用下可以实现葡萄糖到葡萄糖酸及其盐的高效转化[1,4-5]。但Pd和Pt等催化剂在反应中存在贵金属流失及其导致的催化剂失活问题,而纳米金催化剂在葡糖糖氧化过程中不仅具有较高的活性和产物选择性,而且有非常好的反应稳定性[6-7]。因此,纳米金催化葡萄糖选择氧化成为了研究热点之一[1,8]。2002年,Serena Biella发现Au/C(活性炭负载的纳米金催化剂)对葡萄糖氧化成葡萄糖酸具有非常好的效果[9]。随后,人们陆续对葡萄糖选择氧化机理、催化剂制备方法和纳米金粒子大小对催化活性的影响进行了详细考察[10-12]。研究发现,金纳米粒子的尺寸对金催化剂的反应活性具有非常明显的影响,但是,由于活性炭载体与金纳米粒子作用较弱,随着反应的进行,金颗粒会逐渐长大,进而导致催化剂活性逐渐降低。因此,笔者选用与金纳米粒子具有较强相互作用的金属氧化物作为载体,详细考察了反应过程中pH值、反应温度、氧气体积分数及氧化物载体种类等对氧化物负载纳米金催化葡萄糖选择氧化反应活性的影响。
1 实验部分
1.1 试剂与仪器
葡萄糖、氢氧化钠,AR,国药集团化学试剂有限公司产品;HAuCl4,质量分数99.99%,沈阳金属所产品;TiO2(p25)、ZrO2、ZnO,纳米级,阿拉丁公司产品;聚乙烯醇(Poly(vinyl alcohol),简称PVA),相对分子质量16000,质量分数98%,比利时ACROS有限公司产品;NaBH4(质量分数98%),国药集团化学试剂有限公司产品;氧气(O2)体积分数分别为10%、20%、60%、100%,大连大特气体有限公司产品。
DZG-6050型真空干燥箱(上海森信实验仪器有限公司产品);KSL-1200X马弗炉(合肥科晶材料技术有限公司产品);METROHM 902 Titrando(瑞士万通公司产品)全自动电位滴定仪;IKA RCT basic磁力搅拌器(德国IKA公司产品)。
1.2 催化剂制备
采用溶胶-固载法制备不同氧化物(氧化钛、氧化锆、氧化锌)负载的纳米金催化剂。取2.42 g HAuCl4溶液(30.2 mmol/L)于200 mL烧杯中,加入100 mL去离子水;然后搅拌10 min(转速600 r/min),加入9.2 g相对分子质量为16000、质量浓度为 0.015 mmol/L 的PVA(聚乙烯醇)溶液;继续搅拌30 min,再快速加入18.4 mg NaBH4,得到金胶体溶液。将氧化物载体加入到上述金溶胶溶液中。根据氧化物的等电点,调节溶液的pH值,确保金纳米粒子担载到载体上。最后,老化3 h,过滤、洗涤、烘干,300 ℃空气气氛下焙烧2 h,分别得到金理论担载质量分数为1.2%的Au/TiO2、Au/ZrO2、Au/ZnO催化剂。
1.3 催化剂性能评价
称取2.62 g葡萄糖装入100 mL三颈烧瓶中,再依次加入18.2 mg催化剂和50 mL超纯水。反应物葡萄糖与金的摩尔比约为16000:1,葡萄糖摩尔浓度为0.29 mol/L。将三颈烧瓶放入恒温水槽中缓慢搅拌。待溶液温度升到设定温度后,打开全自动电位滴定仪,设置pH值,将搅拌速率调整到1000 r/min。通入一定浓度氧、氮混合气体(60 mL/min),开始反应。反应期间,通过全自动电位滴定仪控制溶液的pH值恒定在设定值。根据碱性条件下葡萄糖氧化的反应机理(见图1)[13],在没有副反应存在的情况下,葡萄糖与消耗的碱存在摩尔比为1∶1的化学计量比关系。因此可以用消耗的碱液量(1 mol/L NaOH)来计算葡萄糖的转化率。当葡萄糖完全转化后,随着时间的延长,溶液的pH值不会再发生变化。此时,增加反应时间消耗的碱液量也不会增加,这就导致葡萄糖转化率随时间变化的曲线会有一个平台出现,代表反应的终止。
葡萄糖转化率(x)及转化频率(Turnover frequency, TOF,h-1)计算公式如下:
(1)
(2)
ngold=ntotal×d
(3)
式中,nglucose表示转化的葡萄糖的物质的量,mol;ninitial表示葡萄糖总物质的量,mol;ngold表示负载的金颗粒表面金原子的物质的量,mol;t为反应时间,h;ntotal表示催化剂上负载的金的物质的量,mol;d为金属分散度(d=1/D,其中D为金颗粒的平均粒径)。

图1 葡萄糖氧化反应过程Fig.1 Scheme of glucose oxidation
1.4 催化剂表征
采用美国Micromeritics公司生产的ASAP2020型全自动物理吸附仪(N2物理吸附)测试样品的比表面积。首先,在250 ℃下真空脱气6 h,除去水分及其他杂质;然后,在-196 ℃下进行N2吸附-脱附实验;最后,通过BET方法计算样品的比表面积。
利用Shimadzu公司生产的ICPS-8100型等离子体发射光谱(ICP-OES)测定催化剂的金担载量。在金离子质量分数为10 μg/g左右、酸质量分数不超过10%的条件下进行测试。
样品的CO吸附实验是在美国Bruker公司生产的VERTEX 70型红外光谱仪上进行。首先,在120 ℃和He气氛下吹扫30 min;然后,通过低温装置降温到25 ℃,扫描背景3次;最后,通入CO,检测CO吸附峰的位置。
样品透射电镜表征是在日本电子株式会社生产的JEM-2100型透射电子显微镜(TEM)上进行。加速电压是3.0 kV。将少量样品加入到3 mL乙醇中,超声分散,然后滴加到涂覆有碳膜的铜网上。待乙醇挥发后进行电镜观察。
2 结果与讨论
2.1 pH值对Au/TiO2催化葡萄糖氧化反应活性的影响
首先以Au/TiO2催化剂为模型催化剂,考察了pH值对Au/TiO2催化葡萄糖氧化制葡萄糖酸的影响,结果见图2。由图2可知,pH值对Au/TiO2催化葡萄糖氧化反应速率有很大影响。当pH值为8.5时,反应速率较低,其TOF只有3.42×102h-1。随着pH值的增加,其反应速率急剧增加。当pH值为9.5时,其转化频率提升了一个数量级,为 4.4×103h-1。进一步提升pH值到10.5,其TOF进一步增加到7.4×103h-1。可见增加pH值可以显著提高葡萄糖氧化的反应速率。但是从图2(a)可以看出,当pH值太高或太低时,反应消耗了与葡萄糖投放量相同物质的量的碱液后,葡萄糖转化率随时间变化的曲线并没有平台出现的趋势,说明反应随着时间的延长可以继续进行。这种现象表明,在此条件下的反应过程中,葡萄糖氧化的反应路径发生了改变,有过度氧化等副反应发生。由此可见,在葡萄糖氧化反应过程中,pH值的选择至关重要。当pH值为9.5时,不仅可以保持一个较高的催化反应速率,而且可以将反应控制在葡萄糖酸生成这一步,避免过度氧化发生。这一结论与Biella等[14]研究的Au/C催化剂体系所得出结论一致,即当pH值过高时,将会发生碱催化反应,如Claisen缩合、Cannizzaro反应和异构化等。
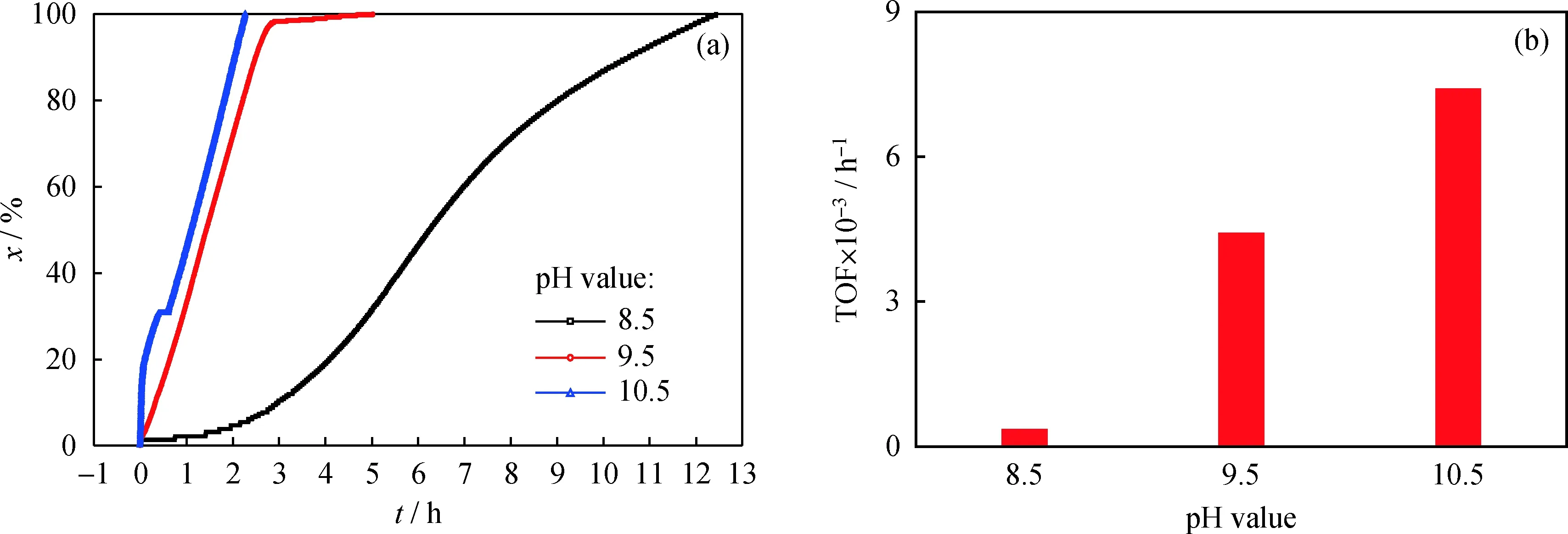
图2 pH值对Au/TiO2催化葡萄糖氧化反应转化率(x)和转化频率(TOF)的影响Fig.2 Effect of pH value on glucose conversion (x) and TOF over Au/TiO2 catalystReaction condition: n(Glucose)/n(Au)=16000; T=60 ℃; φ(Oxygen)=20%(a) x; (b) TOF
2.2 温度对Au/TiO2催化葡萄糖氧化反应活性的影响
在pH值为9.5的条件下,考察了温度对 Au/TiO2催化葡萄糖氧化制葡萄糖酸的影响,结果见图3。从图3(a)可以看出,当反应温度为30 ℃时,葡萄糖转化速率很慢,需要9 h才能完全转化。随着反应温度的升高,葡萄糖转化速率变快,完全转化所需的时间逐渐减少。当反应温度为60 ℃时,葡萄糖全部转化所需的时间降为3.7 h。TOF计算结果也表明,随着反应温度的升高,催化剂的本征反应速率也从30 ℃的1.16×103h-1,提升到60 ℃的4.41×103h-1(图3(b))。可见反应温度对于Au/TiO2催化葡萄糖氧化的速率有很大的影响。提高反应温度有利于葡萄糖氧化反应的进行。但是,当反应温度进一步提高到70 ℃时,反应的TOF仅为2.52×103h-1,远低于60 ℃的TOF。从反应后溶液的颜色可以看到,当反应温度为70 ℃时,反应溶液变为深棕色、糊状,且有芳香味。根据文献[15]所述,这种情况可能是由于反应温度过高导致葡萄糖发生异构化、过度氧化、结焦等引起。因此,葡萄糖氧化过程反应温度控制在60 ℃时有较好的结果。
2.3 氧气体积分数对Au/TiO2催化葡萄糖氧化反应活性的影响
在pH值为9.5、反应温度为60 ℃的条件下,考察了氧气体积分数对Au/TiO2催化葡萄糖氧化反应的影响。由图4可知,当氧气体积分数为10%时,葡萄糖氧化反应的速率很慢,反应完成所需的时间约为12 h,其TOF仅为1.36×103h-1。当氧气体积分数为20%时,葡萄糖完全转化的时间极大地缩短,仅需222 min,对应TOF也提高到了4.41×103h-1。可见氧气体积分数对Au/TiO2催化葡萄糖氧化反应的速率影响较大。进一步提高混合气体中氧气体积分数到60%、100%,葡萄糖氧化反应速率进一步增加,其完全转化时间也分别缩短到2.7 h和2.3 h,TOF提升到5.28×103h-1和6.77×103h-1。Beltrame等[12]报道,对于没有氧化物负载的金溶胶催化葡萄糖选择氧化,葡萄糖和氧气的反应级数分别为0.4和1.0。当葡萄糖浓度一定时,反应速率随着氧气体积分数的增加而增加。但当氧气体积分数超过20%时,可能受到溶液中氧气溶解度的限制,进一步提高氧气体积分数对葡萄糖氧化反应的促进作用变弱。
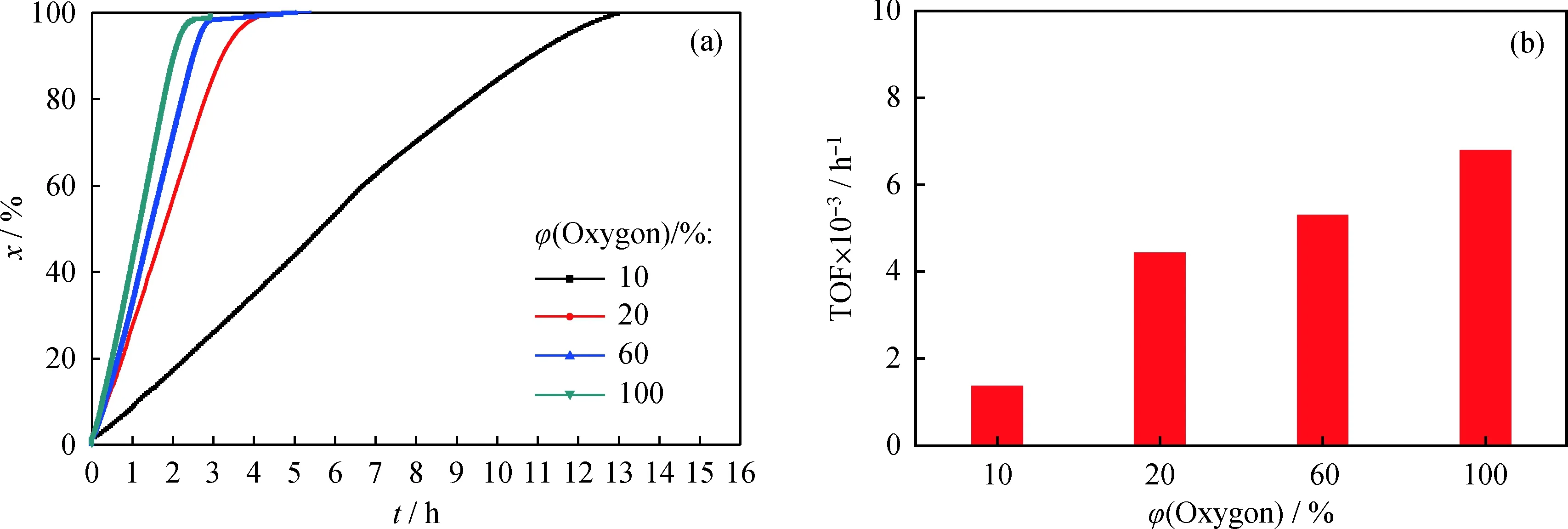
图4 氧气体积分数对Au/TiO2催化葡萄糖氧化反应转化率(x)和转化频率(TOF)的影响Fig.4 Effect of volume fraction on glucose conversion (x) and TOF over Au/TiO2 catalystsReaction condition: n(Glucose)/n(Au)=16000; pH=9.5; T=60 ℃; φ(Oxygen)=20%(a) x; (b) TOF
2.4 载体对纳米金催化葡萄糖氧化反应活性的影响
2.4.1 活性评价
Ishida等[16]对纳米金催化葡萄糖氧化反应的粒径效应进行过详细考察,发现金颗粒尺寸显著影响催化活性。但是,此工作采用的固相研磨法和沉积-沉淀法制备的金颗粒尺寸分布较宽,而且很难在不同载体上负载相似尺寸的金颗粒,因此很难考察载体效应对金催化剂活性的影响。笔者采用溶胶法制备了尺寸相似的金胶体颗粒,然后均匀负载到氧化钛、氧化锆、氧化锌载体上,通过空气气氛焙烧除去PVA (聚乙烯醇) 保护剂,金颗粒尺寸完好保持。在此基础上考察了载体效应对纳米金催化葡萄糖氧化反应的影响,结果见图5。从图5可以看出,不同载体负载的纳米金催化剂对葡萄糖氧化反应的活性由高到低的排列顺序是Au/ZrO2、Au/TiO2、Au/ZnO。经计算得出Au/ZrO2、Au/TiO2和Au/ZnO催化氧化葡萄糖的TOF分别是5.13×103h-1、4.41×103h-1、4.15×103h-1。以上结果表明,Au/ZrO2催化剂对葡萄糖氧化反应具有最优异的催化活性,这一结果与Ishida等报道的结果一致[16]。
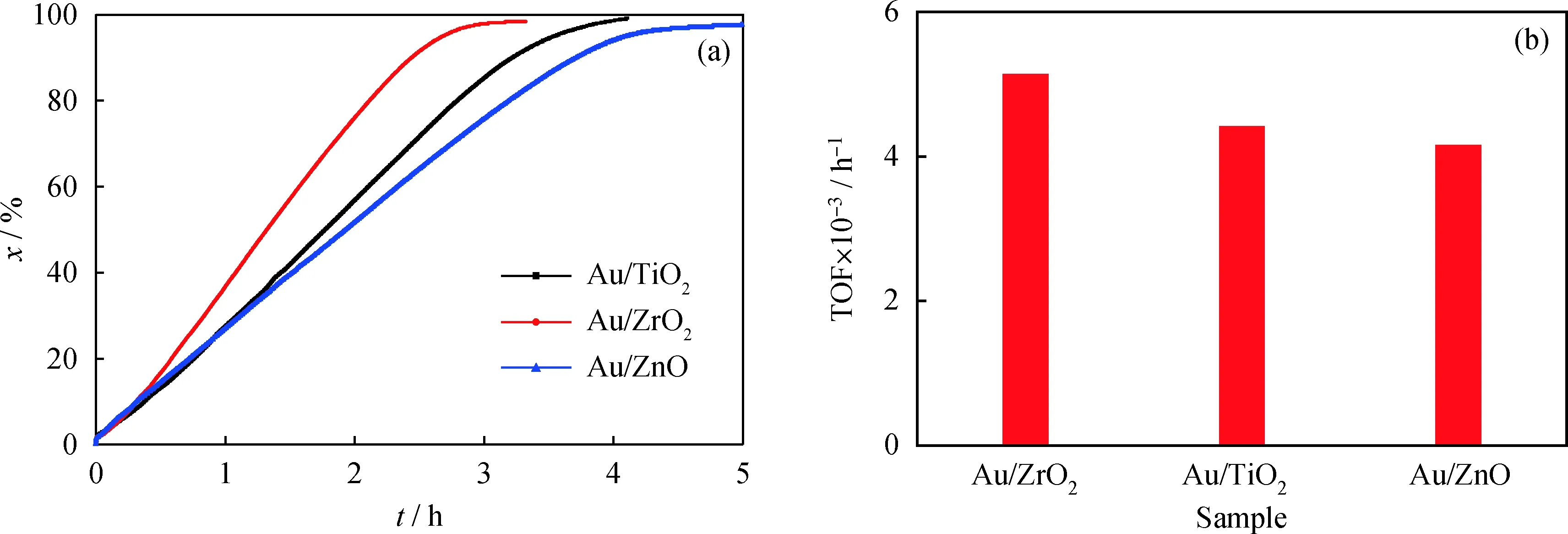
图5 载体对纳米金催化剂催化葡萄糖氧化反应转化率(x)和转化频率(TOF)的影响Fig.5 Effect of supports on glucose conversion (x) and TOF over Au catalystsReaction condition: n(Glucose)/n(Au)=16000; pH=9.5; T=60 ℃; φ(Oxygen)=20%(a) x; (b) TOF
2.4.2 物性表征
(1)电镜和粒径分析
为了考察金纳米粒子的大小对葡萄糖氧化反应活性的影响,对Au/ZrO2、Au/TiO2、Au/ZnO催化剂做了电镜表征,并对金纳米粒子进行了粒径统计,统计数超过400个,结果见图6。从图6可以看出,金纳米粒子高度分散在ZrO2、TiO2、ZnO载体表面,并且尺寸均匀;平均粒径分别为(3.6±0.8)、(3.8±0.8)、(3.8±0.7) nm。从以上结果可以看出,不同氧化物载体上金颗粒的尺寸大致相同,因此推测葡萄糖氧化反应活性的差异更可能是载体不同所引起。
(2)ICP和BET分析
对Au/ZrO2、Au/TiO2、Au/ZnO 3个纳米金催化剂进行了ICP表征,结果见表1。从表1可以看出,3个催化剂的金担载质量分数都接近于1.0%。说明溶胶-固载法可以很好地控制金的担载量,使不同氧化物载体上金的担载量相近。这进一步排除了金负载量对葡萄糖氧化反应活性的影响。以上结果表明不同氧化物负载的纳米金催化剂在葡萄糖氧化反应中活性的差异主要是载体本身性质的不同所引起。
由于气-液-固三相反应中,催化剂对反应物的吸附对反应活性有很大的影响,因此,对这3种氧化物负载纳米金催化剂进行了BET表征,见表1。BET表征结果表明,Au/TiO2催化剂和Au/ZnO催化剂的比表面积相近,而Au/ZrO2催化剂的比表面积仅为Au/TiO2和Au/ZnO比表面积的1/2。催化剂的比表面积越大越容易吸附反应物种,对反应通常有促进作用;而实际上比表面积最大的 Au/TiO2催化剂并没有展现出最好的反应活性。以上结果表明,催化剂的比表面积与葡萄糖氧化反应的活性无线性关系。
(3)In situ DRIFT表征
为了进一步探究上述催化剂活性差异的原因,对Au/ZrO2、Au/TiO2、Au/ZnO催化剂进行了In situ DRIFT表征,见图7。由图7看到,这3个催化剂在2101 cm-1左右有1个CO的吸附峰,这个峰可以归属为金属态金对CO的吸附[17]。图7表明3个催化剂表面金的电子性质是类似的;同时还看到,CO在这3个催化剂上的吸附量有很大不同,由多到少的顺序为Au/ZrO2、Au/TiO2、Au/ZnO。纳米金催化剂上CO吸附通常与以下3个因素密切相关:1)金颗粒分散程度。金颗粒分散程度越高,暴露的表面金原子越多,CO吸附量越大。2)表面金原子配位数。表面金原子配位数越低(越不饱和),CO吸附越强,特别是处于边、角、台阶处的金原子,而这和金颗粒形貌密切相关[18]。Boccuzzi等[17]发现,相比金颗粒上平面处金原子,边、角、台阶处金原子配位数更低,CO吸附能力显著增强。3)温度。相比钯、铂催化剂,金催化剂吸附CO能力很弱,随着温度升高,CO将快速脱附。在室温条件下,只有和CO相互作用较强的低配位数表面金原子才能吸附CO。在本工作中,CO吸附实验都在25 ℃进行,因此可以排除温度对CO吸附量的影响。此外,Au/ZrO2、Au/TiO2和 Au/ZnO 的金颗粒尺寸分别为3.6、3.8、3.8 nm,非常相似,也可以基本排除金颗粒分散程度对CO吸附量的影响。因此,很有可能是Au/ZrO2、Au/TiO2和Au/ZnO上金颗粒表面金原子配位数的不同导致了CO吸附量的较大差异,而这和金颗粒形貌密切相关,由金颗粒与载体间相互作用强弱决定。在这3个催化剂中,Au/ZrO2对CO吸附量最大,拥有最多低配位数表面金原子,因而其吸附、活化氧气能力最强,催化活性最高;其次是Au/TiO2;Au/ZnO最小。当然,也不排除由于金颗粒与TiO2、ZnO存在强相互作用,在空气焙烧过程中部分TiO2、ZnO会迁移并覆盖部分表面金原子,导致暴露的表面活性金原子的减少[19-20],进而导致CO吸附量的减少和催化活性的降低。
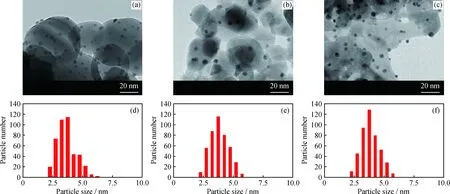
图6 Au/ZrO2、Au/TiO2、Au/ZnO催化剂的电镜照片和相应的金纳米粒子粒径分布Fig.6 TEM images of Au/ZrO2, Au/TiO2, Au/ZnO catalysts and the corresponding size distributions of Au nanoparticles(a), (d) Au/ZrO2; (b), (e) Au/TiO2; (c), (f) Au/ZnO(a), (b), (c) TEM; (d), (e), (f) Particle size distribution
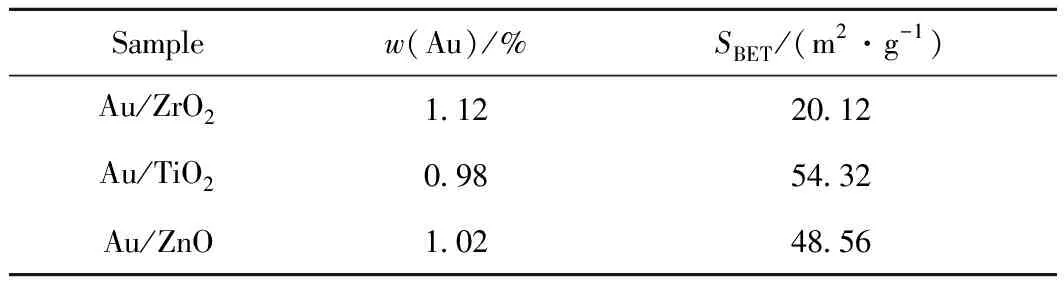
表1 Au/ZrO2、Au/TiO2、Au/ZnO的金担载量和比表面积Table 1 Au loadings and BET surface area of Au/ZrO2,Au/TiO2 and Au/ZnO samples
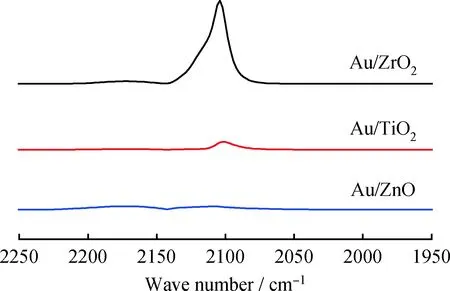
图7 25 ℃下Au/ZrO2、Au/TiO2、Au/ZnO催化剂CO原位红外吸收光谱Fig.7 In situ DRIFT spectra of CO adsorption forAu/ZrO2, Au/TiO2, Au/ZnO at 25 ℃
通过比较发现,纳米金催化剂上CO吸附量的大小与其催化葡萄糖氧化活性的高低是一致的。由于目前实验条件的限制,很难区分不同金催化剂上CO吸附量的差异究竟是部分表面金原子在焙烧过程中被氧化物部分覆盖所致,还是金颗粒、载体间强相互作用导致金颗粒形貌变化所引起。
3 结 论
系统地考察了氧化物负载纳米金催化葡萄糖氧化反应中,pH值、反应温度、氧气体积分数及载体对反应活性的影响。研究结果表明,提高反应体系的pH值、反应温度以及氧气体积分数都可以提高葡萄糖氧化的反应速率。但是过高的pH值和反应温度都会导致葡萄糖氧化副反应的发生,不利于获得较高的葡萄糖酸选择性。通过比较不同载体负载纳米金催化剂在葡萄糖氧化反应中的活性,及结合电镜、In situ DRIFT等表征,可以清晰地得出以下结论,即氧化物载体与金纳米粒子相互作用的不同所引起的纳米金催化剂活性位点的差异可能是导致催化活性差异的主要原因。
