水通道蛋白过表达对脊髓损伤大鼠便秘的影响
2020-03-27徐珮珮杨明亮刘长彬李雅静刘梓桐李建军
徐珮珮,杨明亮,刘长彬,李雅静,刘梓桐,李建军
1.首都医科大学康复医学院,北京市 100068;2.中国康复研究中心北京博爱医院脊柱脊髓神经功能重建科,北京市 100068;3.北京脑重大疾病研究院神经损伤与修复研究所,北京市 100068;4.北京市神经损伤与康复重点实验室,北京市 100068;5.首都医科大学附属北京天坛医院康复医学科,北京市 100070
肠道功能障碍是脊髓损伤后较为常见的并发症,会引起腹胀、腹痛和顽固性便秘等症状。据统计,近半数脊髓损伤患者存在严重便秘问题[1]。通常认为,脊髓损伤后肠道功能障碍与大便干硬导致粪便在结肠内停留时间过长、水分过度吸收等有关。
水通道蛋白(aquaporins,AQPs)是控制各种细胞含水量的膜水通道之一,与先天性白内障、肾源性尿崩症等多种疾病有关[2]。在胃肠道中,AQPs的异常表达可见于多种疾病。近年来发现,肠道黏膜AQPs 过度表达与便秘存在一定关系。结肠中,参与水转运的AQP 包 括AQP1、AQP2、AQP3、AQP4 和AQP8[3‐4]。其中AQP1、AQP3 和AQP4与便秘关系更密切[5‐6]。Ikarashi等[7‐8]的实验也证明AQP3功能或表达的降低会导致腹泻,推测可能是降低了结肠管腔侧到血管侧的吸水性。结肠中的AQPs 可能在一定程度上参与调节粪便含水率。
本研究观察大鼠脊髓损伤后结肠AQP1、AQP3和AQP4 的表达变化,检测其表达水平与粪便含水率的相关性。
1 材料与方法
1.1 实验动物及分组
48 只SPF 级Sprague‐Dawley 大鼠,体质量(220±10) g,由北京维通利华公司提供,许可证号SCXK(京)2009‐0017,分为对照组(n=24)和脊髓损伤组(n=24)。大鼠单笼饲养,室温(21±1)℃,湿度30%~70%,12 h黑夜‐白昼循环,自由取食及饮水。实验前,所有大鼠均在标准环境下饲养7 d。研究设计和实验操作均符合首都医科大学动物伦理委员会的要求,伦理审查号AEEI‐2019‐045。
1.2 主要试剂及仪器
DH‐101‐2电热恒温鼓风干燥箱:天津中环实验电炉有限公司。AQP1 抗体、AQP3 抗体、AQP4 抗体:武汉赛维尔生物科技有限公司。HistoFAXS 软件:奥地利TISSUE GNOSTICS 公司。1.48 版Image J 软件:美国国立卫生研究院。
1.3 动物模型
术前禁食不禁水12 h。予动物5%异氟烷诱导麻醉,2%异氟烷维持麻醉。大鼠俯卧位,背部正中切口,显露T7‐9椎板并去除,显露胸髓,于T8椎体位置用手术剪横断脊髓,建立T8脊髓损伤模型[9‐11]。脊髓残端出血,用明胶海绵覆盖止血,出血通常15~30 s停止。缝合肌肉和皮肤。对照组仅咬开椎板,暴露脊髓后关闭伤口。术中大鼠采用体位暖垫保暖。术后肌注青霉素20万U,每天1次,连续7 d。每天两次给予手动辅助脊髓损伤大鼠排尿,同时按摩和被动活动双下肢防止压疮。
1.4 评定方法
1.4.1 Basso‐Beattie‐Bresnahan(BBB)评分
于造模前,造模后第1、3、7、14、28 天,每组取8 只大鼠,采用BBB 评分评定大鼠双侧后肢运动功能。将大鼠置于直径约90 cm、高7~10 cm 的塑料池内,底面粗糙,由两位独立检查人员观察大鼠连续4 min 内的运动能力。0 分,完全下肢瘫痪;21 分运动能力正常[12]。
1.4.2 粪便含水率
术前,术后第3、14、28 天,每组取8 只大鼠,评估两组粪便含水率。评估前3 d 每只大鼠定量给食30 g/d、给水50 ml/d,评估在早晨8 点开始。先将大鼠转移至无垫层的单独观察笼中,禁食禁水2 min。2 h 后检查者用镊子从大鼠肛门处收集新鲜粪便颗粒,用塑料袋密封,称湿重;90 ℃电热恒温鼓风干燥箱中干燥48 h后,称得干重。依据公式计算粪便含水率。

1.4.3 免疫组化技术检测AQP1、AQP3 和AQP4 在结肠组织中的表达
两组在术后第3、14、28 天各处死大鼠8 只,在距肛门3 cm 处切取1 cm 左右结肠标本。4%多聚甲醛固定,石蜡包埋,连续切片,片厚4~5 μm,脱蜡至水,切片高压蒸锅法抗原修复,PBS 冲洗。分别加AQP1 (GB11310,1∶ 2000)、AQP3(GB11395,1∶1000)、AQP4(GB11311‐1,1∶1000)一抗,4 ℃孵育过夜。0.2% PBS 液冲洗5 min 后,加HRP 标记的二抗,室温孵育2 h,复染细胞核后脱水封片[15]。采用Histo‐FAXS 软件对所有切片进行20 倍放大成像。采用Im‐age J 软件测量每张切片阳性着色面积和积分光密度(integrated density,ID)[16]。
1.4.4 脊髓、肠道HE染色
术后第28 d,将大鼠麻醉(方法同前),固定(方法同前)后取脊髓损伤区、结肠(距肛门3 cm 处) 组织标本各1 cm,石蜡包埋,切片5 μm 厚,常规HE 染色。采用Olympus光学显微镜观察。
1.5 统计学分析
采用GraphPad Prism v 5.0、SPSS 22.0 生成统计分析。计量资料以(±s)表示,组间比较采用独立样本t检验。组内不同时间点比较采用单因方差分析和LSD 检验。采用Pearson 相关分析检验粪便水含率与AQPs的相关性。显著性水平α=0.05。
2 结果
脊髓损伤组出现明显的便秘、尿潴留等症状。对照组未出现神经功能障碍或便秘。
2.1 BBB评分
对照组术后各时间点间BBB 评分无显著性差异(P>0.05)。脊髓损伤组术后BBB 评分时间效应显著(P<0.001),且均显著低于对照组(P<0.001)。见表1。
2.2 粪便含水率
对照组各时间点粪便含水率无显著性差异(P>0.05)。脊髓损伤组术后各时间点粪便含水率均显著降低(P<0.001),随着时间延长略有增加,但均显著低于对照组(P<0.001)。见表2。
2.3 AQP1、AQP 3、AQP 4在结肠组织中的表达
2.3.1 AQP1
AQP1 的表达主要分布在结肠黏膜上皮细胞中,在细胞顶端、基底侧和腔面较为丰富。少量阳性表达于黏膜下层和肌层。与对照组相比,脊髓损伤组阳性细胞染色更明显,呈棕褐色。见图1。脊髓损伤组第3、14、28 天结肠黏膜细胞AQP1 表达均显著高于对照组(P<0.001)。见表3。
2.3.2 AQP3
AQP3 主要表达在结肠黏膜顶部的上皮细胞中,集中在基底面和管腔面,少见于杯状细胞,呈黄色或棕黄色。在着色量及程度上,脊髓损伤组高于对照组。见图2。脊髓损伤组第3、14、28 天结肠黏膜AQP3表达均显著高于对照组(P<0.001)。见表4。
2.3.3 AQP4
AQP4 阳性细胞多见于结肠黏膜顶端,以细胞膜基底侧为主,杯状细胞少见。脊髓损伤组AQP4 阳性细胞表达显著高于对照组。见图3。脊髓损伤组第3、14、28 天结肠黏膜AQP4 表达均明显高于对照组(P<0.01)。见表5。

表1 各组不同时间点BBB评分比较

表2 各组不同时间点粪便含水率比较

图1 各组不同时间点结肠AQP1表达(免疫组织化学染色,bar=50 μm)

表3 各组不同时间点结肠AQP1表达(×107,ID)
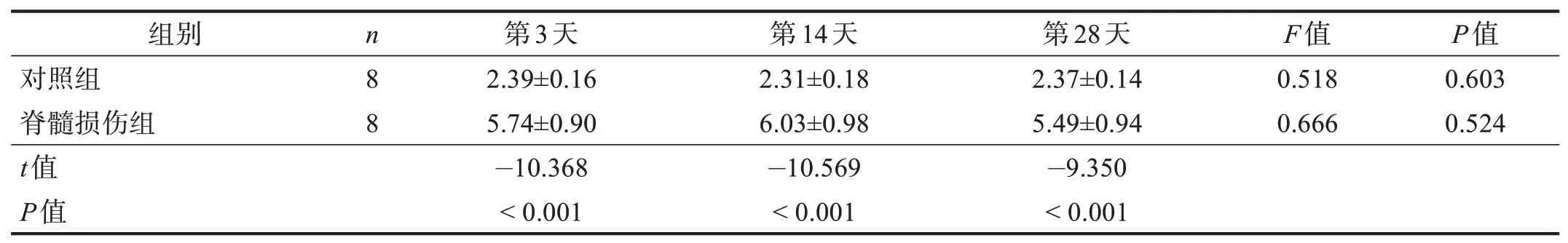
表4 各组不同时间点结肠AQP3表达(×107,ID)
2.4 AQPs表达与粪便含水率的相关性分析
AQP1、AQP3 和AQP4 均与粪便含水率呈显著负相关(r=-0791~-0.730,P<0.001)。见图4。
2.5 脊髓、结肠组织病理
脊髓损伤组脊髓内部结构紊乱,灰白质破坏,中央管破裂,神经细胞坏死。对照组脊髓结构完整,灰白质结构清晰。见图5。脊髓损伤组结肠见炎性细胞浸润,结肠隐窝萎缩,吸收细胞和杯状细胞数目减少,黏液分泌减少。对照组结肠未见明显炎症反应。见图6。
3 讨论
结肠的一个重要功能是重吸收肠道内容物的水分。人类的结肠在渗透压梯度下每天吸收水分约1.5~2 L。由于结肠上皮细胞间连接紧密形成屏障,水由结肠腔内进入结肠黏膜中,需要通过黏膜上皮细胞上AQPs 转运。在AQP 家族中,AQP1、AQP3、AQP4、AQP7、AQP8都存在于结肠,与结肠水的吸收与分泌存在很大关系[17‐20],它们的改变可能导致AQP 对水转运的干扰。
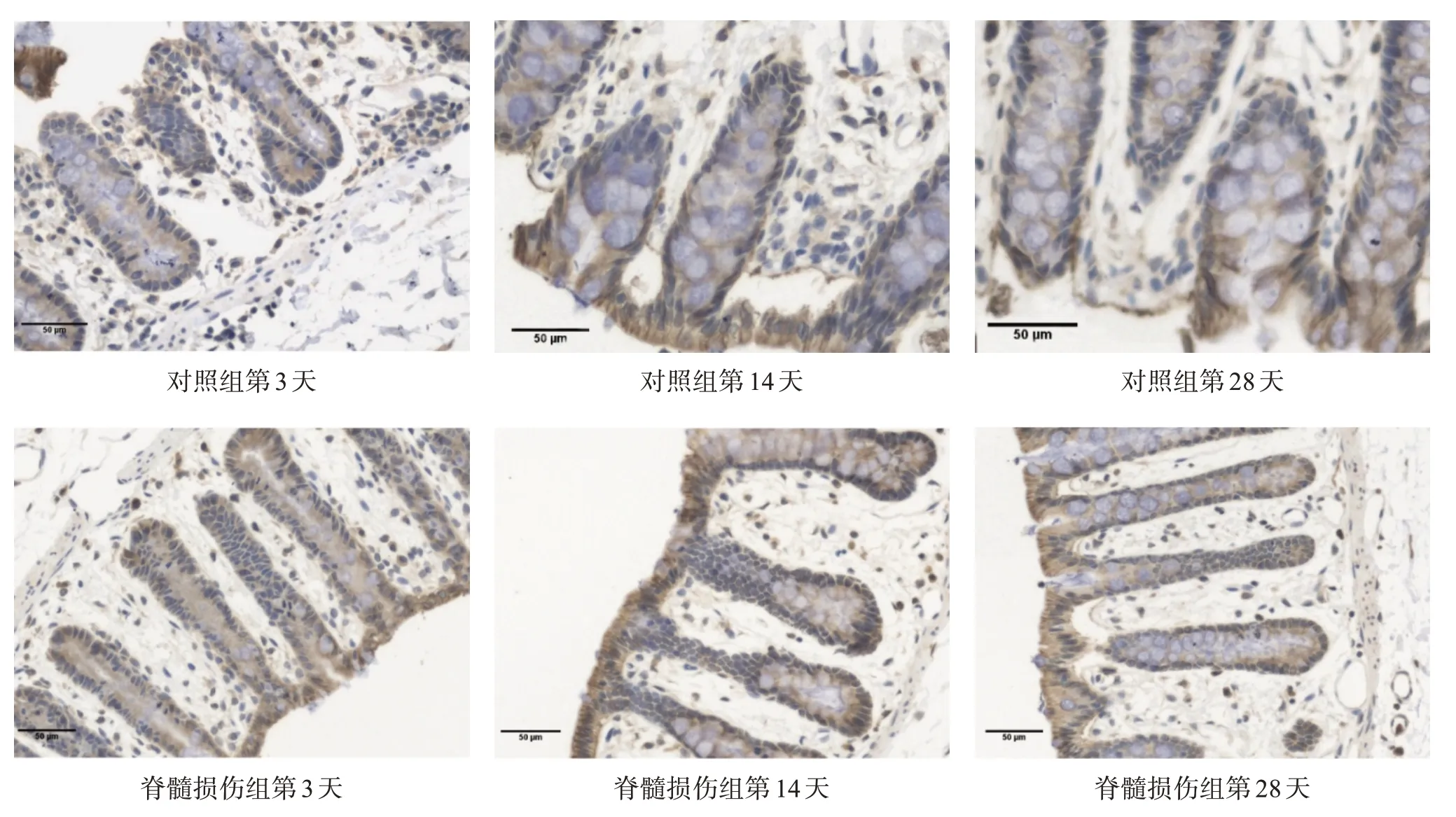
图2 各组不同时间点结肠AQP3表达(免疫组织化学染色,bar=50 μm)

图3 各组不同时间点结肠AQP4表达(免疫组织化学染色,bar=50 μm)
AQPs 异常表达可见于多种肠道疾病。在慢传输型便秘大鼠模型[21]和糖尿病大鼠链脲霉素诱导的胃肠功能障碍[22]中都观察到AQP1 表达增加。而在轮状病毒腹泻小鼠模型中,结肠AQP1、AQP4、AQP8 蛋白表达明显降低[23]。AQP3 广泛表达于远端结肠黏膜上皮细胞[24],其增加或减少会导致便秘或腹泻[25‐27]。AQP4 则在结肠上皮细胞的基底外侧膜中高度表达。AQP4 的下调与腹泻存在一定关系[28]。在霍乱毒素引起的腹泻[29]、过敏性腹泻[30]和炎症性肠病患者[31]中,都观察到AQP4显著下调。

表5 各组不同时间点结肠AQP4表达(×107,ID)

图5 两组脊髓损伤组织(HE染色,×20)

图6 两组结肠组织(HE染色,bar=100 μm)
本研究显示,脊髓损伤大鼠结肠黏膜上皮细胞AQP1、AQP3 和AQP4 表达增加,在脊髓损伤后4 周内持续存在。脊髓损伤后结肠AQPs 高表达,有利于水分通过肠壁黏膜。这种通透性变化对水转运是双向的,可以解释脊髓损伤患者易出现大便干硬。同时,对泻药高度敏感,易导致腹泻[32]。
脊髓损伤导致结肠AQPs 升高的原因尚不清楚。结肠AQPs 的表达受很多因素影响。渗透性泻药硫酸镁通过增加细胞内Mg2+,激活腺苷酸环化酶,增加结肠AQP3 的表达;刺激性泻药比沙可啶能降低结肠黏膜上皮细胞AQP3的表达水平[32]。Itoh等[33]的实验证明血管活性肠肽通过cAMP依赖通路调节AQP3的表达,影响肠道分泌,与便秘关系密切。在肠易激综合征患者中也观察到5‐羟色胺(5‐hydroxytryptamine,5‐HT)的释放量增加,提示炎症及机械刺激也可促进嗜铬细胞分泌5‐HT[34]。结肠黏膜中较高的5‐HT水平可增 加AQP3 的表达,促进水从管腔运输至血管侧面,导致大便硬化[35‐37]。
脊髓损伤后血管自主神经失调,远端结肠肠系膜动脉基础血灌注减少,结肠炎性因子表达上调[38]。由于肠道运动减慢,粪便长期滞留,结肠内炎性因子异常积累,肠道菌群增殖移位,进一步加重肠道慢性炎症的发生[39]。本研究中,脊髓损伤组结肠组织有炎性细胞浸润。因此,脊髓损伤后结肠炎症可能是导致肠黏膜AQPs异常表达的重要因素。
脊髓损伤后,由于失去中枢神经系统控制,各种组织的自主神经受体表达和反应性在损伤水平以下经常发生改变,自主神经回路发生重组[40]。肠道内受体表达和激素分泌也会发生适应性改变[41‐42],这也可能导致AQPs的异常表达。
目前对脊髓损伤后肠道功能障碍的研究多关注肠道动力下降,结肠传输时间延长[43‐44],粪便干硬,便秘严重。尽管脊髓损伤组和正常组结肠传输时间有差异,但我们通过在相同时间段内测定两组粪便含水率和AQPs 的变化,可以有效消除传输时间不同造成的影响。本研究结果显示,脊髓损伤后大鼠结肠黏膜AQPs 高表达,至少持续到4 周,且AQPs 过度表达与结肠粪便含水率有显著相关性,提示除肠道运动减慢、结肠传输时间延长外,结肠AQPs 的过度表达可能也是加重大鼠脊髓损伤后便秘的原因之一。
本研究尚有一些不足之处。研究周期较短,未对脊髓损伤后肠道AQPs变化进行长期观察。AQPs在结肠黏膜中的表达变化是本研究的重点,而其在脊髓损伤后的变化机制仍需进一步探讨。
综上所述,我们首次观察到脊髓损伤可导致大鼠结肠AQPs 过表达,与脊髓损伤后结肠水分过度吸收有关。本研究具有一些潜在临床优势可为脊髓损伤患者的便秘治疗提供研究方向。
