激素处理对楸树种子在不同温度下萌发特性的影响1)
2020-03-26崔令军陈诗嘉刘瑜霞林健石开明
崔令军 陈诗嘉 刘瑜霞 林健 石开明
(生物资源保护与利用湖北省重点实验室(湖北民族大学),湖北·恩施,445000)
楸树(CatalpabungeiC. A. Meyer),又称梓桐,为紫薇科(Bignoniaceae)梓树属(CatalpaScop.)高大落叶乔木,原产于中国,至今已有2600多年栽培历史,在中国分布范围广,遍及暖温带及亚热带,尤以山东、江苏、河南、湖北等省分布较多。楸树系我国特有的珍贵用材树种,材质优良、不翘不裂、纹理美观,在中国博大的树木园中,唯其“材”貌双全,自古就有“木王”之美称[1]。近年来,不少学者对楸树的生物学特性、组织培养、良种选育、造林技术等方面开展了较为系统的研究[2-7],但是,由于楸树是异花授粉植物,自花授粉不孕,往往只开花不结实,造成种子发芽率低,给楸树优良品系的繁殖造成很大的障碍;加之楸树因材质优良而加剧了人们对它的开发利用,造成楸树资源相对较少[8]。
植物激素不仅对植物生长发育具有调控作用,还对一些植物种子萌发具有促进或抑制作用[9]。植物外源激素是人工合成的具有生理活性、类似植物激素的化合物[10]。通过外源激素的质量浓度与配比变化,改变内源激素水平与平衡,实现植物不同生长发育阶段的需求。目前,外源激素在其他林木种子中已广泛应用,如桑树[11]、刺槐[12]、云南松[13]等,但对楸树种子萌发影响报道较少[14]。为提高楸树种子的发芽率,探寻适宜的楸树种子萌发条件,试验对楸树种子用外源激素GA3、IBA、ABA进行处理,在适宜的环境条件下进行发芽试验,探索其对发芽及幼苗生长的影响,以期为楸树的种子快繁、优良种质资源的开发利用提供参考。
1 材料与方法
供试材料为2018年10月在湖北恩施地区采集的楸树种子,选取新鲜成熟、大小均一、无损伤的种子,采后于室内阴干后调制,楸树种子质量为3.650 mg·粒-1。
去除空粒种子和物理损伤的种子,用质量分数为0.5%的K2MnO4溶液消毒0.5 h,然后分别用质量浓度为100、200、300、400 mg·L-1的赤霉素(GA3)、吲哚丁酸(IBA)、脱落酸(ABA)溶液浸种4、8 h;浸种后用蒸馏水冲洗去除残液,将种子布于发芽床上,放置于恒温和变温条件下进行发芽试验。发芽床为100 mm培养皿,内铺滤纸一层,贴好标签,写明树种、重复号及置床日期,然后放入培养箱中,恒温光照培养箱内温度为25 ℃,变温光照培养箱内温度为夜温15 ℃、昼温25 ℃,各12 h。每天定时统计发芽率,去除霉变种子,并视发芽床内水分状况适当补水。
以种子萌发后胚根达到种子长度的1/2为发芽标准。发芽持续时间的确定,根据GB 2772—1999《林木种子检验规程》的规定,以连续3 d每天的发芽粒数不超过每重复供试验种子粒数的1%为结束发芽[15-16]。试验数据采用Microsoft Excel 2016和SPSS22.0分析软件进行分析处理,用邓肯新复极差法(Duncan)进行显著性检验。
发芽率(Rg),Rg=(n/N)×100%;发芽势(Eg),Eg=(m/N)×100%;发芽指数(Ig),Ig=∑(ni/ti)。式中:n为试验结束时相应的萌发种子数;N为供试种子总数;m为3 d内发芽种子数;ti为发芽时间;ni为与ti相对应的每日发芽种子数。
2 结果与分析
2.1 不同质量浓度GA3对楸树种子萌发的影响
将经过质量分数为0.5% K2MnO4溶液消毒0.5 h的楸树种子,分别浸种于100、200、300、400 mg·L-1的GA3溶液中4 h,以正常条件不加植物激素处理作对照。由表1可见:与空白对照组(CK)相比,随着GA3质量浓度不断升高,楸树种子发芽率无论在恒温(25 ℃)条件,还是变温(夜温15 ℃、昼温25 ℃)条件,均呈先上升后下降的趋势;在恒温条件下,当GA3质量浓度为300 mg·L-1时,发芽率达到最大值(52.77%);在变温条件,当GA3质量浓度为200 mg·L-1时,发芽率达到最大值(67.18%);与CK相比,在恒温条件下除了GA3质量浓度为100 mg·L-1,变温条件下除了GA3质量浓度为400 mg·L-1,其余差异均显著。发芽势无论在恒温,还是变温条件下,同样呈先上升后下降趋势;在恒温条件下,当GA3质量浓度为300 mg·L-1时,发芽势达到最大值(38.43%);在变温条件,当GA3质量浓度为200 mg·L-1时,发芽势达到最大值(45.24%);与CK相比差异均显著。发芽指数无论在恒温,还是变温条件下,同样呈先上升后下降趋势;在恒温条件下,当GA3质量浓度为100 mg·L-1时,发芽指数达到最大值(9.13);在变温条件,当GA3质量浓度为200 mg·L-1时,发芽指数达到最大值(12.48);与CK相比,除了恒温条件GA3质量浓度为300 mg·L-1及变温条件GA3质量浓度为100、300 mg·L-1时,差异不显著外,其余均差异显著。

表1 不同质量浓度GA3不同浸种时间的楸树种子萌发结果
注:数据后,同列不同小写字母表示同一浸种时间不同GA3质量浓度处理结果间差异显著(P≤0.05)。
由表1可见:和浸种4 h类似,用GA3浸种8 h后,随着GA3质量浓度不断升高,无论在恒温条件,还是变温条件,种子发芽率、发芽势均呈先上升后下降的趋势;在恒温条件下,GA3质量浓度为300 mg·L-1时,种子发芽率、发芽势达到最大值,分别为63.07%、38.04%,与CK均差异显著;变温条件下,GA3质量浓度为200 mg·L-1时,发芽率、发芽势达到最大值,分别为75.07%、52.86%,与CK均差异显著。在恒温条件下,当GA3质量浓度在200 mg·L-1时,发芽指数达到最大值(9.53);在变温条件下,GA3质量浓度在300 mg·L-1时,发芽指数达到最大值(11.25);无论恒温,还是变温,与CK相比,除了GA3质量浓度为100 mg·L-1外,其余均差异显著。
2.2 不同质量浓度IBA对楸树种子萌发的影响
将经过质量分数为0.5% K2MnO4溶液消毒0.5 h的楸树种子,分别浸种于质量浓度为100、200、300、400 mg·L-1的IBA溶液中4 h,以正常条件不加植物激素处理作对照。由表2可见:在恒温条件下,种子发芽率随着IBA质量浓度的升高不断升高,在IBA质量浓度为400 mg·L-1时,种子发芽率最高(50.45%);在变温条件,种子发芽率则呈先上升后下降的趋势,在IBA质量浓度为300 mg·L-1时,种子发芽率达到最大(81.47%);与CK相比,在恒温条件下除了IBA质量浓度为100 mg·L-1,变温条件下除了IBA质量浓度为400 mg·L-1,其余均差异显著。无论在恒温,还是变温条件下,种子发芽势变化一致,均呈先上升后下降的趋势;当IBA质量浓度为300 mg·L-1时,在恒温和变温条件下,种子发芽势均达到最大值,分别为33.08%、47.32%;与CK相比,除了GA3质量浓度为100 mg·L-1,其余均差异显著。种子发芽指数在恒温条件下随IBA质量浓度升高呈下降趋势,在变温条件下随IBA质量浓度升高呈先上升后下降趋势;在恒温条件下,IBA质量浓度为100 mg·L-1时,种子发芽指数最大(9.47);在变温条件,IBA质量浓度为200 mg·L-1时,种子发芽指数达到最大(13.68);与CK相比,在恒温条件下除了IBA质量浓度为200 mg·L-1、变温条件下除了IBA质量浓度为300 mg·L-1,其余均差异显著。
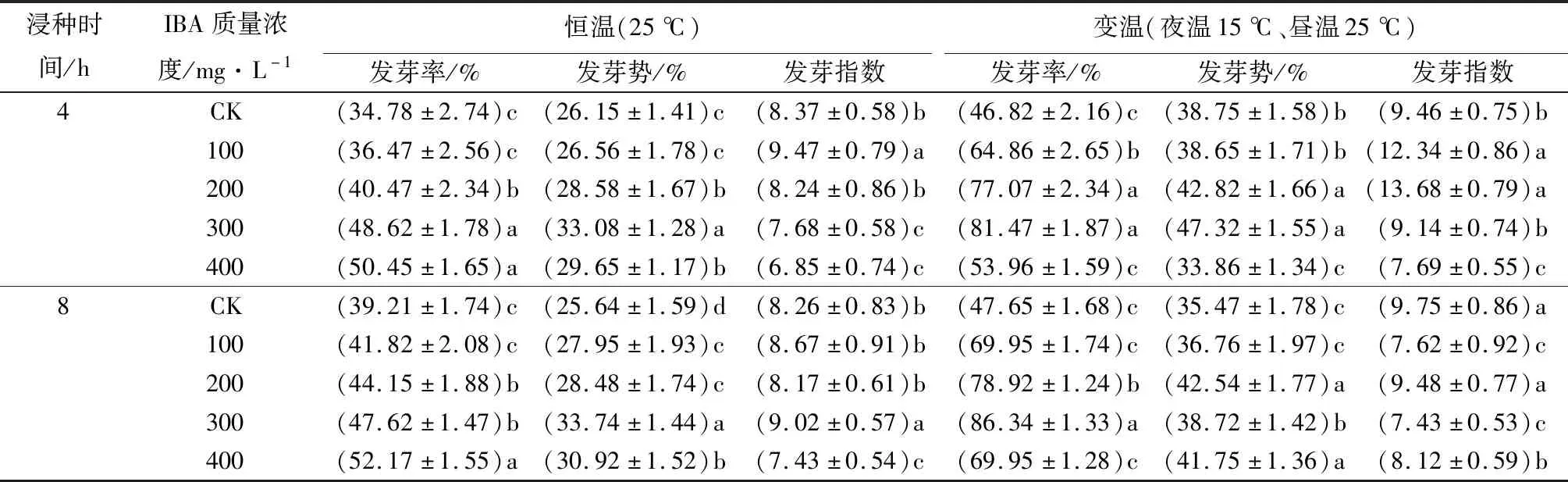
表2 不同质量浓度IBA不同浸种时间的楸树种子萌发结果
注:数据后,同列不同小写字母表示同一浸种时间不同IBA质量浓度处理结果间差异显著(P≤0.05)。
由表2可见:和浸种4 h相同,用IBA浸种8 h后,种子发芽率随着IBA质量浓度升高呈上升趋势;在恒温条件下,IBA质量浓度为400 mg·L-1时,发芽率最高(52.17%);在变温条件下,发芽率则呈先上升后下降的趋势,在IBA质量浓度为300 mg·L-1时达到最大(86.34%);与CK相比,恒温条件下除了IBA质量浓度在100 mg·L-1,变温条件下除了IBA质量浓度在100、400 mg·L-1差异不显著外,其余均差异显著。种子发芽势,无论在恒温还是变温条件下则变化一致,均呈先上升后下降的趋势;在恒温条件下,当IBA质量浓度为300 mg·L-1时发芽势最大(33.74%),与CK相比,在恒温条件下均差异显著;在变温条件下,当IBA质量浓度为200 mg·L-1时发芽势最大(42.54%),与CK相比,除了在变温条件IBA质量浓度在100 mg·L-1差异不显著外,其余均差异显著。在恒温条件下,发芽指数随IBA质量浓度的升高呈先上升后下降趋势,在IBA质量浓度为300 mg·L-1时发芽指数最大(9.02),与CK相比,除了IBA质量浓度在100、200 mg·L-1差异不显著外,其余均差异显著;在变温条件下,发芽指数呈无规则变化,在IBA质量浓度为200 mg·L-1时发芽指数最大(9.48),在IBA质量浓度为300 mg·L-1时发芽指数最小(7.43),与CK相比,除了IBA质量浓度在200 mg·L-1时差异不显著外,其余均差异显著。
2.3 不同质量浓度ABA对楸树种子萌发的影响
将经过质量分数0.5% K2MnO4溶液消毒0.5 h的楸树种子,分别浸种于质量浓度为100、200、300、400 mg·L-1的ABA溶液中4 h,以正常条件不加植物激素处理作对照。由表3可见:与CK相比,随着ABA质量浓度不断升高,无论在恒温还是变温条件下,种子发芽率均随着ABA质量浓度升高而降低;与CK相比,除了IBA质量浓度在100 mg·L-1时差异不显著外,其余均差异显著。种子发芽势、发芽指数的变化规律和种子发芽率相同,无论在恒温还是变温条件下,随ABA质量浓度上升均呈下降趋势,除了IBA质量浓度在100 mg·L-1时差异不显著外,其余均差异显著。

表3 不同质量浓度ABA不同浸种时间的楸树种子萌发结果
注:数据后,同列不同小写字母表示同一浸种时间不同ABA质量浓度处理结果间差异显著(P≤0.05)。
由表3可见:和浸种4 h相比,用ABA浸种8 h后,无论在恒温还是变温条件下,种子发芽率均随着ABA质量浓度的升高而降低,与CK相比,除了IBA质量浓度在100 mg·L-1时差异不显著外,其余均差异显著。在恒温还是变温条件下,种子发芽势同样随着ABA质量浓度的上升呈下降趋势,但与CK相比,均呈现显著水平。种子发芽指数和种子发芽率变化规律相同,无论在恒温还是变温条件下,随ABA质量浓度上升均呈下降趋势,除了IBA质量浓度在100 mg·L-1时差异不显著外,其余均差异显著。
3 结论与讨论
楸树是异花授粉植物,植物雄、雌蕊不在同一朵花中,因此无法自行授粉,单种植1个品种无法为其提供授粉环境,导致坐果率下降,往往只开花不结实,造成种子发芽率低。目前对楸树种子的研究,主要集中在梓醇[17]、脂肪酸含量[18]、黄酮类成分[19]的研究,对楸树种子发芽率的研究较少;对楸树种子发芽率的研究,大部分集中在选种时对种子的处理等,用激素调节来提高种子发芽率的方法却报道较少。本研究选择了3种常用的外源激素,研究其对楸树种子发芽的影响,不仅进行了不同激素对种子萌发的影响,也比较了不同质量浓度、不同浸种时间对种子萌发的影响,为今后楸树种子育苗提供了数据基础。
目前,植物生长调节剂对种子萌发的影响已得到广泛的研究,并取得了较多成果。在解除种子休眠、促进萌发过程中起关键作用的内源信号分子是GA3和IBA,可以启动淀粉酶合成化学信使诱导种子淀粉酶的合成,并提高其活性,加速胚乳中淀粉的水解,促进种胚的生长和种子的萌发[20]。本试验结果表明:对楸树种子各发芽性状有效促进的GA3质量浓度不一致,在低质量浓度下(0~200 mg·L-1),随着GA3质量浓度升高,发芽率无论在恒温(25 ℃)条件还是变温(夜温15 ℃、昼温25 ℃)条件上升,但是超过一定质量浓度之后,发芽率反而下降,发芽势和发芽指数也具有同样的规律,这和刘开业等[21]研究发现高质量浓度GA3对狗牙根(Cynodondactylon)种子的萌发有抑制作用相似;原因是外源激素浸种,并不完全是通过影响种子活力而作用于幼苗生长,而是通过影响内源激素来调节幼苗的生长发育。在恒温条件下,随着IBA质量浓度的升高,发芽率不断增加,而在变温条件下发芽率呈先上升后下降趋势,同时无论恒温还是变温,种子的发芽势和发芽指数均为先上升后下降趋势,这是由于外界温度条件的改变,尤其是在变温情况下,由于IBA质量浓度的升高抑制了种子的萌发。
脱落酸(ABA)是一种较强的植物生长抑制剂,可抑制整株植物或离体器官的生长,在种子萌发、成熟与休眠、果实成熟以及植物响应逆境胁迫中有广泛的生理效应[22]。ABA对生长的作用与IBA、GA3相反,它对细胞的分裂与伸长起抑制作用,抑制胚芽鞘、嫩枝、根和胚轴等器官的伸长生长,本试验也证实了这一点。在恒温和变温条件下,随着ABA质量浓度的升高,不论是浸种4 h还是8 h,种子发芽率、发芽势、发芽指数均显著下降,但是近年来越来越多的观点认为ABA/GAs的阈值范围调控种子的萌发和休眠[23-24],超过阈值上限种子休眠,低于阈值下限种子萌发,但是具体阈值范围尚不清楚,有待进一步深入研究。
