沉淀法制备的紫杉醇白蛋白微粒包封率测定1)
2020-03-26钱佳怡隋小宇潘虹袁橙董岩简白羽
钱佳怡 隋小宇 潘虹 袁橙 董岩 简白羽
(齐齐哈尔医学院,齐齐哈尔,161006)
紫杉醇(PTX)是从红豆杉属植物的树皮和针叶中提取的一种次生代谢产物[1],具有广谱、高效的抗肿瘤效果,尤其是针对非小细胞肺癌、转移性乳腺癌和难治愈性乳腺癌[2]。由于其在水中溶解度极低,很大程度上限制了其临床应用。目前,一些药物载体制剂常用于解决其水溶性问题,例如脂质体、微球、固体脂质纳米粒、乳剂等[3]。
白蛋白微粒是由人或动物的白蛋白制备而成的载药系统[4],多数由人血清白蛋白(HSA)或牛血清白蛋白(BSA)制备而成。白蛋白微粒载药系统,无毒、生物相容性高[5],可提高药物的水溶性[6],起到缓释作用[7]。由于白蛋白载药系统具有以上优点,现在越来越多的将其用于药物制剂,尤其是抗癌药物制剂的研究或临床应用中,如紫杉醇白蛋白纳米粒[8]。由于紫杉醇白蛋白载药系统,不仅能降低药物的不良反应,并且用药前无需进行皮质激素及抗组胺药物的预处理,可直接用药,提高患者用药的顺应性;近年来已经越来越多的应用于卵巢癌、乳腺癌等疾病的临床治疗,成为癌症治疗的一线用药[9]。
目前,白蛋白微粒的制备方法主要有乳化法-挥发法、喷雾干燥法、沉淀法等[10-12]。其中,乳化溶剂挥发法在制备过程中需要用到氯仿等中高毒性的有机溶剂,并且去除有机溶剂耗时长,有残留风险;喷雾干燥法在制备过程中存在粒径不均匀、包封率低等问题[10];而沉淀法操作相对简单,不需使用中高毒性有机溶剂,且重复性较好,是一种环境友好并且高效的方法。目前,对于沉淀法制备白蛋白微粒的研究较少[13]。
包封率是白蛋白微粒制备过程中的一个重要评价指标[14],指被包封入微粒内的药物与体系中药物总量的百分比。目前在沉淀法制备白蛋白微粒载药系统的过程中,包封率的测定主要采用消化法[15]。但消化法在包封率测定过程中需反复离心,操作比较繁琐。有机溶剂萃取法是一种利用药物的溶解性,将难溶性游离药物从体系中萃取出来的一种方法,可以用于脂溶性药物载体系统包封率的测定,操作简单且重现性好,多用于载体药物包封率的测定,但目前很少见到使用该方法测定白蛋白载药系统包封率的相关研究。因此,本课题拟以紫杉醇白蛋白微粒作为模型药物,以有机溶剂萃取法进行包封率的测定。
1 材料与方法
1.1 材料及主要仪器
紫杉醇(大连美仑生物技术有限公司,质量分数≥98%;紫杉醇对照品(大连美仑生物技术有限公司,质量分数≥99%;牛血清白蛋白(大连美仑生物制药有限公司);色谱级甲醇、分析级二氯甲烷(北京百灵威科技有限公司);水为自制超纯水。
JY96-IIN型超声波细胞破碎仪(上海沪析实业有限公司);T6紫外-可见分光光度计(北京普析通用仪器有限公司);高效液相色谱仪(包括AS1000进样器、2000-检测器、PC2001-二元泵、Laballiance工作站,天津市兰博实验仪器设备有限公司)。
1.2 紫杉醇质量浓度测定
吸收波长的选择:取紫杉醇对照品配制为50 mg·L-1的对照品溶液,在200~800 nm范围内进行紫外-可见全波长扫描。
色谱条件[10]:色谱柱为C18(250.0 mm×4.6 mm,5 μm);流动相为V(甲醇)∶V(水)=75∶25;流速为1.0 mL·min-1;进样量为20 μL。
白蛋白微粒的制备:采用沉淀法制备紫杉醇-白蛋白微粒及空白微粒[13]。取处方量PTX溶于适量乙醇作为油相,将BSA分散于适量纯化水中作为水相,在冰水浴下将乙醇迅速注入水相中,超声5 min(超声3 s,间歇3 s),在涡旋下向其中加入BSA质量15%的氯化锌使PTX混悬液与BSA共沉淀,制得PTX-BSA微粒。同法制得空白微粒。
线性范围的考察:取适量紫杉醇对照品,用二氯甲烷稀释定容制备成10、15、20、50、75、100 mg·L-1,按试验设定的色谱条件进样分析,记录色谱图,以峰面积对紫杉醇质量浓度进行线性回归。
精密度:①日内精密度。精密吸取适量储备液,二氯甲烷稀释定容制备成40、50、60 mg·L-1,按试验设定的色谱条件进样分析,分别进样5次,记录色谱图,计算峰面积。②日间精密度。精密吸取适量储备液,二氯甲烷稀释定容制备成40、50、60 mg·L-1,按试验设定的色谱条件连续进样5 d,记录色谱图,计算峰面积。
回收率:精密吸取适量紫杉醇储备液,稀释至紫杉醇质量浓度为40、50、60 mg·L-1,各3份,按试验设定的色谱条件进样分析,计算回收率。
1.3 包封率测定
萃取法测定包封率:精密吸取320 μL紫杉醇白蛋白微粒,加入2 mL二氯甲烷,涡旋5 min,静置15 min,取下层有机相液体[13],过膜后按试验设定的色谱条件进样分析,计算体系中游离的紫杉醇质量(m1)、投药量(m2)。计算包封率(E),E={(m2-m1)/m2}×100%。
游离药物回收率:精密吸取适量紫杉醇储备液,加水稀释至紫杉醇质量浓度为40、50、60 mg·L-1的溶液。取0.32 mL样品溶液加2 mL二氯甲烷,置于离心管中,涡旋5 min,静置15 min。取下层清液过滤,取续滤液,按试验设定的色谱条件进样分析,一式三份,计算回收率。
萃取法加样回收率:精密吸取1 mL空白载体溶液,再精密吸取适量紫杉醇储备液,加水稀释至紫杉醇质量浓度为40、50、60 mg·L-1的溶液。取样品0.32 mL加入2 mL二氯甲烷溶液,置于离心管中,涡旋5 min,静置15 min。取下层清液过滤,取续滤液,按试验设定的色谱条件进样分析,一式三份,计算回收率。
2 结果与分析
在200~800 nm范围内进行紫外-可见全波长扫描,结果显示紫杉醇在227 nm处有最大吸收。因此,高效液相色谱法检测紫杉醇质量浓度时,确定检测波长为227 nm。
线性范围检测结果表明:紫杉醇在10~100 mg·L-1呈良好线性关系,回归方程为A=0.691 3ρ+5.925,R2=0.999 5,式中的A为峰面积、ρ为紫杉醇质量浓度。
日内精密度试验结果表明:低中高3个紫杉醇质量浓度样品进样5次,计算峰面积的相对标准偏差(RSD)分别为0.63%、1.24%、1.62%。
日间精密度试验结果表明:低中高3个浓度样品进样5次,计算峰面积的RSD分别为1.54%、1.60%、1.44%。
回收率试验结果表明:低中高3个紫杉醇质量浓度平均回收率,分别为97.6%、95.8%、101.0%。
低中高3个紫杉醇质量浓度的样品溶液各3份,经二氯甲烷涡旋萃取并过滤后,其滤液中药物的平均回收率分别为94.86%、95.38%、98.61%(见表1)。
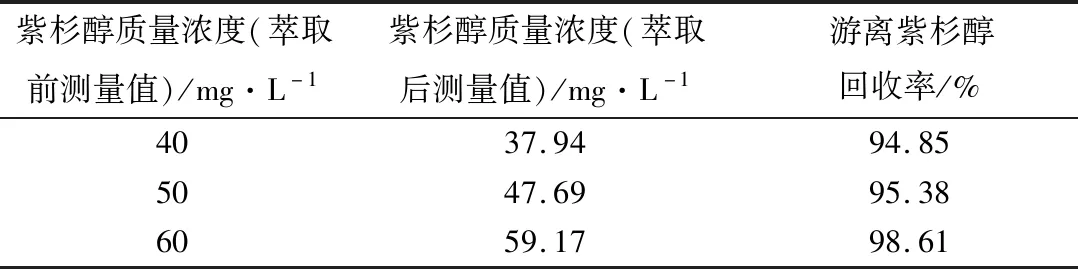
表1 游离紫杉醇回收率测定结果(n=5)
加样回收率试验结果表明:低中高3个紫杉醇质量浓度平均回收率,分别为94.80%、96.92%、101.67%(见表2)。
表2萃取法测定紫杉醇白蛋白包封率的加样回收率测定结果(n=5)
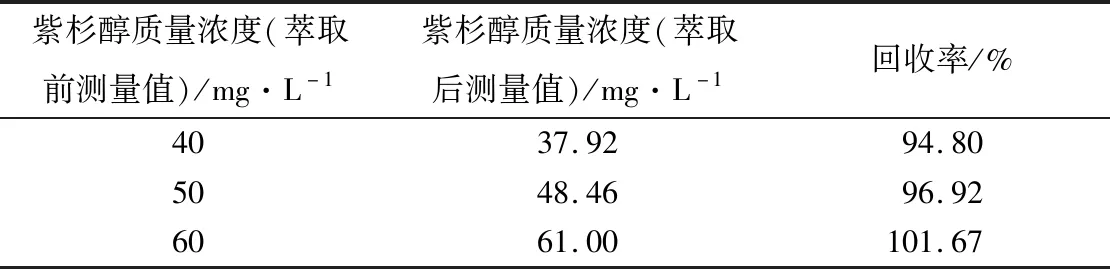
紫杉醇质量浓度(萃取前测量值)/mg·L-1紫杉醇质量浓度(萃取后测量值)/mg·L-1回收率/%4037.9294.805048.4696.926061.00101.67
取3批自制载药微粒样品,按试验设定方法分别测定包封率,每组测定3次,测定结果表明:采用有机溶剂萃取法测定的白蛋白微粒包封率在92.70%~94.10%之间(见表3)。

表3 紫杉醇白蛋白微粒包封率(n=3)
3 讨论与结论
在难溶性药物活性成分的制剂研究中,载体制剂以其特有的优越性得到越来越广泛的关注。其中白蛋白微粒作为一种安全、稳定、降解能力高的药物载体系统,得到了越来越多的应用,而在其进行制备及优化过程中,包封率是一个重要的指标。测定包封率时需要分离游离药物与载体制剂,常用的方法有离心法、消化法等。其中,离心法在测定白蛋白载体药物包封率时,需要通过离心将蛋白微粒与游离药物及蛋白进行分离,重现性较差,结果不稳定。消化法操作较为复杂,使用不方便。有机溶剂萃取法一般用于脂溶性载体药物包封率的测定,其操作简便、分离速度快,且结果较稳定。本试验将该方法用于白蛋白微粒包封率的测定,具有一定的创新性。
在预试验中,曾对萃取法中的有机相进行了初步筛选,包括二氯甲烷、正己烷及氯仿,综合考虑药物在有机相中的溶解度及有机相毒性,最后选择二氯甲烷作为有机相进行萃取。在包封率测定过程中,未与载体结合的药物以游离的状态存在于体系中;在萃取过程中,游离药物被萃取到有机相中,而药物载体不溶于有机相,从而将药物载体与游离药物分开。在涡旋过程中,有轻微乳化现象出现,但结果表明,并未对回收率结果产生影响。在操作过程中,应注意涡旋的时间以及样品与有机相的比例,时间过短游离药物萃取不完全,时间过长则容易造成药物载体破坏,导致药物泄露;样品与有机相的比例则不应过大,比例过大易造成萃取次数增加,操作繁琐。
本试验建立的紫杉醇白蛋白微粒包封率测定方法,操作简单、结果准确、稳定且重现性好,符合方法学要求,对紫杉醇白蛋白微粒的进一步处方优化及质量控制具有一定意义,同时对于其他难溶性药物活性成分的白蛋白载体制剂研究具有一定的参考价值。
